纳米粒介导的曲安奈德递送对治疗糖尿病大鼠视网膜病变的影响
胡 浩,蔡江雄,林 然,江灵莉
0 引言
糖尿病视网膜病变(Diabetic retinopathy,DR)是糖尿病患者晚期的并发症之一,是导致患者视力下降的重要原因[1-2]。糖尿病患者的高血糖导致氧化应激、炎症、血管通透性和视网膜神经变性,最终出现DR[3-5]。DR演变一般经历两个阶段:早期非增殖阶段(NPDR)和晚期增殖阶段(PDR)[2]。NPDR阶段特点是各炎症介质如肿瘤坏死因子α(TNF-α),核因子κB(NF-κB)和细胞间粘黏附分子-1(ICAM-1)在视网膜上的产生增加[6],持续的缺氧和产生这些炎症介质使其发展到PDR阶段。PDR的特点是分泌血管生成介质增强,包括低氧诱导因子-1α(HIF-1α)和血管内皮生长因子(VEGF)的增加,血视网膜屏障的破坏和微血管丛在视网膜毛细血管的形成[7-8]。炎症和血管生成介质的产生导致视网膜胶质细胞的应激反应,其特征是增强胶质纤维酸性蛋白(GFAP)的产生,光感受器细胞功能损伤或光感受器细胞凋亡,最终导致失明[8-9]。因此,DR引起视网膜组织的结构和功能异常,需要治疗干预控制疾病进展。
有研究表明,聚合物纳米粒(NPs)由于其缓释作用,能够提供持续几天甚至几个月的药物分子供给[10]。由于高表面积与体积比,这些传递系统通过细胞内吞机制很容易被细胞内吞,同时也促进药物通过紧密的细胞连接运输[11]。此外,聚合物NPs的组成控制着粒子-组织的相互作用,而粒子组织的相互作用又控制着药物在眼睛局部的时空分布[12],眼组织层对亲水性和疏水性分子具有不同的渗透性[13]。我们假设通过设计纳米输送系统,由于其表面亲水性/疏水性可优先与眼层组织相互作用和发生渗透,从而提高视网膜的药物生物利用度[12]。此外,通过生理屏障的抵抗清除,NPs的大小也决定了局部给药药物的视网膜生物利用度[14]。因此,本研究制备一种基于PCL和PF68形成核壳结构的纳米粒输送系统,包括一个疏水聚已酸内酯核和亲水普朗尼克®F68壳来装载用于包载曲安奈德(TA),评价其在糖尿病(DR)大鼠模型中的有效性。
1 材料与方法
1.1 材料 聚己内酯(PCL)、聚乙丙交酯(PLGA)、聚乳酸(PLA)、pluronic®F-68(PF68)、壳聚糖(CHI)、明胶(GEL)、聚乙烯醇(PVA)、多聚赖氨酸(poly-L-lysine)、链脲佐菌素(STZ)购自阿拉丁;曲安奈德(TA)药购自天津市金汇药业有限公司;胎牛血清购自Thermo scientific。
1.2 NPBs、NPDs的制备 将0.25%(w/w)的PF68 作为水相、0.5%(w/w)的PCL和0.05%(w/w)TA丙酮溶液作为有机相,水相与有机相以2∶1(v/v)比例混合并充分搅拌。制备NPBs时,不加TA,用旋转蒸发仪(上海申顺生物科技有限公司)在低压下蒸发有机溶剂。所形成的胶体悬浮液经过夜搅拌去除残留有机溶剂。然后用去离子水重悬,离心分离NPs,最后用冻干法制得NPBs或NPDs。
1.3 PCL-PF68 NPs的形态学特征、尺寸和Zeta电位 利用扫描电子显微镜(EVO 18)对其表面形貌进行表征(SEM),放大60 000倍和100 000倍观察。采用马尔文激光粒度仪(Zetasizer,Nano ZS90)确定NPBs和NPDs的粒径大小。用于NPs分散的介质是DI水。采用激光多普勒测速与相位分析光散射相结合的方法确定NPs的ζ电位。
1.4 NPs的包载效率和药物负载 为了评估载药NPs的包封效率,将其分别溶于氯仿,在238 nm处用紫外-可见分光光度计记录各自溶液的吸光度。将TA在氯仿中溶解(10~80 μg/ml)绘制的标准曲线来确定。药物负载和包封率的计算公式如下:


1.5 TA装载PCL-PF68 NPs的药物释放动力学 评估在PBS(pH=7.4)中 PCL-PF68 NPs中TA的体外释放动力学。NPDs悬浮于PBS(0.05%,w/v)并放入透析袋(10 kDa),置于15 ml的PBS透析介质中,温度37 ℃。在指定时间点从PBS中取1 ml样品,用紫外分光光度法测定TA浓度。取样后,等量的PBS缓冲液添加以补充介质。用NPs释放的TA浓度表示累积释放,绘制出时间函数。
1.6 PCL-PF68 NPs体外细胞相容性研究 采用角膜上皮细胞系(SIRC)进行NPBs和NPDs的细胞相容性研究。检测不同浓度的NPs(0.25、0.5、1.0、2.0 mg/ml)确认急性和慢性毒性。将细胞(含有10%FBS的DMEM中培养)以3.5×105个细胞/孔的密度接种在96孔板中,于37 ℃下、5%CO2的培养箱中孵育24 h,加入NPs,再孵育24 h以获得急性毒性,并在进行MTT测定之前将其孵育72 h,以获得慢性毒性。MTT法测定吸光度为560 nm,背景吸光度为690 nm。未处理的细胞作为有100%存活率的阳性对照,未添加试验试剂的细胞作为空白对照。相对细胞存活率的计算公式如下(数据取3次测量的平均值):

1.7 DR大鼠模型的建立及分组 雄性Sprague Dawley大鼠,体重(230±14)g,3个月,获自温州医科大学动物实验中心,饲养条件为温度(22±2)℃,相对湿度50%,光照/黑暗周期12 h。对照组大鼠以0.1 mmol/L柠檬酸钠缓冲液(pH 4.5)作为载体,实验组大鼠单次腹膜内注射35 mg/kg STZ(0.1 mmol/L pH 4.5柠檬酸钠缓冲液配制成1% STZ溶液)。STZ注射72 h后通过监测空腹血糖水平>120 mg/d为造模成功。对照组和糖尿病动物均正常饮食,每周记录每只动物的体重和血糖浓度,每周2次向血糖浓度≥350 mg/dl的糖尿病大鼠腹腔注射胰岛素。在10周结束时,将动物随机分成2组(2个时间点:20 d、40 d)。将这些不同时间点的组分成3个亚组:亚组-Ⅰ[糖尿病大鼠对照组-左眼提供PBS(PBS),右眼在PBS(D)基础上提供TA],亚组-Ⅱ糖尿病大鼠实验组-左眼提供安慰剂NPs(NPB),右眼提供TA负载的NPs(NPD)],亚组-Ⅲ[非糖尿病大鼠对照组-左眼和右眼均提供PBS作为滴眼液(对照)]。每天2次应用大约25 μl的滴眼剂(早6∶00和晚17∶00)。治疗持续20、40 d,在两个不同时间点(第21天和第41天)处死大鼠,并将眼球用于组织病理学分析。
1.8 组织病理学分析 在大鼠安乐死之后,将眼球摘出并用于组织病理学分析。将眼球摘出并切成两个半球以除去晶状体和玻璃体液,并置于4%多聚甲醛(PFA)中,固定48 h,包埋在石蜡块中并切片。将切片脱石蜡并在乙醇溶液(100%、95%、70%乙醇)的梯度中水合。视神经头的矢状面取向的中央部分用于测量。切片用苏木精-伊红进行HE染色,并使用显微镜捕获图像。此外,通过image J软件确定所有亚组的视网膜层的厚度之和。
2 结果
2.1 空白PCL-PF68的制备和表征 使用纳米沉淀法成功制备了NPBs和NPDs。NPs的SEM成像表明NPs呈球形,具有光滑的形态(图1A、1B)。纳米粒径测定仪测定结果显示,NPB和NPD的平均流体动力学直径分别为(163±4)nm和(184±2)nm(图1C),尺寸均匀,多分散性低。NPBs和NPDs的ζ电位分别为(-21±5)mV和(-13±1)mV(图1D)。
2.2 NPs的载药量 NPDs的包封率为60%,载药量为(60±5)μg/mg。
2.3 TA负载的PCL-PF68 NPs药物释放动力学 药物释放动力学结果显示,在最初的7 d内,释放了约60%的药物,然后在接下来的18 d内持续释放(图2A)。初始释放后持续释放,在20 d内释放80%的药物。
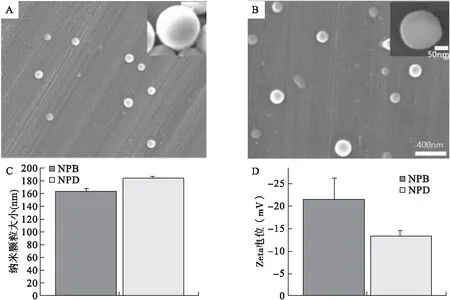
图1 TA负载(NPD)和空白(NPB)PCL-PF68 NPs的表征
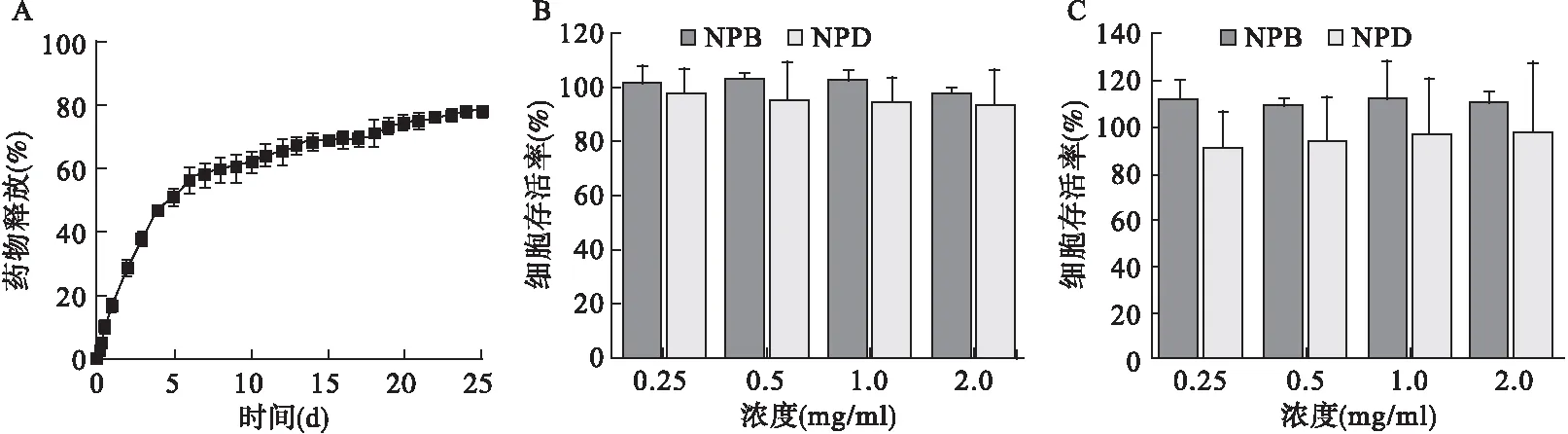
图2 TA负载(NPD)的药物释放及细胞相容性
2.4 PCL-PF68 NPs体外细胞相容性研究 在24 h 暴露的试验浓度下,NPBs、NPDs的细胞存活率均为100%,表明NPBs和NPDs的细胞相容性(图2B)。与NPBs孵育72 h后,细胞活力超过100%,而NPDs细胞活力为92%±8%。见图2C。
2.5 组织病理学分析 不同滴眼液治疗后,观察视网膜组织病理。HE染色的视网膜图像显示,滴眼治疗20 d后,各治疗组的视网膜层厚度比较差异无统计学意义(图3A、图3B)。然而,治疗40 d后,与糖尿病组(PBS、NPB和游离药物)相比,非糖尿病对照组和NPD治疗的眼睛显示出更厚的视网膜层(图3A、图3C)。此外,NPD处理组和非糖尿病对照组动物眼睛的厚度相当。
3 讨论
DR已成为我国4大致盲眼病之一。TA作为一种非水溶性的糖皮质激素,具有强大的抗炎作用,其用于治疗DR主要是能够降低炎症血管的渗透性,稳定血眼屏障[15]。但是由于眼部特有的解剖结构,常规眼部制剂一般很难达到视网膜发挥作用,用药受到限制[16]。具有控释性的纳米粒子在眼部视网膜疾病中比常规治疗的效果更好,能保持有效的药物治疗浓度,有效抑制新生血管,且对眼组织无毒性作用[17-19]。
为此,我们通过设计纳米输送系统,提高视网膜的药物生物利用度[12]。本研究使用PCL和PF68形成核壳结构的纳米粒输送系统用于包载TA,成功制备了球形NPBs和光滑形态的NPDs,结果表明,两亲性PF68分子在制备过程中稳定了疏水性PCL NPs。PF68的稳定作用可能是由于PF68中存在PPO和PEO单元。PPO单元与疏水性PCL链相互作用并使PEO链可与水相互作用,以形成稳定的核-壳NPs[20]。此外,NPDs的Zeta电位略有正向变化,可能是由于NPs表面存在中性TA分子。同样,PCL核心的疏水性质为疏水性药物TA提供了最佳包封效率,这可归因于PCL和TA之间的疏水相互作用。
药物的初始释放是由NPDs表面吸附药物引起的。研究表明,药物的持续释放是由于PCL在水介质中的降解速度较慢导致胶囊药物的缓慢释放[10]。我们的研究结果与降解动力学数据一致,表明在初始时间点,NPs的降解速度较慢。推测聚合物降解导致水分子渗透到NPs的大部分中,进而导致药物溶解和扩散。
由于NPDs的最终应用涉及与眼组织接触,因此,其所需的浓度应显示治疗效果,同时提供最小或无细胞毒性作用。因此,通过将其以递增浓度暴露于SIRC细胞系的2个持续时间,24 h(急性细胞毒性)和72 h(慢性细胞毒性)来研究NPs的细胞相容性。本研究结果显示,NPBs暴露72 h后的存活率较高,可能是由于纳米粒诱导的氧化应激导致细胞在与NPBs孵育时增殖增强所致[21]。此外,NPDs孵育后细胞活力下降(虽然不明显),可以归因于TA的抗增殖作用[22]。组织病理学结果表明,用NPDs处理改善了视网膜结构的完整性。这可能是由于药物输送系统在视网膜上呈现更高浓度的TA,会减少炎症、VEGF分泌和内皮细胞增殖,从而提高治疗效果。
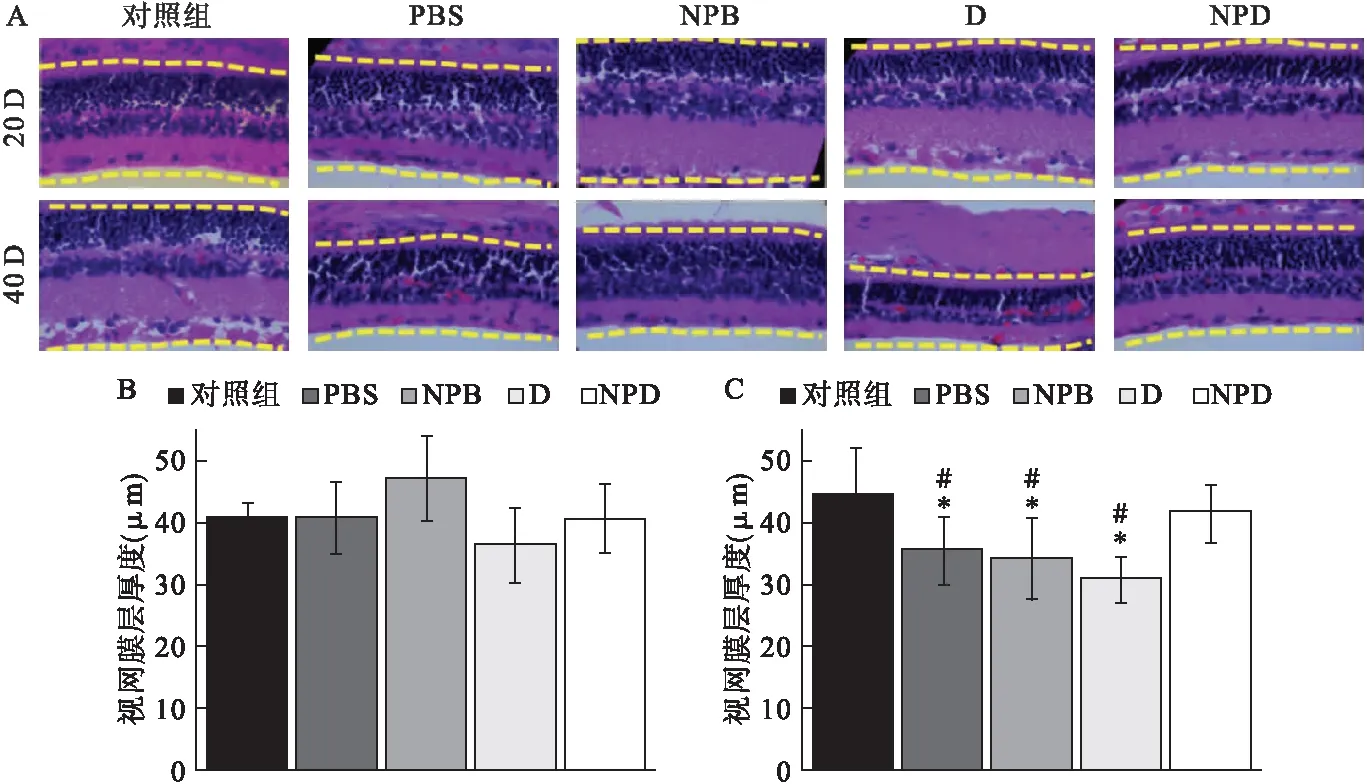
图3 不同滴眼剂处理20、40 d后大鼠视网膜的组织病理学分析
4 结论
综上所述,TA负载的PCL-PF68核-壳纳米粒在作为滴眼剂施用时将TA递送至视网膜,这是向眼组织施用药物的无创且安全的模式,其避免了与玻璃体内注射相关的缺点。这种将TA以治疗浓度传输到视网膜的能力不仅能减少炎症,还能改善DR大鼠视网膜的结构和功能活性。因此,TA负载的PCL-PF68核-壳纳米粒可用于大鼠DR的无创性治疗,并且可以在诸如灵长类动物的高等动物中进一步评估后外推至人类。因此,本研究表明,基于聚合物纳米粒的滴眼剂制剂有可能被开发为用于治疗多种视网膜疾病的平台技术。

