标本离体固定时间对荧光原位杂交技术检测乳腺浸润性导管癌HER2基因的影响▲
詹晓芬 王少洪 况丽平 邱晓阳 李 帆
(广东省汕头市中心医院病理科,汕头市 515031,电子邮箱:2565458852@qq.com)
乳腺癌是严重危害我国女性健康的恶性肿瘤,每年新增病例约21万,死亡率近10/10万[1]。《乳腺癌HER2检测指南(2014版)》中明确指出,所有乳腺原发性浸润癌必须检测人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)[2]。规范化的标本离体固定时间是确保乳腺浸润性导管癌HER2基因检测结果的关键,但在实际临床诊疗工作中并没有得到真正的重视。目前国内仅有少许文献报告了标本离体不同固定时间检测对细胞形态[3]、胃癌HER2检测结果的影响[4],尚未见关于不同标本离体固定时间对乳腺浸润性导管癌HER2基因扩增效果影响的报道。本研究通过收集不同的离体时间段内固定的乳腺浸润性导管癌标本,采用荧光原位杂交(fluorescenceinsituhybridization,FISH)技术检测HER2基因的表达情况,并分析不同离体时间乳腺浸润性导管癌标本间HER2基因表达和扩增情况的差异,为优化乳腺浸润性导管癌HER2基因检测流程中规范标本离体固定时间提供参考。
1 材料与方法
1.1 试剂与仪器 HER2探针(生产批号:2016002、2016012、2017010、2018003)由北京金菩嘉医疗科技有限公司生产,其是含有HER2基因/第17号染色体着丝粒(CEP17)的双色探针。10%中性缓冲福尔马林固定液(生产批号:16021603、16091905、17062201、18011705)由广州维格斯生物科技有限公司生产。Tissue-Tek®VIPTM电脑全封闭脱水机、Tissue-Tek® Y0213990044全自动染色封片机均购自日本樱花公司;Leica RM2135石蜡切片机由德国徕卡公司生产;Olympus BX51荧光显微镜由日本奥林巴斯株式会社生产;S500-24荧光原位杂交仪由美国ThermoBrite公司生产。
1.2 标本来源及分组 选择2016年5月至2018年6月间在我院就诊的、未接受过任何治疗的原发性乳腺浸润性导管癌患者116例,乳腺癌的诊断依据参考乳腺肿瘤最新分类标准[5]。常规石蜡切片、伊红-苏木精染色流程参照文献[6]进行。将每例患者送检的同一病变部位组织呈书页状切开成5份,根据标本的不同离体时间,将标本分别编入A、B、C、D、E组,各组标本离体时间分别为5 min、30 min、60 min、90 min、120 min。
1.3 方法
1.3.1 FISH法检测乳腺浸润性导管癌组织HER2基因:针对各组对应的标本离体固定时间,采用10.0%中性缓冲福尔马林固定液将各组标本固定24 h后制作常规组织切片。按文献[7-9]进行FISH检测。为保证实验的可信度,实验过程设置了阴、阳性对照。
1.3.2 HER2基因检测结果的判定标准[2]:(1)HER2/CEP17比值>2.0时,或HER2与/CEP17比值<2.0,但平均HER2拷贝数/细胞≥6.0均判为HER2阳性;(2)HER2/CEP17比值<2.0且平均HER2拷贝数/细胞<4.0时为HER2阴性。
1.3.3 观察指标:(1)荧光显微镜下不同离体固定时间乳腺浸润性导管癌组织的形态学表现。(2)不同离体固定时间乳腺浸润性导管癌组织HER2基因阳性检出情况。
1.4 统计学分析 采用SPSS 22.0软件对数据进行统计分析。计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组标本荧光镜检结果 荧光显微镜下,A、B、C组的细胞轮廓完整、背景干净、探针定位精准,橘红/绿色荧光信号呈成簇状(见图1A~图1C)。D、E组的细胞轮廓逐渐模糊,可见细胞碎片、核溶解甚至细胞融合,荧光信号不规则甚至消失,橘红/绿色荧光信号强度及数量较A、B、C组减弱、减少(见图1D、图1E)。
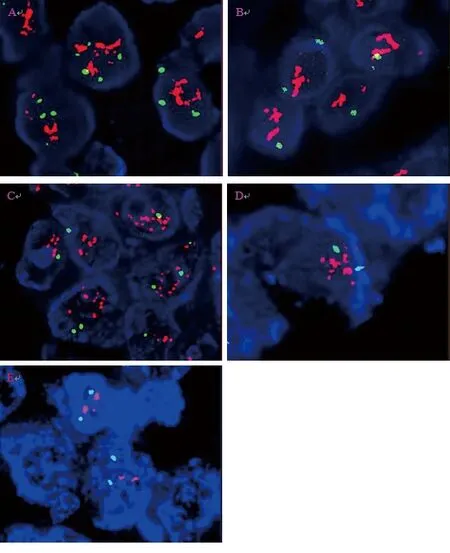
图1 各组标本HER2基因荧光镜检结果(FISH法,×1000)
注:细胞核为深蓝色荧光信号,CEP17探针为绿色荧光信号,HER2探针为橘红色荧光信号。A~E分别是A~E组乳腺浸润性导管癌组织荧光镜检图像。
2.2 各组标本HER2基因阳性检出情况 A~E组标本中HER2基因的阳性检出率分别为28.5%(33/116)、28.5%(33/116)、26.7%(31/116)、15.5%(18/116)、8.6%(10/116)。各组HER2基因的阳性检出率比较,差异有统计学意义(χ2=22.33,P<0.001);进一步分析结果显示,A、B、C组HER2基因阳性检出率均高于D、E组(均P<0.05)。
3 讨 论
HER2是一种原癌基因,与乳腺癌的发生、发展、临床治疗与疾病预后密切相关[10-11]。在组织标本的制备过程中,规范的标本离体固定时间是保证乳腺浸润性导管癌HER2基因检测结果准确性的基础,因此,探讨不同离体固定时间对FISH法检测HER2基因的影响具有重要意义。
本研究中,A、B、C组荧光显微镜检的细胞轮廓完整性、背景干净度明显优于D、E组,且橘红/绿色荧光信号强度及数量呈逐渐下降或者减弱的趋势;而在对不同离体固定时间标本HER2基因阳性检出率的分析中,我们发现各组乳腺浸润性导管癌组织的HER2基因阳性检出率具有差异,且A、B、C组HER2基因阳性检出率均高于D、E组(均P<0.05),而A、B、C组间阳性检出率比较无差异(P>0.05),提示采用FISH法检测乳腺浸润性导管癌HER2基因时,标本离体固定时间在5~60 min内的检测结果相对真实、稳定,而标本离体固定时间超过60 min则可能引起偏差。我们认为出现这一现象的原因可能是随着标本离体固定时间的延长,未及时固定的组织可发生自溶及腐烂,细胞内各种成分发生变性、碎裂,部分DNA结构开始出现破坏、消失,出现细胞碎片、融合、非特异着色、荧光探针强度数量及定位异相等现象。
本研究结果显示,A~C组乳腺浸润性导管癌组织HER2基因阳性检出率为26.7%~28.5%,与相关研究[12-14]结果相似。尽管A~C组HER2基因阳性检出率差异无统计学意义,但C组比A、B组均少了2例阳性病例,这可能是因为随着标本离体时间的增长,DNA结构破坏的现象越来越明显,从而导致HER2基因阴性的检测结果。因此,我们认为在采用FISH法检测乳腺浸润性导管癌HER2基因时,标本离体固定时间以30 min内为佳,最长不应超过60 min。
综上所述,标本离体固定时间可影响FISH法检测乳腺浸润性导管癌HER2基因的结果,标本离体固定时间以30 min内为佳,最长不应超过60 min。本研究存在一定局限性,如研究时限短、样本量偏小等,下一步我们将加大样本量和延长研究时限来验证其结论。

