耐热克鲁维酵母和粟酒裂殖酵母顺序接种发酵对美乐干红葡萄酒品质的影响
王玉华,盛文军,李 敏,米 兰,蒋玉梅,王 婧*
(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃省葡萄与葡萄酒产业技术研发中心,甘肃 兰州 730070)
近几年,中国已经成为葡萄酒的消费大国,但对于进口葡萄酒的过度依赖,使我国本土葡萄酒产品面临严峻的市场竞争[1]。目前,与国外优质干红葡萄酒相比,我国葡萄酒同质化严重,各产区、各企业产品的质量层次均一,特点、个性不突出,无法满足现在消费者对多元化和多样化的需求[2]。西部作为我国优质葡萄酒产区,其干红葡萄酒在品质上依然存在色度较浅、颜色稳定性不佳、产地特征不明显等诸多问题[3],因此不断提升我国葡萄酒品质是葡萄酒产业目前亟待解决的问题。
葡萄汁发酵是一个复杂的生物化学过程,酿酒酵母(Saccharomyces cerevisiae)在乙醇发酵中起着决定性作用。然而,近几年研究发现,一些非酿酒酵母(non-Saccharomyces)对葡萄酒香气的复杂性和风格的独特性方面具有积极影响[4-5]。因此利用优选的非酿酒酵母进行多菌种协同发酵,揭示其对干红葡萄酒品质的影响,对解决葡萄酒产品缺陷和品质提升具有十分重要的意义。
粟酒裂殖酵母(Schizosaccharomce spombe)是一株裂殖属的非酿酒酵母,具有较高的乙醇发酵能力和苹果酸转化能力[5],其作为非酿酒酵母已经被成功用于朗姆酒和棕榈酒的发酵生产[6];国际葡萄与葡萄酒组织已允许其作为生物降酸剂在葡萄酒中使用;已有研究表明[7],S. pombe可代谢产生含量较高的吡喃型花色苷、甘油和一些特征性香气物质,因此在葡萄酒发酵方面具有纠正颜色参数、提高香气复杂性等应用潜力。耐热克鲁维酵母(Lachancea thermotolerans)是一株能够代谢产生乳酸的非酿酒酵母,具有增加酒体酸度、降低pH值的能力[8]。有研究指出L. thermotolerans在不同条件下能够使葡萄酒中乳酸含量从0.23 g/L增加到9.6 g/L,然而L. thermotolerans具有中等乙醇发酵能力,不能单独完成葡萄汁的乙醇发酵,必须与发酵能力较强的酵母菌共同作用来完成乙醇发酵[9]。Benito等[10]利用L. thermotolerans与S. cerevisiae共同发酵来探索其对西班牙南部葡萄产区的应用效果,其结果表明L. thermotolerans在提高葡萄酒乳酸含量、甘油含量、增加挥发性香气物质方面有显著效应。然而,微生物菌种因地域环境的不同和发酵基质的差异其作用结果也有很大差异[11]。目前国内对S. pombe和L. thermotolerans在葡萄酒发酵中的应用研究尚鲜见报道。
本研究以甘肃武威葡萄酒产区美乐葡萄为原料,分别采用S. cerevisiae和S. pombe单独接种发酵以及L. thermotolerans与S. pombe顺序接种发酵的方式酿造美乐干红葡萄酒,研究其顺序接种方式对美乐干红葡萄酒理化指标、主要香气物质的种类、含量及风味品质的影响,以期建立一种多菌种发酵工艺模式,为利用非酿酒酵母提升干红葡萄酒品质提供技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
美乐葡萄于2016年9月采自甘肃省武威市民勤县夏博览葡萄酒庄园,含糖240 g/L(以还原糖计)、可滴定酸7.30 g/L(以酒石酸计)。
1.1.2 菌种与培养基
S. pombe:菌株SP-70购于北京北欧博伟生物技术有限公司(菌种保藏号SP-70)。L. thermotolerans:菌株LTA购于中国工业微生物菌种保藏管理中心(菌种保藏号33099);菌株LTB购于北京北欧博伟生物技术有限公司(菌种保藏号2.4066);菌株LTC由安琪酵母公司提供。S. cerevisiae:CECA酿酒酵母活性干粉,安琪酵母公司提供;酒酒球菌(Oenococcus oeni):OMEGA酒酒球菌活性干粉,购于法国Lallemand公司。
YPD液体培养基(均为质量分数):葡萄糖2%、蛋白胨2%、酵母浸粉1%;YPD固体培养基(均为质量分数):葡萄糖2%、蛋白胨2%、酵母浸粉1%,琼脂2%;赖氨酸培养基购自青岛高科技工业园海博生物技术有限公司。
1.1.3 试剂
氯化钠、醋酸、醋酸钠、无水碳酸钠、盐酸、氢氧化钠、无水葡萄糖、一水合没食子酸(均为分析纯) 天津市科密欧化学试剂有限公司;L-苹果酸、L-乳酸(均为色谱纯) 上海源叶生物科技有限公司;斐林试剂、次甲基蓝指示液等按照GB/T 603—2002《化学试剂试验方法中所用制剂及制品的制备》配制。
1.2 仪器与设备
160350 D型沸点测定仪 法国Dujardin公司;Genesis 10s紫外-可见分光光度计、TRACE1310-ISQ气相色谱-质谱联用仪 法国Salleron公司;TG-WAX气相色谱柱、Ultimate 3000高效液相色谱仪、BDS HYPERSIL C18液相色谱柱 美国Thermo Scientific公司;SW-CJ-2FD洁净工作台 苏净集团苏州安泰空气技术有限公司;500051 S立式高压灭菌锅 上海申安医疗器械厂;PHS-3 C pH计 上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 发酵实验
1.3.1.1 菌种培养
将各供试菌株分别接种于YPD液体培养基中,28 ℃培养24 h,再以1%的接种量接种于YPD液体培养基中28 ℃培养24 h,然后进行酵母菌接种实验。
1.3.1.2 发酵接种方案
将采收的美乐葡萄果实除梗破碎后加入20 mg/L果胶酶,常温浸渍24 h,取澄清汁并装入1 L玻璃罐中,装液量为70%,100 ℃水浴10 min[10],冷却后进行接种处理。
接种处理:将扩培的3 株L. thermotolerans菌液以2%接种量分别接种于葡萄汁中(初始菌体数量为106CFU/mL),96 h后分别以2%接种量接入S. pombe菌液进行混合菌种发酵(接种后S. pombe初始菌体数量106CFU/mL);将扩培的S. pombe菌液以2%接种量接种于葡萄汁中进行单一菌种发酵(初始菌体数量为106CFU/mL);实验以S. cerevisiae菌液单一发酵作为对照(初始菌体数量也为106CFU/mL)。接种后于25 ℃控温发酵;每处理重复3 次。
当残糖量低于4 g/L时,处理组酒样中添加60 mg/L的SO2
[12](以偏重亚硫酸钠的形式)终止发酵并转入灭菌的棕色玻璃罐中满罐陈酿。对照组酒样乙醇发酵结束后,按0.02 g/L的添加量接入OMEGA酒酒球菌启动苹果酸-乳酸发酵(malolactic fementation,MLF),利用纸层析法检测苹果酸减少和乳酸的生成监测发酵进程[13],当苹乳发酵结束,则取各发酵试样检测理化指标。所有酒样低温贮存,陈酿4 个月后对各发酵组取样检测香气成分。
1.3.2 指标测定
1.3.2.1 葡萄酒理化指标测定
总糖、乙醇体积分数、总酸和挥发酸等理化指标参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定;色度、色调参照Somers等[14]的方法进行测定。
1.3.2.2 苹果酸、乳酸分析
参照Buglass[15]和Pérez-Ruiz[16]等方法,并略作修改,采用高效液相色谱仪进行测定。
色谱条件:色谱柱BDS HYPERSIL C18(250 mm×4.6 mm,5 µm);二极管阵列检测器;流动相0.005 mol/L硫酸溶液;流速0.5 mL/min;柱温30 ℃;进样量20 µL;检测波长210 nm。
定性:将配好的苹果酸、乳酸单一标准溶液分别进样,确定各自的出峰时间,根据保留时间进行定性。定量:将配好不同浓度的苹果酸和乳酸混合标准液分别进样,进行定量分析。以不同混合酸标准液的浓度为横坐标,出峰面积为纵坐标绘制标准曲线,得到苹果酸、乳酸的标准曲线方程。
样品测定:取2 mL待测酒样,加入4 mL水,于10 ℃、8 000 r/min的条件下高速离心10 min。然后取上清液用0.45 μm的无菌滤膜过滤后进样。根据标准曲线方程分别计算出酒样中苹果酸、乳酸的含量。
1.3.2.3 CO2质量损失的测定
参照周丽华等[17]的方法,略作修改。从葡萄汁接入菌种当天开始,每隔24 h对发酵瓶进行称质量并记录数据,2 个时间点之间的质量差即为CO2质量损失(即CO2的释放量)。以CO2质量损失为纵坐标,发酵时间为横坐标,绘制CO2生成曲线。
1.3.2.4 细胞生物量测定
参照Gobbi等[8]的方法,略作修改。单独接种S. cerevisia和S. pombe的发酵酒样分别用YPD固体平板进行菌落计数。S. pombe和L. thermotolerans顺序发酵的酒样先用YPD平板进行培养计总数,再用赖氨酸培养基根据形态差异对L. thermotolerans进行计数,差值即为S. pombe的生物量。
1.3.2.5 挥发性化合物测定
取8 mL酒样于顶空瓶中。加入2.4 g NaCl及10 μL内标物2-辛醇,并加入磁力搅拌转子,密封并摇匀,然后将样品放于40 ℃磁力搅拌器中,平衡30 min,插入萃取头于40 ℃恒温水浴锅中磁力搅拌吸附富集30 min。
气相色谱-质谱条件:进样温度250 ℃,解吸5 min,不分流进样,10 min后开启分流阀;载气为高纯氦气;流速1 mL/min;程序升温:初始温度40 ℃,3.5 ℃/min升至180 ℃,保持15 min;连接杆和离子源温度分别为180 ℃和200 ℃;扫描范围m/z 50~350。
定性:香气成分利用MS全离子扫描模式下的总离子流图谱,依据色谱保留时间和质谱信息、NIST08标准谱库比对结果以及参考相关文献相结合的方法进行定性分析。定量:采用内标法进行定量分析。

1.3.3 感官分析
选择10 名经过专业培训的甘肃农业大学葡萄酒专业的老师及研究生(6 名女性和4 名男性)对所酿葡萄酒进行感官评定。感官评价的场所在本学院的品酒室进行。供品尝酒样在14 ℃下贮存,以随机顺序提供给品尝者。品鉴从视觉(颜色强度、色调)、香气(香气强度、花香、果香、异味)和风味(甜味、酸味、酒体、余味长短)共10 个属性方面进行,用8 分结构化数值进行量化,0~8 分表示感官逐渐增强。
1.4 数据分析
采用Excel 2010 进行数据处理,SPSS 22.0对数据进行单因素方差分析,利用Duncan多重比较在置信区间0.05下对数据进行差异显著性分析,对不同处理酒样的香气化合物进行主成分分析。
2 结果与分析
2.1 基本理化指标

表 1 供试酒样乙醇发酵结束时理化指标Table 1 Physicochemical indices of wine samples at the end of alcoholic fermentation
从表1可以看出,各处理组总糖质量浓度均小于4 g/L。S. pombe单独接种发酵的酒样与对照酒样相比,其乙醇体积分数无显著差异,而L. thermotolerans与S. pombe顺序接种发酵的3 个处理组与对照组相比其乙醇体积分数显著降低,这一结果说明L. thermotolerans与S. pombe顺序接种在乙醇发酵能力方面低于S. cerevisiae单独接种发酵。挥发酸含量是判断葡萄酒健康状态或腐败情况的指标[18],同时根据GB/T 15037—2006要求挥发酸不能高于1.0 g/L,顺序接种的3 个处理组与对照组相比挥发酸含量均低于国标要求,相比挥发酸质量浓度显著降低了0.11~0.16 g/L。另外,用S. pombe单独接种的酒样总酸质量浓度显著低于对照组酒样,而顺序接种的3 个处理组总酸含量与对照组相比增加了0.96~1.97 g/L。pH值的高低与总酸结果相对应,顺序发酵使pH值显著降低0.45~0.59。关于颜色指标方面,用S. pombe单独接种发酵的酒样色度值最高,有S. pombe参与的3 组顺序接种酒样的色度值也显著高于对照组。S. pombe参与发酵的处理酒样与对照组酒样的色调值相比显著降低,说明处理组酒样比对照组更能呈红色色调。
2.2 苹果酸、乳酸含量分析

图 1 供试酒样苹果酸、乳酸生成量Fig. 1 Production of malic acid and lactic acid of sample wines
单独接种S. cerevisiae的对照组在MLF后进行苹果酸、乳酸含量测定,其他处理组的酒样于乙醇发酵结束后进行苹果酸、乳酸含量测定。由图1可知,S. pombe单独发酵和顺序发酵的酒样中苹果酸含量与接入乳酸菌进行苹乳发酵的对照组相比无显著差异。3 组顺序接种处理组酒样中乳酸质量浓度差异不显著(2.46~2.86 g/L),但均显著高于对照组(P<0.05),顺序发酵酒样在不进行MLF的情况下,减弱了口感尖锐的苹果酸增加了口感柔和的乳酸,表明L. thermotolerans与S. pombe顺序接种发酵具有代替苹果酸-乳酸发酵的潜在可能性。
2.3 CO2质量损失分析
在葡萄汁乙醇发酵过程中CO2质量损失可代表菌株的发酵力,CO2质量损失速率可作为菌株的乙醇发酵速率[17]。由图2可知,对照组在第8天完成乙醇发酵,单独接种S. pombe酒样在第16天完成乙醇发酵,两菌株CO2总质量损失相似,说明S. pombe与S. cerevisiae菌株具有相似的发酵能力,但发酵速度较为缓慢。顺序接种的3 组处理酒样在接入L. thermotolerans菌株24 h内均能启动发酵,当第4天接入S. pombe后,发酵速率提升,于第12天后发酵速率逐渐缓慢,最终在第16天时CO2释放基本停止完成发酵。
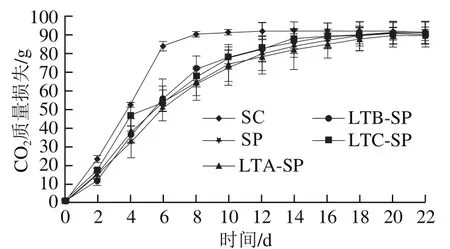
图 2 供试酒样CO2质量损失Fig. 2 CO2 production of sample wines
2.4 生物量分析
图3A为单独接种S. cerevisiae和S. pombe的酒样中其菌体数量的变化情况,至乙醇发酵结束,S. pombe和S. cerevisiae的生长动态基本相似,最初菌体数量增长快速,随后略有下降,从发酵第6天到乙醇发酵结束的第16天,其菌体数量均稳定在106CFU/mL。3 组顺序接种发酵过程中各处理酒样中两种非酿酒酵母生长动态见图3B~D。3 株L. thermotolerans在顺序接种发酵过程中其菌体生长趋势相似,自接种之后的2 d内,菌体数量快速增加,在2~4 d内菌体数量达到最大,当接入S. pombe后的第2天,L. thermotolerans菌体数量开始迅速减少并逐渐消失,菌株LTA(图3B)在第10天全部消亡,菌株LTB(图3C)和菌株LTC(图3D)均在第12天时无法检测到其活细胞存在,而S. pombe在第16天乙醇发酵结束时菌体数量依然保持在105CFU/mL。
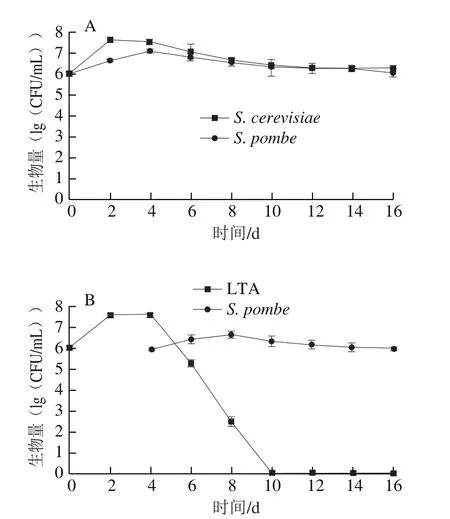

图 3 供试酒样生物量Fig. 3 Yeast population during wine fermentation
2.5 挥发性香气化合物分析
葡萄酒的酿造过程是一个复杂的生物化学反应,其香气复杂多变,主要来源有葡萄品种,酵母发酵与陈酿过程。实验所得酒样中共检测出77 种香气化合物,包括26 种酯类(约占香气总量的27.89%),16 种醇类(约占香气总量的54.64%),15 种有机酸(约占香气总量的15.53%),12 种萜烯类(约占香气总量的0.90%),7 种其他类化合物(约占香气总量的1.03%)。与仅用S. cerevisiae发酵的对照组先比,顺序接种处理组的酯类、醇类和酸类的含量分别下降了38.46%~49.34%、13.36%~19.42%、46.84%~49.71%,种类相差不大。而萜烯类和其他类化合物在种类和含量上均有所增加,其含量要比对照组增加32.47%~42.65%。

表 2 供试酒样香气成分及含量Table 2 Concentrations of aroma components in wines

续表2

续表2
2.5.1 酯类化合物
酯类物质主要通过酵母代谢以及酒中的酯化反应产生,通常赋予葡萄酒一定的花香、果香[28]。由表2可以看出,本实验中各发酵酒样所检测到酯类物质共26种,其酯类化合物总量有所不同。L. thermotolerans和S. pombe顺序发酵的酒样酯类化合物质量浓度在2 310.63~2 807.09 μg/L,与单独用S. cerevisiae接种发酵4 561.44 μg/L相比降低了38.46%~49.34%,单独用S. pombe接种的酒样酯类总量为2 561.11 μg/L,与3 组顺序发酵酒样含量接近。在3 组顺序发酵酒样中贡献较大的物质有正己酸乙酯(550.20~569.42 μg/L)、辛酸乙酯(613.05~643.00 μg/L)和癸酸乙酯(477.88~828.85 μg/L),虽然其含量均低于对照组,但均超过相应阈值,对葡萄酒果味香气有积极贡献。
2.5.2 高级醇类化合物
葡萄酒中高级醇类物质主要通过酵母发酵过程中糖代谢和氨基酸转化而成[29]。有研究显示当高级醇质量浓度小于300 mg/L时,对于葡萄酒的感官品质具有积极作用[30]。本实验中各发酵酒样检测到的高级醇类物质总量由高到低排列顺序为S. cerevisiae纯种发酵酒样(7 241.44 μg/L)、L. thermotolerans和S. pombe顺序发酵酒样(5 834.91~6 274.28 μg/L)、S. pombe纯种发酵酒样(3 545.40 μg/L)。其中,单独用S. pombe接种试样中高级醇含量与对照S. cerevisiae相比显著下降,顺序接种酒样与对照相比也下降了13.36%~19.42%。说明S. pombe参与发酵的试样,高级醇总量均有所下降[31]。各供试酒样个别物质含量也存在差异,3 组顺序发酵的处理组苯乙醇含量较对照组高,且超过感官阈值,为葡萄酒提供玫瑰等花粉香气。
2.5.3 酸类化合物
酸类化合物是酵母发酵过程中代谢的副产物,主要在乙醇发酵和苹乳发酵过程中产生,葡萄酒中通常表现出来的奶酪味以及脂肪味与葡萄酒中存在的酸类化合物密切相关[32-33]。由表2可知,各发酵试样酸类化合物种类相差不多,用S. cerevisiae单独接种发酵的酒样酸类化合物质量浓度(2 637.04 μg/L)高于顺序发酵酒样(1 326.21~1 401.81 μg/L)。顺序发酵酒样与对照相比酸类化合物含量降低了46.84%~49.71%,各发酵酒样中单个有机酸类物质在含量上存在一定差异,但排在前三位的有机酸类物质相同,分别为辛酸、癸酸、己酸。
2.5.4 萜烯类化合物
萜烯类化合物来源于葡萄果实本身,主要以糖苷键合态形式存在,酿造过程中可在糖苷酶作用下转变为挥发性的游离态香气化合物,从而赋予葡萄酒品种香气特征[34]。本实验处理组中所检测到的萜烯类物质的种类和含量均高于对照组,对照组中仅检测到橙花醇和叶醇。单独接种S. pombe的酒样中萜烯类物质总量达到120.55 μg/L,L. thermotolerans和S. pombe顺序接种的酒样中萜烯类物质质量浓度范围在83.47~126.03 μg/L。其中,对顺序发酵酒样起到主要贡献作用的物质有芳樟醇(薰衣草香)和香茅醇(柠檬、柑橘香),这些物质含量均超过感官阈值,赋予葡萄酒花果香气,提高了葡萄酒香气的复杂性。
2.5.5 其他类化合物
本实验酒样中还检测到了癸醛、仲辛酮、大马酮、枯烯、苯乙烯、2,6-二叔丁基对甲酚、2,4-二叔丁基对甲酚7 种物质,这些物质对于酒体的平衡具有一定的贡献,其质量浓度由高到低排序为顺序发酵酒样(124.82~130.11 μg/L)、S.cerevisiae纯种发酵酒样(85.50 μg/L)、S. pombe纯种发酵酒样(69.63 μg/L)。在非酿酒酵母参与发酵的酒样中均有大马酮(苹果、蜂蜜、玫瑰香)和2,6-二叔丁基对甲酚(药味、烟味、酚醛味)的检出,但顺序发酵的酒样大马酮的含量高于S. pombe纯种发酵的试样,而2,6-二叔丁基对甲酚的含量在非酿酒酵母酒样中含量相差不大。
2.6 各处理酒样挥发性香气的主成分分析
将供试酒样进行主成分分析,以特征值大于1为依据,提取4 个公因子,其中PC1、PC2和PC3的累计方差贡献率为86.20%。由图4可知,PC1、PC2、PC3的方差贡献率分别为51.05%、20.41%和14.74%。可以看出,与PC1高度正相关的是一些具有浓郁花果香的酯类、醇类(如乙酸异戊酯、正己酸乙酯、辛酸乙酯和卞醇)以及某些具有消极气味的酸类(如辛酸、癸酸等),而1-壬醇和2,6-二丁基对甲酚与PC1呈负相关(载荷系数大于0.9)。PC2主要体现了乙酸苯乙酯、苯乙醇、3-乙氧基丙醇等香气化合物的重要信息(载荷系数大于0.7),与检测到的大多数萜烯类物质呈负相关。对PC3起主要贡献作用的物质有2,3-丁二醇、2,4-二丁基对苯酚等(正相关),与丁二酸单乙酯、仲辛酮呈负相关。

图 4 香气化合物主成分分析的因子载荷图Fig. 4 PCA loading plots of volatile aroma compounds
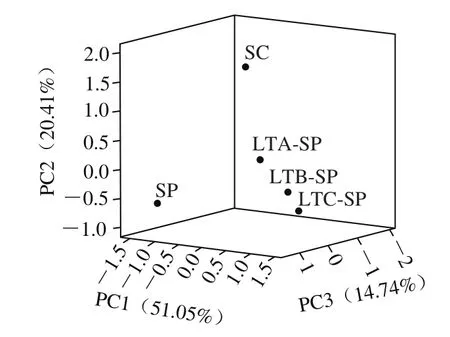
图 5 不同酒样主成分分析得分图Fig. 5 PCA score plots of wines
由图5可知,所有供试酒样可聚为3 类。纯种S. cerevisiae发酵的对照组聚为一类,PC1得分最高。两株非酿酒酵母顺序接种的3 个处理组距离较近,可聚为一类,且PC2得分相对较高,主体香气化合物为乙酸苯乙酯、苯乙醇等物质,赋予葡萄酒浓郁的花果香气。纯种S. pombe发酵可单独聚为一类,位于PC3的正半轴,主要与一些具有消极气味的物质(如2,3-丁二醇、2,4-二丁基对苯酚)相关。
2.7 感官分析
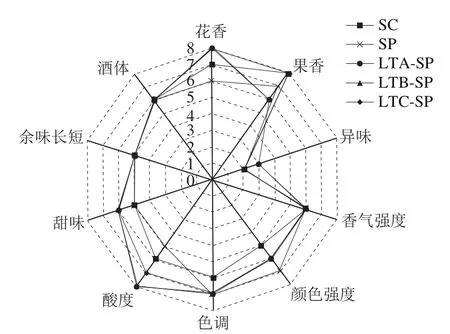
图 6 感官分析雷达图Fig. 6 Rader map of sensory analysis
通过对所有酒样的感官分析(图6)可知,各发酵试样在酒体和余味长短方面得分无显著差异。在颜色方面,S. pombe单独发酵的酒样颜色强度获得最高分数,有S. pombe参与的顺序发酵试样得分也高于用S. cerevisiae纯种发酵的酒样,与图3结论相一致。对香气分析说明,3 株L. thermotolerans与S. pombe顺序接种发酵的酒样花香味突出明显,但与对照相比有稍微明显的生青味。另外,顺序接种发酵有较高的酸度和甜度。综上所述,3 组顺序接种发酵酒样相对于传统的酿酒方式颜色外观有所提升,酸度增加,花香较突出。另外,3 组顺序发酵酒样感官品质分析得分无太大差异。
3 讨 论
L. thermotolerans和S. pombe菌株顺序培养发酵产生乳酸,这取决于L. thermotolerans菌株的生长程度,因此本研究以间隔4 d的顺序接种模式,目的是确保在添加S. pombe前,L. thermotolerans的生长数量达到最大。Kapsopoulou等[35]证实L. thermotolerans菌株在体积分数9%乙醇环境中只能够存活数天,其乳酸生成曲线与其生长曲线一致,当细胞数量达到最大,乳酸生产量也达到最大,这也支持了本实验的结果,L. thermotolerans在发酵第4天菌体数量达到最大,当接入S. pombe菌液后,L. thermotolerans菌体数量开始迅速减少,在两种菌体混合发酵的过程中,L. thermotolerans能够存活的时间不超过12 d。也有研究显示[9-10],不同的L. thermotolerans菌株及不同发酵条件,乳酸产量差异较大(0.23~9.6 g/L),本实验中L. thermotolerans菌株LTA最多能够产生的乳酸为2.86 g/L,供试的3 种菌株之间对乳酸的产生量差异不大。L. thermotolerans和S. pombe顺序接种酿造的美乐干红葡萄酒降低了挥发酸和乙醇体积分数,但需要更长的时间完成发酵,这与Del-Fresno等[9]的研究结果一致,由于S. pombe具有将苹果酸转化为乙醇[5]的能力,顺序发酵酒样可在不添加酒酒球菌的情况下降解尖锐的苹果酸增加口感柔和的乳酸。Benito等[36]的研究也表明L. thermotolerans和S. pombe混合发酵具有代替MLF的潜能。本研究处理酒样中色度值显著增加,色调值显著下降,这主要是由于S. pombe菌株参与发酵的结果。vitisin A是葡萄酒中主要的吡喃型花色苷,在葡萄酒酿造过程中,丙酮酸可将花色苷吡喃环上的第4个C原子和与其相连的苯环第5个C原子连成六元的含氧杂环,形成vitisin A[37]。S. pombe在葡萄汁发酵过程中可产生大量的丙酮酸,使vitisin A产量增加从而改善颜色参数[38]。其次,S. pombe的羟基肉桂酸乙酯脱羧酶活性高于酿酒酵母,该酶能够促进羟基肉桂酸脱羧形成乙烯基苯酚,并与葡萄花色素缩合形成颜色稳定的苯乙烯基吡喃花色苷加合物[38]。对于挥发性化合物,L. thermotolerans和S. pombe菌株顺序发酵酒样中酯类、高级醇类和酸类化合物的含量都有所下降,Morales等[39]对L. thermotolerans和S. cerevisiae混合发酵酒样的挥发性化合物进行定期监控,发现混合发酵酒样的酯类、高级醇类和酸类化合物的含量均不及单独用S. cerevisiae发酵的葡萄酒。其中,高级醇类含量的下降主要与S. pombe菌株相关,Loira等[31]指出有S. pombe参与的混合发酵,高级醇含量均有所下降。本实验还得出顺序发酵酒样的苯乙醇含量有所增加,Gobbi等[8]在L. thermotolerans和S. cerevisiae混合发酵的酒样中也得到相同结论。
传统葡萄酒酿造通常选择S. cerevisiae作为单一的发酵剂,本实验将L. thermotolerans和S. pombe两种非酿酒酵母顺序接种酿造美乐干红葡萄酒打破了传统的酿酒模式,提高了干红葡萄酒的感官品质。但此实验仅为相关菌种的基础研究,对于其在酒厂中的实际应用及基因方面的研究仍需进一步探索。目前,国内对于非酿酒酵母改善葡萄酒品质的研究还鲜有报道,因此,开发出更多具有特色的非酿酒酵母势在必行。
4 结 论
L. thermotolerans和S. pombe以间隔4 d顺序接种发酵过程中,L. thermotolerans菌体前期数量增长迅速,第4天菌体数量达到最大,但在接入S. pombe的第2天,菌体数量明显减少,并在10~12 d完全消亡。3 株L. thermotolerans和S. pombe菌株以顺序接种方式发酵产生的乳酸含量无显著差异,其质量浓度为2.46~2.86 g/L。发酵的美乐干红葡萄酒其基本理化指标符合国标要求,顺序接种发酵能够使挥发酸降低0.11~0.16 g/L,总酸增加0.96~1.97 g/L,也能够增加酒体色度,降低酒体色调。顺序接种发酵酒样中酯类、高级醇类和有机酸类化合物的含量分别下降了38.46%~49.34%、13.36%~19.42%、46.84%~49.71%,但增加了苯乙醇、萜烯类和大马士酮等挥发性化合物的产出,提高了香气的复杂性。感官分析表明顺序发酵改善了葡萄酒的色泽,酸度偏高,花果香气明显。表明L. thermotolerans菌株与S. pombe菌株以间隔4 d的顺序接种方式发酵具有替代苹果酸-乳酸发酵的潜力,对葡萄酒增酸和感官品质的提升也具有积极影响。

