大黄素对刀豆蛋白诱导小鼠急性肝损伤的干预作用及其机制
薛继华,谢琴秀,程君,尹华发,叶英,李家斌
(安徽医科大学第一附属医院,合肥230022)
急性重型肝炎以肝功能的严重恶化为特征,起病急,进展迅速,病死率高。急性重型肝炎可由病毒性肝炎、自身免疫性肝炎、乙醇及毒物等因素导致,在中国最常见的原因是病毒性肝炎。除了病情发展迅猛外,急性重型肝炎难防难治的另一原因是主导肝炎早期发展的关键分子不明确,缺乏特异、有效的治疗靶点和干预手段。刀豆蛋白(Con A)诱导的小鼠肝炎在很多方面较好地模拟了人类急性重型肝炎过程,如肝细胞大面积变性坏死、肝组织内淋巴细胞浸润、T细胞与NK细胞的激活及多种细胞因子水平升高等。前期研究中我们采用此法构建急性重型肝炎模型,利用芯片技术筛选表达受Con A影响的基因,结果发现1 473个基因表达差异明显[1,2],糖皮质激素诱导的肿瘤坏死因子受体(GITR)是其中之一,其配体为GITRL[3]。GITR高表达于调节性T细胞(Treg)表面,与GITRL相互作用能消除Treg的免疫抑制作用。有研究证实大黄素可抑制乙型肝炎病毒(HBV)复制[4,5]。我们既往研究证实大黄素可对抗Con A诱导的急性重型肝炎[6]。2016年7月~2018年6月,本研究观察了大黄素对Con A诱导小鼠急性肝损伤的干预作用,并借GITR/GITRL信号通路探讨其相关机制。
1 材料与方法
1.1 实验动物与主要材料 健康清洁级雄性6~8周龄Balb/C小鼠24只,体质量18~22 g,由浙江中医药大学实验动物中心提供。Con A购自Sigma公司;TRIzol购自Invitrogen公司;定量PCR试剂SYBR Premix Ex TaqTM(Perfect Real Time)及反转录试剂盒PrimeScript RT reagent Kitwith gDNA Eraser(Perfect Real Time)均购自TaKaRa公司;anti-GITR及anti-GITRL购自Abcam公司;匀浆机购自Bertin Technologies公司;电泳仪购自Bio-Rad公司;普通PCR仪2720及7900HT型荧光定量PCR仪购自ABI公司。
1.2 急性肝损伤模型制作及大黄素用法 24只小鼠随机分为对照组、模型组、大黄素组,每组8只。大黄素组给予大黄素25 mg/kg灌胃,2 h后经尾静脉注射20 mg/kg的Con A诱导急性肝损伤模型。模型组以CMC-Na(大黄素溶剂)代替大黄素预处理,2 h后以同法制作急性肝损伤模型。对照组不做特殊处理。于Con A注射10 h后以摘眼球法取血。处死小鼠,取肝组织,取一小部分以4%甲醛固定后做病理检查,余肝组织以液氮冻存备用。
1.3 血清ALT、AST检测 各组小鼠血液室温自然凝固20 min后,2 000~3 000 r/min离心20 min收集上清。血清稀释10倍后用全自动生化分析仪检测血清ALT、AST。
1.4 肝组织病理观察 各组小鼠肝组织标本常规固定、石蜡包埋、染色,光镜下观察肝组织学改变,评估各组小鼠肝组织损伤程度。
1.5 肝组织中GITR、GITRL mRNA及蛋白检测
1.5.1 肝组织中GITR、GITRL mRNA检测 采用实时荧光定量PCR法检测肝组织中的GITR、GITRL mRNA。PCR反应体系20 μL,反应条件为94 ℃预变性30 s,94 ℃ 5 s,60 ℃ 30 s,40个循环。以β-actin为内参基因。GITR基因上游引物序列为5′-CCTAGGTCAGCCGAGTGTAGTTGAG-3′,下游引物序列为5′-GTGCTTGCAGATCTTGCACTGAG-3′。GITRL基因上游引物序列为5′-CGAGTCCTGCATGGTTAA-3′,下游引物序列为5′-TCAGCTTCCCATCAGATGTC-3′。β-actin上游引物序列为5′-CGTTGACATCCGTAAAGACC-3′,下游引物序列为5′-AACAGTCCGCCTAGAAGCAC-3′。以2-ΔΔCt表示目的基因相对表达量。
1.5.2 肝组织中GITR、GITRL蛋白检测 采用Western blotting法。将小鼠肝组织研磨裂解后取总蛋白量相同的细胞裂解物,经10% SDS-PAGE电泳,电转移至PVDF膜上。PVDF膜用含0.05% Tween-20溶液溶解的5%脱脂牛奶室温下封闭1 h,后分别加入GITR抗体、GITRL抗体及GAPDH抗体,4 ℃孵育过夜。TBST溶液洗膜10 min×4次,加入相应二抗,室温孵育1 h后,再用TBST液洗膜10 min×4次。采用ECL显色,胶片曝光。采用Image J图像分析软件对胶片条带OD值进行量化,以目的蛋白OD值与内参蛋白OD值的比值为目的蛋白的相对表达量。
1.6 统计学方法 采用SPSS19.0软件进行统计分析。计量数据服从正态分布且方差齐时,多组间两两比较采用单因素方差分析(ANOVA);数据不服从正态分布或方差不齐时,多组间比较采用Kruskal Wallis检验,两组间比较用Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠血清ALT、AST水平比较 对照组、模型组、大黄素组血清ALT水平分别为(45.2±5.7)、(6 484.0±618.6)、(110.0±12.3)U/L,AST水平分别为(57.0±6.9)、(5 321.0±784.0)、(83.2±12.0)U/L。模型组血清ALT、AST水平显著高于对照组,大黄素组血清ALT、AST水平低于模型组(P均<0.01)。
2.2 各组小鼠肝组织病理变化 相较于对照组,模型组小鼠肝组织出现明显坏死灶,而大黄素组小鼠肝组织坏死明显减轻。见图1。
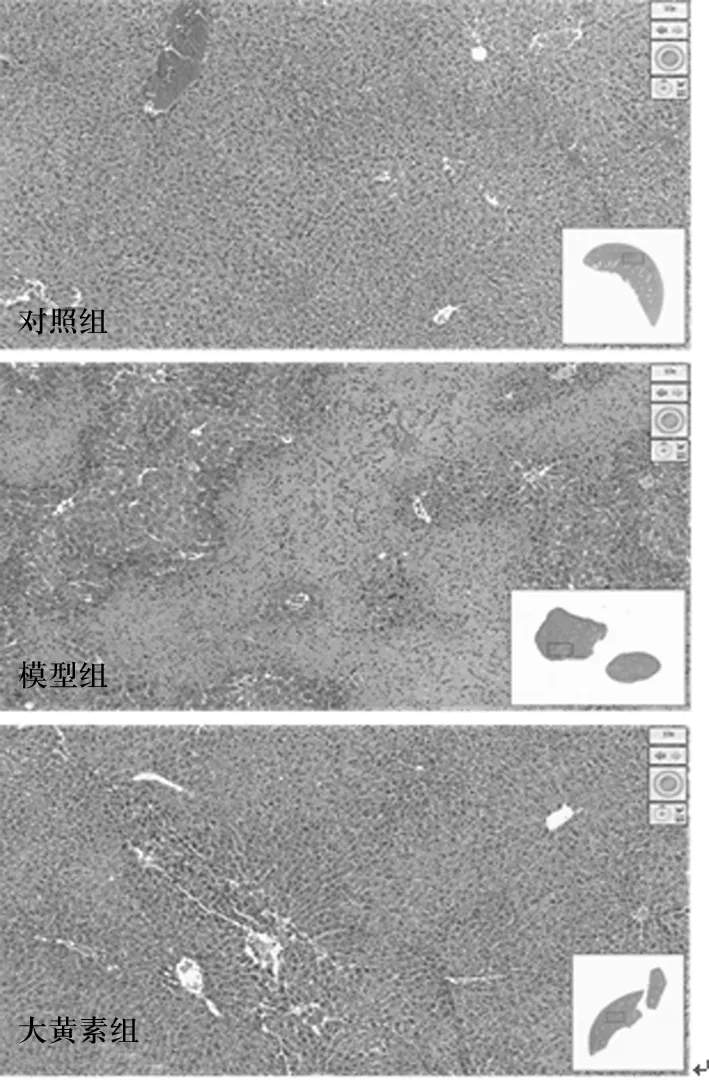
图1 各组小鼠肝组织病理变化(HE染色)
2.3 各组小鼠肝组织中GITR、GITRL mRNA及蛋白表达比较 模型组GITR、GITRL mRNA相对表达量高于对照组,大黄素组GITR、GITRL mRNA相对表达量低于模型组(P均<0.05)。模型组GITR、GITRL蛋白相对表达量高于对照组,大黄素组GITR、GITRL蛋白相对表达量低于模型组(P均<0.05)。详见表1、图2。

表1 各组小鼠肝组织中GITR、GITRL mRNA及蛋白表达比较
注:与对照组相比,*P<0.01;与模型组相比,#P<0.05。

图2 各组小鼠肝组织中GITR、GITRL蛋白表达情况(Western blotting法)
3 讨论
本研究团队既往研究发现,大黄素可对抗Con A诱导的急性重型肝炎,且Con A诱导的小鼠肝损伤组织中GITR表达升高,因此推测GITR在Con A诱导的小鼠肝损伤中可能发挥重要作用。本研究以大黄素预处理,观察大黄素对Con A诱导小鼠急性肝损伤的干预作用,并借GITR/GITRL信号通路探讨其相关机制。本研究发现,模型组血清ALT、AST水平显著高于对照组,大黄素组血清ALT、AST水平低于模型组;相较于对照组,模型组小鼠肝组织出现明显坏死灶,而大黄素组小鼠肝组织坏死明显减轻。这表明大黄素可减轻Con A诱导的小鼠肝损害。进一步实验结果显示,模型组GITR、GITRL mRNA及蛋白相对表达量高于对照组,大黄素组GITR、GITRL mRNA及蛋白相对表达量低于模型组,提示Con A可诱导小鼠肝组织中GITR及GITRL的表达,而大黄素预处理后可显著降低GITR及GITRL的表达水平。
GITR为70 kD的同源二聚体跨膜糖蛋白,属于Ⅰ型跨膜蛋白,主要表达于胸腺和外周淋巴器官的静息性Treg中,在CD4+CD25-T细胞、巨噬细胞及树突状细胞上也有少量表达,但这些细胞活化后GITR表达增加[7,8]。Shimizu等[9]用流式细胞仪检测GITR在Balb/C小鼠体内的分布,发现其在脾和淋巴结的Treg及胸腺中的CD4+CD25+T细胞上均呈高表达。1999年和2003年,人类和鼠的GITRL也分别被克隆出来[9~11],为Ⅱ型跨膜糖蛋白,主要表达在树突状细胞、B细胞、巨噬细胞和内皮细胞上,在静息性和活化的T细胞上不表达[12,13]。目前普遍认为GITR/GITRL是T细胞的共刺激分子,增强GITR/GITRL共刺激信号的作用有助于机体清除感染、发挥抗肿瘤免疫的作用[14,15]。另一方面,GITR/GITRL的相互作用可打破Treg介导的免疫耐受,从而诱发或加重自身免疫性疾病。因此,GITR/GITRL调节了Treg和效应性T细胞之间的功能平衡。
Treg在维持机体免疫耐受状态、防止自身免疫疾病发生、抗移植物排斥及肿瘤免疫中发挥重要作用[16]。Treg上有许多重要的表面分子,其中GITR的表达引起了人们的关注,因为用GITR抗体(DTA-1)可消除Treg的抑制活性[17]。DTA-1在此不是起封闭作用,而是激发GITR,即起到生理性GITRL的作用。Patel等[18]以抗GITR单抗注入关节炎鼠模型后,炎症恶化,同时伴有TNF、干扰素、胶原特异性IgG1的升高;GITR单抗刺激同样可以加剧卵清蛋白(OVA)诱导的鼠哮喘模型的气道炎症。研究[19]指出,GITR/GITRL相互作用增强了ILC2s的活性,促进了哮喘的发病。 Shimizu等[17]报道小鼠接受抗GITR抗体刺激后3个月即被诱发自身免疫性胃炎。近年研究认为,GITR/GITRL系统可作为T细胞活化的共刺激分子,与CD28一样起辅助刺激作用[20]。许多动物模型也验证了GITR信号对T细胞具有共刺激活化作用并抑制Treg活性,促进免疫系统的过度活化,从而诱发或加剧自身免疫性疾病[18,21]。GITR/GITRL的相互作用不仅可刺激效应性T细胞的增殖,还可打破Treg介导的免疫耐受,因此,GITR/GITRL系统的紊乱必将导致免疫平衡失调。
本研究结果提示,大黄素可能通过抑制GITR/GITRL通路发挥对Con A诱导小鼠肝损伤的干预作用。我们推测,在Con A诱导的急性重型肝炎中,GITRL与GITR相互作用,刺激效应性T细胞的增殖,打破Treg介导的免疫耐受增强,促进免疫系统的过度活化;而大黄素可通过抑制GITRL与GITR的表达从而抑制其功能,最终发挥抗肝损伤的作用。

