围产期奶牛高酮血症血液生化指标的监测
张广和,李国鹏,韩天龙,3,刘国文
(1.吉林大学动物医学学院,吉林 长春 130062;2.内蒙古赤峰市国营农牧场综合服务站,内蒙古 赤峰 024000;3.内蒙古赤峰市农牧科学研究院,内蒙古 赤峰 024031)
奶牛围产期是指妊娠奶牛分娩前Antepartum(A.P.)和分娩后Postpartum(P.P)的一段时期,一般指产前3周和产后3周,国外多称之为过渡期。奶牛高酮血症(酮病)是高产奶牛产后因碳水化合物和脂肪酸代谢紊乱而引起的一种群发、高发性能量代谢紊乱性疾病[1]。其发病率高,在我国奶牛酮病发病率约为15% ~30%,常发生在3胎~5胎的高产奶牛。该病主要是由于围产期能量摄入不能满足机体需要,而发生能量负平衡,为了应对这种负平衡,体脂和体蛋白被动员,长期便会引发机体的代谢紊乱。围产期能量负平衡引起围产期和泌乳期奶牛各种生产性疾病,如酮病、真胃变位、脂肪肝、胎衣不下等。血糖及血酮的测定仍然是诊断奶牛酮病的主要指标,血糖降低、酮体增加是酮病的临床病理学变化,但高血糖、高酮血的Ⅱ型酮病发生可能与胰岛素抵抗有关[2]。通过围产期奶牛酮病的发病率调查可以了解奶牛能量负平衡的严重程度,也为饲养管理提供了一些参考数据,此外对于血液肝功能、矿物质等其他生化指标的监测可从多方面了解酮病发生的规律及群体疾病预警,为疾病早期干预带来了帮助。
1 材料与方法
1.1 试验动物 本试验选取吉林省长春市某奶牛场围产期荷斯坦奶牛171头,通过临床酮病初筛结合血液相关指标和临床症状、胎次、产奶量、体况评分、干物质摄入量最终确定10头奶牛为本实验高酮血症奶牛。高酮血症奶牛的判定标准是血清BHBA>1.2 mmol/L、GLU <2.5 mmol/L、NEFA >0.5 mmol/L。 另外选取10头健康奶牛作为对照组。两组奶牛日粮均按NRC标准配制。在发病率调查中,以周为时间单位,选取7个时间点,每个时间点不少于17头奶牛。试验组和对照组所有奶牛均采用舍饲,自由采食。
1.2 循环血液样本的采集 根据场内管理系统记录,计算奶牛预产期,选择产前3周(21 d)、2周(14 d)、1周(7 d)、分娩当天(0)和产后1 周(7 d)、2 周(14 d)、3周(21 d)7个时间点的围产期奶牛和健康奶牛,每头奶牛血液样品的采集均于清晨投饲前颈静脉(或尾部静脉)无菌采集20 mL,10 mL肝素钠抗凝处理用做分离血浆,另10 mL血液不添加抗凝剂用做分离血清。3 800 r/min离心10 min,收集血浆(或血清)于事先准备好的无菌冻存管中,准确标记后,-80℃保存待测。
1.3 测定项目和方法 测定指标有葡萄糖(GLU)、β-羟丁酸(BHBA)、非酯化脂肪酸(NEFA)、甘油三酯(TG)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(GGT)、乳酸脱氢酶(LDH)、钙(Ca)、镁(Mg)和磷(P)。以上指标于吉林大学第四医院医学检验科测定,具体步骤按试剂盒说明书进行。
1.4 数据统计与分析 数据采用SPSS 19.0软件进行分析,组间差异显著性采用ONE-WAY ANOVA进行分析,测定指标与NEFA、BHBA的相关性采用Bivariate Correlations皮尔逊检验分析,结果用平均值±标准差(Mean±SD)表示。利用 SPSS 19.0-ROC-Curve程序建立ROC曲线,比较各指标曲线下面积(Auc),利用公式:Younde指数 =敏感度 -(1-特异度),计算YI最大值,其对应的检测值即为cut-point,其中Se表示正确判断病牛的比率,Sp表示正确判定非病牛的比率,Se越高表明漏诊几率越小,Sp越高表明误诊概率越小。本试验以Se大于等于0.70作为具有诊断意义的可能下限。Auc>0.5时,其值越大表明该指标的诊断准确性越高,如果Auc<0.5则表明该指标无诊断价值。
2 结果
2.1 围产期奶牛高酮血症发病率调查 如图1所示,产前无高酮血症发生,至分娩后发生率逐渐增加,呈上升趋势,在产后14 d达到最高发生率(10%),随后下降至4.8%,从时间来看,高酮血症的发生在分娩后1-3周,产后14 d最高。

图1 围产期奶牛高酮血症发病率/%
2.2 高酮血症奶牛血液生化指标改变及其与NEFA、BHBA的相关性分析如表1所示,高酮血症奶牛血液GLU、Ca浓度显著低于健康奶牛,P显著高于健康奶牛。血液TBIL(R=0.729,P=0.000)、DBIL(R=0.697,P=0.001)、IBIL(R=0.708,P=0.000)、AST(R=0.720,P=0.000)浓度与 NEFA在P<0.01水平上呈显著正相关;血液浓度NEFA(R=0.618,P=0.004)与BHBA在P<0.01水平上呈显著正相关,血液 P(R=0.504,P=0.024)在BHBA在P<0.05水平上也呈显著正相关,但GLU(R=-0.881,P=0.000)、Ca(R=-0.738,P=0.000)在P<0.01水平上与BHBA呈显著负相关,在P<0.05水平上TG(R=-0.543,P=0.013)、GGT(R=-0.525,P=0.017)浓度与BHBA呈显著负相关。

表1 高酮血症奶牛血液生化指标与NEFA、BHBA的相关性分析结果
2.3 围产期高酮血症奶牛危险因素分析与评价 运用Logistic回归法,以是否发生低血糖为因变量,自变量包括NEFA、BHBA等几个血液指标因素,筛选出独立危险因素,纳入标准为 α=0.05,NEFA(OR=7.72)强联系,TG(OR=7.03)强联系,GGT(OR=6.708)强联系,LDH(OR=4.45)强联系,P(OR=6.23)强联系。见表2。

表2 围产期高酮血症奶牛危险因素评价
在高血酮危险因素评价中应用Logistic回归分析造模模拟各生化指标与高酮的危险性,分为3个模型,一是与能量相关指标;二是肝功能指标;三是矿物质指标。由于能量相关指标无离群值无法分析。肝功能造模后由表3可知,各肝功能指标无显著性差异;而从表4看出,GGT(P=0.01),LDH(P=0.035)差异显著故不应舍去,可作为参考。表5看出,肝功能指标对高酮血阴性预测达90%,对阳性预测为80%。最终造模表达式为:
Y=0.283TBIL-4.350DBIL+0.142AST-0.513GGT+0.006LDH-2.561

表3 方程中的变量

表4 不在方程中的变量

表5 预测指标分类
矿物质指标造模后,由表6可知,矿物质指标对高酮血症预测不显著,但表7显示Ca(P=0.001),P(0.013)对高酮血症显著,故应保留。表8可知,矿物质指标对高酮血症阴性预测达100%,阳性预测90%。最终造模表达式为:
Y=-87.657 Ca+64.935Mg-11.594P+152.989。
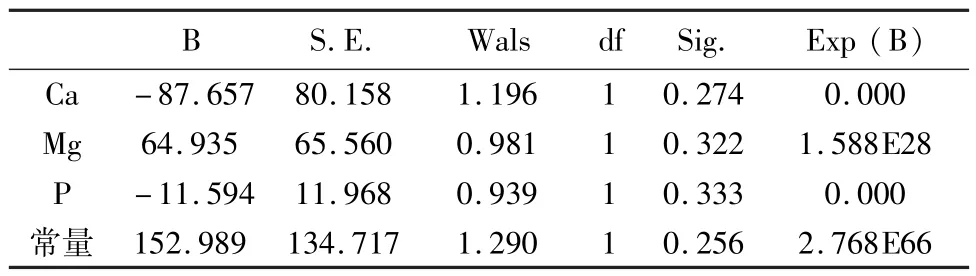
表6 方程中的变量

表7 不在方程中的变量
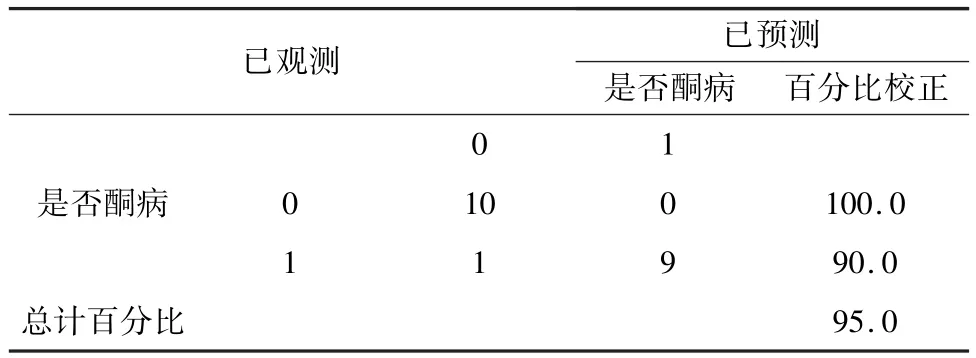
表8 预测指标分类
2.4 高相关性血液生化指标在奶牛高酮血症诊断中的效用评价及参数确定 如中插彩版图2和表9所示,利用 ROC曲线分析,血液中高相关性指标Auc分别为 TG(0.15)、TBIL(0.395)、DBIL(0.535)、IBIL(0.385)、AST(0.690),其中只有DBIL和AST的Auc面积大于0.5,利用Youden指数计算Cut-point值分别DBIL(1.15)、AST(73.5)。
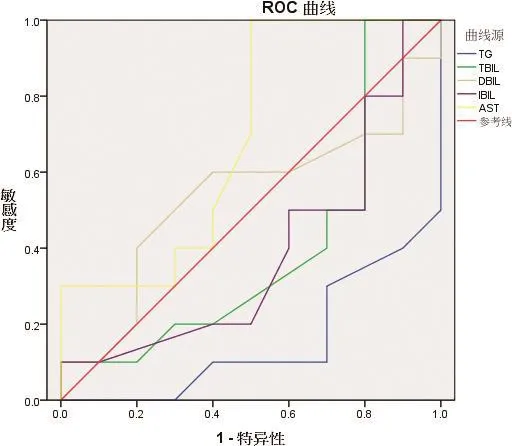
图2 部分血液指标对奶牛高酮血症诊断的ROC曲线比较

表9 血液指标在奶牛高酮血症诊断中的灵敏度、1-特异度和临界点
3 讨论
酮病可以分为原发性酮病和继发性酮病,原发性酮病是以能量负平衡为病理学基础,继发性酮病是以任何能引起奶牛食欲减退或消化吸收障碍的疾病为病因,此外矿物质缺乏、内分泌紊乱、应激也是引起酮病的诱因。发病率调查结果显示,产前无高酮血症发生,至分娩后发生率逐渐增加,呈上升趋势,在产后14 d达到最高发生率(10%),随后下降至4.8%。有统计数据表明,在我国临床酮病发病率达2% ~20%,亚临床酮病发生率达10%-30%[3]。在对高酮血症独立危险因素分析后发现NEFA(OR=7.72)强联系,TG(OR=7.03)强联系,GGT(OR=6.708)强联系,LDH(OR=4.45)强联系,P(OR=6.23)强联系。
危险因素评价中,应用Logistic回归分析造模模拟各生化指标与高血酮的危险性,3个模型中能量相关指标无离群值,肝功能指标GGT(P=0.01),LDH(P=0.035)差异显著可作为参考,肝功能指标对高酮血症阴性预测达90%,对阳性预测为80%。Ghanem[4]等人对产前4周内37头水牛血浆中卵磷脂胆固醇脂酰转移酶(LCAT)检测发现浓度显著性降低,在对37头产后水牛进行临床检查发现有23头水牛有临床酮病,14头奶牛有血红蛋白尿症状,表明LCAT作为一种肝合成的酶,其降低可以作为酮病发生的一个预测指标。有报道,机体内超氧化物歧化酶(SOD)可以清除体内代谢产生的自由基,酮病、脂肪肝等代谢疾病与健康奶牛相比SOD含量显著下降,但围产期总体都下降,说明SOD减少可能是诱发此类疾病的一个危险因素,机体SOD的减少使代谢自由基破坏细胞,使细胞膜脂质过氧化能力加而发生代谢疾病[5]。矿物质元素 Ca(P=0.001),P(0.013)对高酮血症差异显著,应作为参考指标,对高酮血症阴性预测达100%,阳性预测90%。ROC分析计算出高相关性因素的Cut-point值分别 DBIL(1.15)、AST(73.5)。
4 结论
围产期奶牛高酮血症多发于产后1~3周内,以产后第2周发病最高,产后是监测的重点。血液NEFA、BHBA、GLU是高酮血症监测的首选指标,DBIL、AST为高酮血症监测的参考指标,存在一定程度的肝功能异常。

