中华绒螯蟹中内源性氨基脲的产生途径研究
彭 婕,吕 磊,喻亚丽,甘金华,何 力
(中国水产科学研究院长江水产研究所,农业农村部淡水鱼类种质监督检验测试中心,农业农村部水产品质量安全风险评估实验室(武汉),武汉 430223)
呋喃西林作为一类有效的抗菌药物曾被广泛运用在猪、牛等畜禽和水产养殖中[1],氨基脲(semicarbazide,SEM)是其重要的代谢产物。因呋喃西林原药在生物体内快速代谢成SEM[2-3],目前许多国家均以检测SEM来判断在养殖过程中是否非法使用呋喃西林,以达到对呋喃西林原药监控的目的[4]。呋喃西林及其代谢物SEM均被证明对哺乳动物具有遗传毒性[5-7],欧盟、日本及中国先后规定呋喃西林及其代谢物在动物源性食品中不得检出[8]。近年来,国内外频繁在甲壳类水产品中检出SEM残留,我国在青虾监督抽查和虾蟹苗种抽检中也发现,SEM超标现象较严重。
前期研究以中华绒螯蟹肌肉、性腺、肝胰腺、腮、蟹壳等不同组织为对象,分析了SEM在上述组织中的残留情况,发现肌肉、性腺、肝胰腺和腮中几乎没有检出SEM,而所有蟹壳样品均检出SEM且超过国家限量标准,实验证明中华绒螯蟹中存在内源性SEM,且主要来源于蟹壳[9],这一结论也在国内外相关研究中得到证实[10-14],但有关其产生途径鲜有研究。蟹壳的主要成分为甲壳素、钙盐和蛋白质,其中钙与以蛋白质为主的有机质镶嵌结合,层层交叠覆盖在甲壳素的表面,因此探究蟹壳中SEM的主要来源,需研究蟹壳中甲壳素及蛋白质含量变化对SEM残留量的影响。本实验以不同产地的中华绒螯蟹雄性及雌性个体的背部蟹壳和腹部蟹壳为研究对象,测定SEM在上述组织中的残留水平,分析不同部位蟹壳中主要成分甲壳素、蛋白质及其水解氨基酸等相关因素的分布规律,评估并验证其与SEM残留的相关性,以此探究中华绒螯蟹中内源性SEM可能的产生途径,为下一步研究其产生机理提供基础和依据。
1 材料与方法
1.1 仪器与试剂
ThermoFinnigan Surveyor液相色谱系统和TSQ Quantum Access Max三重四级杆质谱仪(美国 Thermo Fisher公司);SHZ-28A水浴恒温振荡器(太仓市华美生化仪器厂);CR21 离心机(日本 HITACHI);KD200 氮吹仪(杭州奥盛仪器有限公司);K9840自动凯式定氮仪(济南海能仪器股份有限公司);L-8900氨基酸自动分析仪(日本 HITACHI)。
SEM盐酸盐和内标物SEM·HCl-13C-15N2(纯度≥ 99 %,德国Dr. Ehrenstorfer公司),甲醇、二甲基亚砜、乙酸乙酯、正己烷(色谱纯,J.T.Baker公司),醋酸铵(色谱纯,J.T.Baker公司),2-硝基苯甲醛(分析纯,上海安谱公司),盐酸、磷酸氢二钾、氢氧化钠(分析纯,国药集团化学试剂有限公司),甲壳素(纯度≥ 98 %)、天冬氨酸、谷氨酸、脯氨酸、丙氨酸、丝氨酸、缬氨酸、蛋氨酸、胱氨酸、组氨酸、异亮氨酸、苯丙氨酸、酪氨酸、甘氨酸、苏氨酸、赖氨酸、亮氨酸、精氨酸标准品(SIGMA公司),实验用水由Milli-Q纯水仪制备。
1.2 样品检测
1.2.1 样品来源与制备
中华绒螯蟹样品取自武汉市江夏区梁子湖山坡湖区(基地1)、武汉市汉南区湘口街五湖大队(基地2)和洪湖市大同湖农场(基地3),三个基地的养殖水体和饲料等基质中均未检出呋喃西林原药。每个基地选取雄蟹雌蟹各30只,雄蟹体重约100 ~ 120 g/只,雌蟹体重约70 ~ 90 g/只,分别取其腹部蟹壳和背部蟹壳,剪碎备用。
1.2.2 样品中SEM浓度测定
样品中SEM浓度测定的前处理及仪器分析方法参见文献[9]。
1.2.3 样品中甲壳素含量测定
采用文献[15]方法将甲壳素标准品及待测样品烘干后加入浓硫酸水解4 h,待水解液冷却至室温后,经MCX小柱净化,浓缩后采用液相色谱-串联质谱法分别测定甲壳素标准品及样品的水解产物氨基葡萄糖盐酸盐(GAH)浓度,再根据公式(1)计算待测样品中甲壳素的含量。
X=(mGAH×m0)/(mS×m0-GAH)×100%
(1)
其中:X为样品中甲壳素的含量(%);mGAH为待测样品水解后的GAH质量(μg);m0为甲壳素标准品质量(mg);mS为待测样品质量(mg);m0-GAH为甲壳素标准品水解后的GAH质量(μg)。
1.2.4 样品中蛋白质含量测定
称取固体试样0.2 g左右,与硫酸和催化剂一同加热消化,使蛋白质分解,按相关方法进行测定[16]。
1.2.5 样品中氨基酸含量测定
称取一定量样品于水解管内,加入6 mol/L盐酸10 ~ 15 mL,将蛋白质彻底水解成游离氨基酸,用1 mL pH 2.2的柠檬酸缓冲液溶解,经氨基酸自动分析仪的离子交换柱分离后,与茚三酮发生颜色反应,再通过分光光度计比色测定氨基酸含量[17]。
1.2.6 相关性验证实验
根据甲壳素和氨基酸含量测定结果,确定2.00 g蟹壳样品中甲壳素和氨基酸的重量,分别将上述重量的甲壳素、17种氨基酸混合物、甲壳素和17种氨基酸的混合物三组物质作为待测样品,按照1.2.2前处理和仪器测定方法来验证是否有SEM检出。
2 结果与分析
2.1 蟹壳中SEM残留水平分析
不同部位的蟹壳样品测定结果如图1所示(样品平行测定3份,取平均值)。从图1可以看出,3个基地不同部位的蟹壳中均有不同程度的SEM检出,其检出值均超过国家限量标准。SEM在3个基地的检出浓度分布趋势基本一致,均为雄蟹背壳>雌蟹背壳>雄蟹腹壳>雌蟹腹壳。整体而言,雄蟹个体比雌蟹大,SEM在其背部和腹部的分布相对较多,而不同性别的中华绒螯蟹中背部蟹壳所含SEM水平明显高于腹部蟹壳。不同取样地点雄蟹背壳中SEM的检出浓度变化规律为基地2>基地1>基地3,雄蟹腹壳和雌蟹腹壳中SEM的分布规律则为基地3>基地1>基地2,三个基地的雌蟹背壳中SEM检出浓度基本相同。不同取样地点同一类型的蟹壳中SEM检出浓度虽无明显变化规律,但其检出值相差不大。

图1 样品中SEM的浓度
2.2 蟹壳中甲壳素与SEM残留相关性分析
根据文献方法测定浓度为0.1、1、5、10、50 mg/L的GAH标准溶液,以浓度为横坐标,峰面积为纵坐标绘制标准工作曲线。回归方程为y=204 0x+277 1,R2=0.995。甲壳素的含量可以间接通过GAH含量表示,可采用添加GAH的方式考察方法的回收率和精密度。选取1个雄蟹背部壳(水解后GAH含量为2.39 mg/L)作为样品,分别加入0.25、2.5、5.0 mg/L三个浓度水平的GAH,平行测定6个样品,结果见表1,其回收率为80.3%~91.3%,相对标准偏差为1.3%~ 4.8%,说明方法回收率和精密度良好。

表1 回收率及方法精密度测定结果(n=6)
分别称取0.02 g甲壳素标准品和待测样品,HPLC-MS/MS法测得甲壳素标准品水解产物GAH质量为13.81 μg,待测样品水解产物GAH的质量及根据公式(1)计算的甲壳素含量如表2所示。此方法操作步骤简单,且测定结果与文献[18]中采用传统方法测定的结果接近。3个基地不同部位蟹壳中甲壳素含量分布如图2 所示,其分布趋势均为雄蟹背壳>雌蟹背壳>雄蟹腹壳>雌蟹腹壳。甲壳素在生物体中的主要作用是作为身体骨架起到保护机体的作用,雄蟹骨架较大,其背部和腹部甲壳素含量自然高于雌蟹,而不同性别的中华绒螯蟹背部蟹壳比腹部蟹壳硬,其甲壳素含量相对较高。
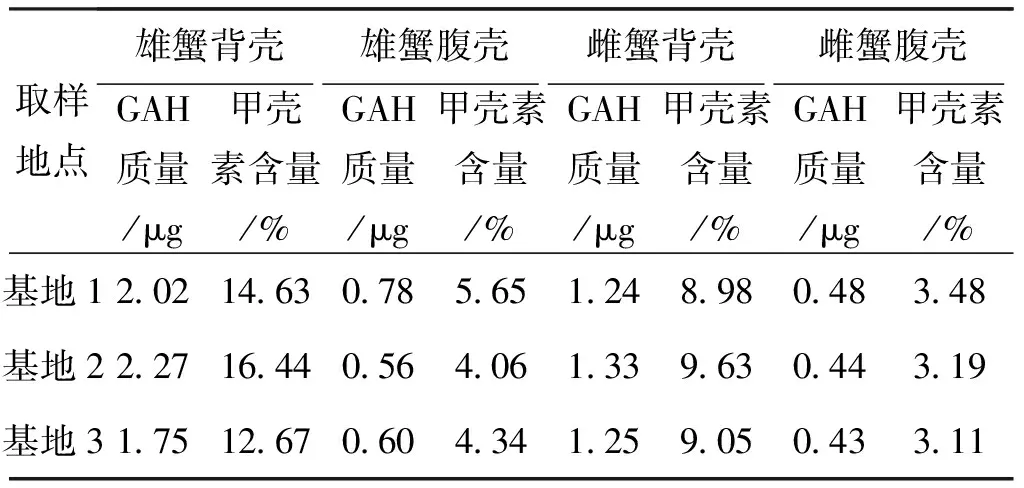
表2 样品中甲壳素的含量(n=3)

图2 不同部位蟹壳中甲壳素含量分布图
以SEM浓度和甲壳素含量绘制曲线,如图3所示,大多数点分布在曲线上及周围,曲线相关系数为正值(P< 0.05),说明中华绒螯蟹蟹壳中SEM浓度与其中甲壳素的含量正相关,样品中甲壳素含量越高,其SEM检出浓度越高。

图3 中华绒螯蟹不同组织中SEM浓度与甲壳素含量相关性分析
2.3 蟹壳中蛋白质与SEM残留相关性分析
雄蟹背壳、雄蟹腹壳、雌蟹背壳和雌蟹腹壳中蛋白质含量结果如图4所示。3个基地不同部位蟹壳中蛋白质含量变化趋势均为雌蟹腹壳>雄蟹腹壳>雄蟹背壳>雌蟹背壳。腹部蟹壳直接与肌肉组织相连,而肌肉组织中蛋白质含量高达70%以上,受其影响,腹部蟹壳蛋白质含量明显高于背部蟹壳。

图4 样品中蛋白质的含量
将不同部位蟹壳中蛋白质含量与其SEM残留浓度比较,发现蛋白质含量最高的雌蟹腹壳中SEM检出浓度最低,而蛋白质含量相对较低的雌蟹背壳和雄蟹背壳中SEM检出浓度却相对较高。以SEM浓度和蛋白质含量绘制曲线,如图5所示,曲线相关系数为负值(P<0.05),说明蛋白质含量与SEM检出浓度呈相反趋势,这表明中华绒螯蟹蟹壳中SEM的生成与其蛋白质的含量也可能相关,样品中蛋白质含量越高,其SEM检出浓度越低。

图5 中华绒螯蟹不同组织中SEM浓度与蛋白质含量相关性分析
2.4 蟹壳中氨基酸与SEM残留相关性分析
蛋白质是由若干氨基酸经过脱水缩合形成的,进一步分析,SEM的生成还可能与样品中的氨基酸组成相关。3个基地不同部位蟹壳中蛋白质分布规律一致,因此仅选取基地1样品分析其中氨基酸组成,结果如表3所示。蟹壳中17种氨基酸的含量占干重的12.92%~29.99%,其中鲜味和甘味氨基酸含量非常丰富,包括天冬氨酸、谷氨酸、甘氨酸、丙氨酸等,占氨基酸总量的28.02%~34.02%。四种蟹壳中蛋氨酸含量最高,其次为谷氨酸、甘氨酸、天冬氨酸和精氨酸。
根据检测结果发现17种氨基酸的变化趋势基本一致,均为雌蟹腹壳>雄蟹腹壳>雄蟹背壳≈雌蟹背壳,因此单从氨基酸测定结果很难直接推断哪一种或哪几种氨基酸与SEM的产生具有相关性,仍需通过下一步的验证实验来探明。
表3 氨基酸检测结果(n=3)
Tab.3 Amino acid test results(n=3)i

氨基酸种类氨基酸含量/%雄蟹背壳雄蟹腹壳雌蟹背壳雌蟹腹壳天冬氨酸(Asp)0.941.900.952.65苏氨酸(Thr)0.480.930.471.36丝氨酸(Ser)0.620.920.601.27谷氨酸(Glu) 1.262.541.223.78甘氨酸(Gly)0.901.460.942.12丙氨酸(Ala)0.661.480.600.62胱氨酸(Cys)0.260.480.290.62缬氨酸(Val)0.780.870.760.99蛋氨酸(Met)3.353.523.093.93异亮氨酸(Lle)0.310.680.300.95亮氨酸(Leu)0.601.340.561.94酪氨酸(Tyr)0.460.700.460.86苯丙氨酸(Phe)0.641.040.611.30赖氨酸(Lys)0.340.980.321.52脯氨酸(Pro)0.600.880.601.34组氨酸(His)0.240.440.240.60精氨酸(Arg)0.981.530.912.70总和13.4221.6912.9229.99
2.5 相关性验证实验结果分析
经甲壳素和氨基酸的含量测定,确定2.0 g蟹壳中甲壳素的重量约为0.20 g,各种氨基酸重量约为0.04 g。三组物质的验证结果如表4所示。验证实验发现甲壳素经前处理后未检出SEM,究其原因可能是因为甲壳素为高含碳物质,氮元素含量较少,而SEM是高含氮物质,因此甲壳素转化为SEM的可能性较低。17种氨基酸混合物经前处理后SEM检出值为0.77 μg/kg,与蟹壳中SEM检出浓度相差较大,导致其检出的原因可能是同位素内标引起的干扰[19]。甲壳素与17种氨基酸混合物经前处理后SEM检出值为10.28 μg/kg,与蟹壳中SEM检出浓度较为接近,由此推断蟹壳中SEM检出可能是甲壳素和氨基酸在SEM测定前处理过程中发生化学反应,从而导致中华绒螯蟹中存在内源SEM,这一猜测2014年Colin C[20]也提到过,但从未被证实,本研究首次验证了这一假想的可能性。下一步进行机理研究时,需首先明确具体是哪种或哪几种氨基酸与甲壳素发生化学反应,能够导致SEM检出且超标,然后确定反应过程的中间产物,从而探明中华绒螯蟹中SEM的产生机理。

表4 不同样品中SEM的浓度(n=3)
注:“ND”表示检测结果小于0.50 μg/kg,“/”表示无。
3 结论
本实验系统分析了中华绒螯蟹雄性与雌性个体不同部位的蟹壳中SEM的残留水平、甲壳素含量、蛋白质含量以及氨基酸组成,结果表明不同部位蟹壳中甲壳素含量与SEM残留水平变化趋势一致,蛋白质含量及氨基酸组成与SEM残留水平变化趋势相反,以此推断甲壳素和蛋白质及其水解氨基酸可能与SEM的形成具有相关性。验证实验进一步证实,甲壳素和氨基酸在前处理过程中发生化学反应产生SEM,这一产生途径可能是导致中华绒螯蟹中内源性SEM残留的原因。

