铀胁迫下伊乐藻的生理响应与富集特性研究
杨昊 罗学刚 丁翰林 王焯
(西南科技大学生命科学与工程学院,绵阳 621010)
铀矿是重要的战略资源和能源,随着国防军工和核电发展的需求的不断增加,大量的铀矿资源被开采和利用,在铀矿冶过程中不可避免地产生了大量难以处理的含铀污染废水[1],含铀废水如不经处理直接排放到环境中,铀会通过食物链积累在人体,从而危害人体健康[2]。目前含铀废水的处理方法有物理法、化学法和生物吸附法,其中生物吸附法中的植物处理法因其成本低、无二次污染等优点成为近年来广泛研究的热点[3-4]。
伊乐藻(Elodea nuttallii)是一种优质、速生、高产的沉水植物。伊乐藻适应力极强,只要水上无冰即可栽培,气温在5℃以上即可生长,在寒冷的冬季能以营养体越冬,当苦草、轮叶黑藻尚未发芽时,该植物已大量生长。目前,国内外污染土壤修复主要以陆生植物为主,利用伊乐藻处理水体中的重金属的研究有了一定的报道,韩华杨等[5]研究发现将伊乐藻与固定化脱氮微生物联用,能提高亲水河的氮素脱除能力,张饮江等[6]研究发现伊乐藻对镉有较好的去除效果。但是很少有利用伊乐藻处理含铀废水的相关报道。因此,本研究以沉水植物伊乐藻为研究对象,研究在不同初始铀浓度胁迫下,伊乐藻的生理生化指标的响应,以及伊乐藻对铀的富集特征,旨为其应用于含铀废水的处理和水体修复提供一定的理论依据和实践参考。
1 材料与方法
1.1 材料
1.1.1 实验材料和实验环境 实验材料伊乐藻购置于绵阳信捷公司,将伊乐藻在1/4 倍Hoagland营养液中培育13-14 d,从中筛选出形态差异不大的植株用于实验。实验于2018年1月-2018年5月,在西南科技大学材料环境降解及安全性评价实验大棚进行。
1.1.2 主要仪器 FW-100高速万能粉碎机(北京永光明医疗仪器有限公司);BSA223S-CW电子天平(德国Sartorius集团);611UF超纯水系统(德国Sartorius集团);Multiwave3000微波消解仪(奥地利安东帕公司);PF6非色散原子荧光光度计(北京普析通用仪器有限责任公司生产);7700x电感耦合等离子体串联质谱仪(美国安捷伦科技有限公司);U-3900紫外分光光度计(日立公司);M-PEA荧光仪(英国Hansatech 公司)。
1.1.3 主要试剂乙酸双氧铀(UO2(CH3COO)2·2H2O)、Hoagland 营养液[7]、双氧水(30% H2O2)、浓硝酸(65%-68% HNO3),本实验采用的试剂均为分析纯。
1.2 方法
1.2. 1 实验设计 用UO2(CH3COO)2·2H2O配制初始浓度分别为10、20、30 mg/L的溶液,每个处理的体积为10 L,每组设置3个平行。将所有溶液的pH调节至5.5±0.01,称取40.0±0.2 g的伊乐藻,放入装有10 L处理液的27 L的整理箱,进行10 d的水培实验,每3 d改变一次水培整理箱的位置。
1.2.2 抗氧化酶活性测定[7]SOD活性的测定方法为氮蓝四唑还原法(NBT);POD活性的测定方法为愈创木酚法;CAT活性采用的测定方法为紫外分光光度法。
1.2.3 MDA含量测定 按照王志昊等[8]的方法分别测量450、532和600 nm吸光度。
1.2.4 叶绿素含量测定 按照董杰等[7]的方法分别测量665、649和470 nm吸光度。
1.2.5 叶绿素荧光参数测定 测定仪器使用M-PEA(英国Hansatech公司),测量前用暗适应夹片处理叶片 20 min,随后测定[9]。用于 JIP-test分析数据[10-11]。
1.2.6 伊乐藻生物量的测定 10 d后,将伊乐藻从溶液中取出,用去离子水反复冲洗3次并用滤纸吸干表面水分,并用电子天平(BSA223S-CW)进行准确称量。
1.2.7 伊乐藻的铀富集量测定[12]使用中药粉碎机(北京永光明)将烘干后的植物粉碎,准确称取样品0.2 g,加入5.0 mL浓硝酸和2.0 mL 30%双氧水,在Synthos 3000消解仪(奥地利安东帕公司)中消解,随后定容至50 mL后经0.45 μm的滤膜过滤,使用Agilent 7700x ICP-MS(美国安捷伦公司)测定其中铀含量。
1.2.8 叶片光合气体交换参数测定 采用LC Pro-S+全自动便携式光合仪(澳作生态仪器有限公司)测定伊乐藻光合气体交换参数,选取距顶端第4片成熟叶片测定,每个处理测3次,取平均值。
1.2.9 计算方法与数据分析[13]生物富集系数(BCF)=植物干物质中重金属含量(mg/kg DW)/水体重金属初始浓度(mg/L)。
单株U总提取量=植物干物质U浓度(mg/kg)×植物干重(kg)。
使用DPS 7.5进行数据分析,应用Origin Pro 8.5软件作图。
2 结果
2.1 铀对伊乐藻生物量的影响
由图1-A可以看出,随着初始铀浓度增加,伊乐藻的鲜重先上升后下降,均小于实验对照组,分别较处理前下降14.6%、6.2%和7.6%。由图1-B可以看出,随初始铀浓度增加,伊乐藻的干重先增大后减小,都高于对照组,分别较对照组上升2.1%、12.1%和10.6%,干重在初始铀浓度20 mg/L下最大,为1.54 g。
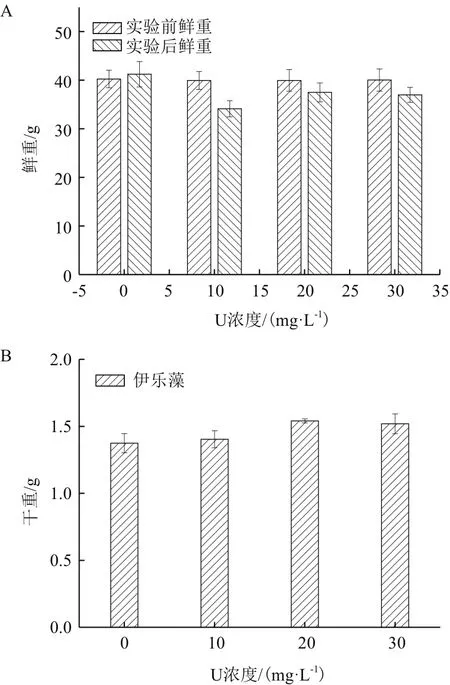
图1 不同初始铀浓度对伊乐藻生物量的影响
2.2 伊乐藻对铀的富集能力
由图2-B可以看出,随着初始铀浓度增加,伊乐藻的生物富集系数(Bioconcentration Factors,BCF)先增大后减小,但均小于1,BCF在初始铀浓度10 mg/L下最大,为0.712 5。由图2-A和图2-C可以看出,富集量和总提取量均随初始铀浓度的增加而逐渐增大,对铀的富集量和总提取量在初始铀浓度30 mg/L时达到最大,分别为14 mg/kg、21.266 μg。
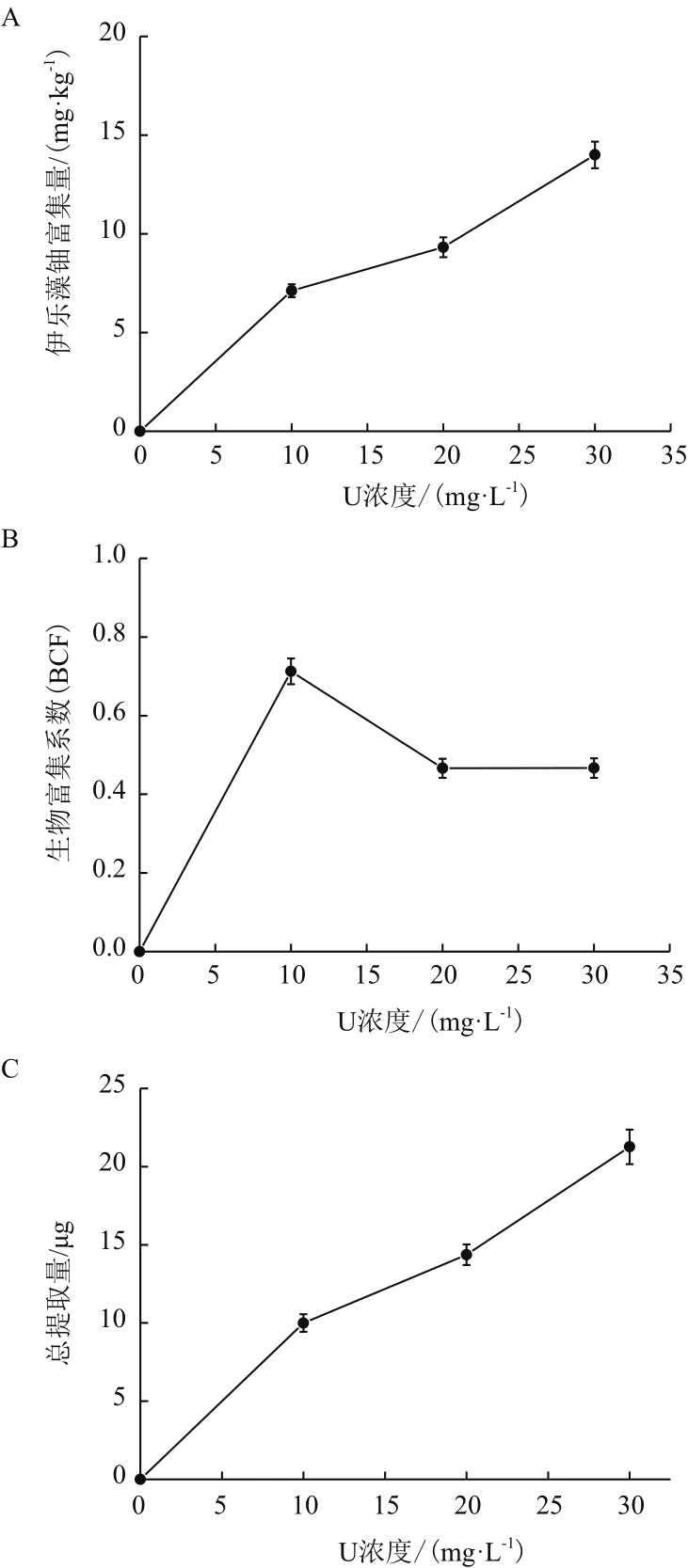
图2 不同初始铀浓度下伊乐藻的富集特性
2.3 铀对伊乐藻抗氧化酶活性和丙二醛含量的影响
由图3可以看出,随着初始铀浓度升高超氧化物歧化酶(Superoxide dismutase,SOD)呈现逐渐下降的趋势,过氧化物酶(Peroxidase,POD)活性、过氧化氢酶(Catalase,CAT)活性、丙二醛(Malondialdehyde,MDA)含量呈现现先上升后下降的趋势。所有初始铀浓度下,SOD活性均低于对照组,而POD活性、CAT活性、MDA含量均高于对照组。SOD活性在初始铀浓度30 mg/L下最小,较对照组下降86.3%。POD和CAT的活性在初始铀浓度10 mg/L 处理下最大,分别较对照组上升412.8%、833.3%。MDA含量在初始铀浓度20 mg/L下最大,较对照组上升152.2%。

图3 伊乐藻在铀胁迫下的抗氧化酶活性和丙二醛变化
2.4 铀对伊乐藻光合色素含量的影响
由图4-A和4-B可以看出,在铀胁迫下伊乐藻的光合色素含量呈现出不同的变化趋势。伊乐藻的叶绿素a、叶绿素b均出现下降趋势,类胡萝卜素含量出现了先上升后下降的趋势。在初始铀浓度30 mg/L 下,叶绿素a、叶绿素b含量较对照组分别下降27.7%和26.7%。类胡萝卜素含量较对照组分别下降46.3%、17.3%和35.7%。
2.5 铀对伊乐藻荧光参数的影响
由图5-A、图5-B和图5-C看出,随初始铀浓度 的 增 加,Fv/Fm、PIABS、ABS/CS0、RC/CS0、TRo/CS0和ETo/CS0荧光参数均呈现逐渐降低的趋势,在初始铀浓度30 mg/L下最小,分别较对照组下降47.7%、83.8%、68.7%、90.0%、87.7% 和 87.3%。从图5-D看出,伊乐藻叶片的快速叶绿素荧光曲线J、I和P点处的荧光值大小为初始铀浓度0 mg/L>10 mg/L>20 mg/L>30 mg/L,且随着初始铀浓度的增加曲线形状趋于平缓。同时在初始铀浓度30 mg/L下,J、I和P处荧光值分别较对照组下降41.4%、46.5%和49.2%。
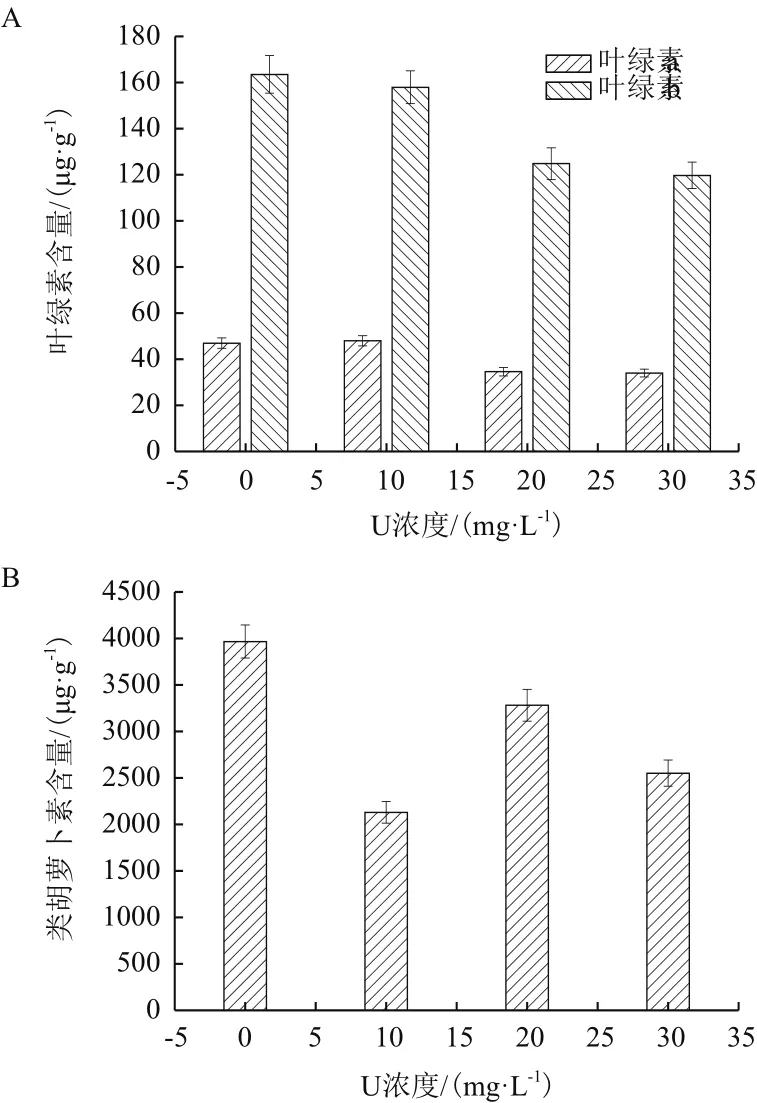
图4 伊乐藻类胡萝卜素含量和叶绿素含量

图5 伊乐藻在铀胁迫下的荧光指数
2.6 铀胁迫下伊乐藻光合参数的响应
由图6可以看出,随着初始铀浓度升高,净光合速率(Pn)、气孔导度(Ga)、胞间CO2浓度(Ci)均呈现下降趋势。在初始铀浓度30 mg/L下,三者分别较对照组下降82.1%、20.5%和6.4%,且光合速率下降得较为显著,而胞间二氧化碳浓度变化幅度不大。
3 讨论
目前大量研究发现,水生植物空心莲子草等对铀具有富集能力[14],这为植物修复铀污染废水提供了可能。贾文甫等[15]发现生物量是植物对逆境胁迫响应的常用指标,且单株总提取量能很好的反应出植物的富集能力[16]。在本实验中,在一定浓度内的铀促进伊乐藻生长,如初始铀浓度20 mg/L处理促进了伊乐藻生长,但仅干重显著高于对照组,此后,随着初始铀浓度的升高伊乐藻生长性能下降,这与姚天月等[17]研究的情况相似,说明伊乐藻对铀有一定的耐受性,低浓度的铀对伊乐藻生长有一定促进作用。当水体中铀浓度超过一定阈值,伊乐藻出现了生长抑制的现象。
随着初始铀浓度不断上升的同时,伊乐藻对铀的富集量也相应增加,当初始铀浓度为30 mg/L时达到最高为14.0 mg/kg干重(Dry weight,DW),这与韩旭等[13]研究发现相似,说明伊乐藻能在一定范围初始铀浓度下正常生长,同时对铀有较好的富集特性。伊乐藻的单株总提取量随着初始铀浓度升高,也逐渐上升。在初始铀浓度为30 mg/L时达到最大,为21.266 μg。在初始铀浓度为10 mg/L时,BCF系数达到最高。可能是铀溶液浓度较低时,有利于伊乐藻吸收和转运物质。伊乐藻的单株总提取量在初始铀浓度为30 mg/L时,为21.266 μg,且BCF<1,不满足重金属超富集植物的其中指标(Cd为 100 mg/kg,Pb 为 1 000 mg/kg 等,BCF>1)[15],因此在本实验条件下伊乐藻不是铀超富集植物。
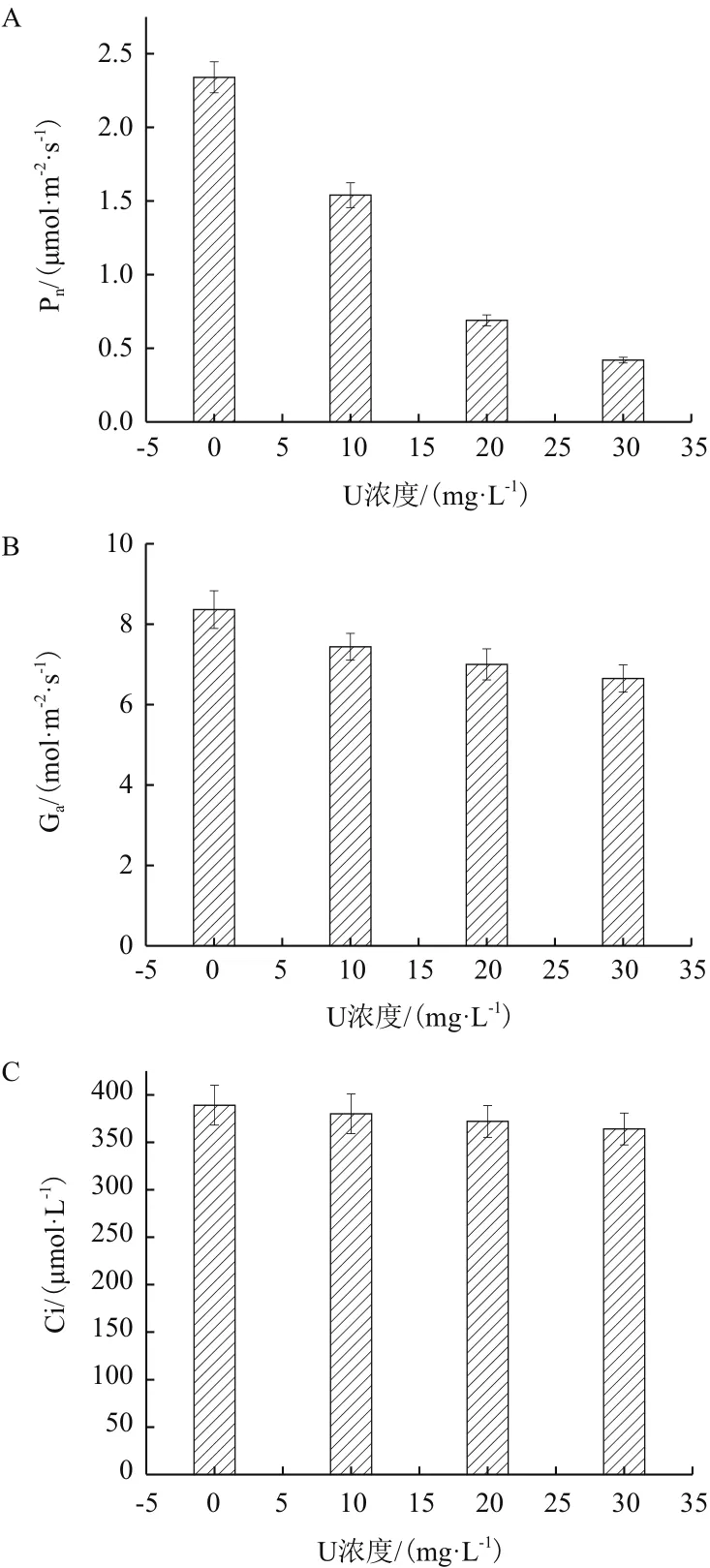
图6 伊乐藻在铀胁迫下的光合参数变化
植物在逆境下会通过抗氧化酶的变化来抵抗胁迫[18-20]。本实验中,随着初始铀浓度增加,POD活性、CAT活性呈现先上升后下降的趋势。在铀胁迫下,伊乐藻SOD活性呈现下降趋势,在30 mg/L的初始铀浓度下时最低,且显著低于对照组,与谢晓红[21]研究相似,说明伊乐藻内部的自由基累积量超过了自身SOD的清除能力。当溶液中初始铀浓度为10 mg/L时POD活性达到最大,当初始铀浓度大于10 mg/L时,出现下降趋势,可能是初始铀浓度大于10 mg/L时POD的活性受到了抑制,清除过氧化物的能力下降。当初始铀浓度为10 mg/L时CAT活性达到最大随之逐渐下降但仍高于对照组,可能是由于CAT活性逐渐下降导致植物体内H2O2的积累,造成细胞膜结构的损害。植物在逆境胁迫时主要产物MDA是反应膜脂过氧化强弱的指标[22]。马剑敏等[23]研究发现,植物MDA含量随着重金属浓度的增加,会出现先上升后下降的趋势,本实验也出现相同的趋势。在初始铀浓度为20 mg/L时MDA含量达到最大,此时伊乐藻叶片膜质过氧化程度加剧,植物受害加重。当初始铀浓度大于20 mg/L时,MDA含量下降,说明此时的伊乐藻已经慢慢失去对铀胁迫的应激能力,膜结构的破坏程度也逐渐上升。可见,伊乐藻抗氧化酶在应对铀胁迫时产生了抵抗作用,MDA含量在铀胁迫时也高于对照组含量,对铀具有较好的耐受性。
植物叶绿素含量通常可以反映出植物的生长情况[24]。叶绿素在植物受到胁迫时伊乐藻的叶绿素含量,随着初始铀浓度升高,呈现下降趋势。当初始铀浓度为30 mg/L时,叶绿素a、叶绿素b达到最低。原因可能是随着铀浓度的增加导致伊乐藻的叶绿体整体结构受到破坏,最终表现为叶绿素总含量下降。说明伊乐藻的叶绿素对铀胁迫较为敏感。随着铀浓度增加,类胡萝卜素含量呈现先升高在降低的趋势,在初始铀浓度为20 mg/L时,类胡萝卜素最高仅次于对照组,说明此时伊乐藻类胡萝卜素含量的增加有利于增加天线色素的热耗散,此时降低了PSⅡ反应中心的破坏程度。当铀浓度继续增大的同时,类胡萝卜素含量下降,说明此时PSⅡ反应中心的破坏程度加剧。
PSⅡ系统是植物内部对重金属离子作用最敏感的部位[25],本实验中伊乐藻的最大光化学效率(Fv/Fm)和光合性能指数(PIABS)均随着初始铀浓度上升呈现下降的趋势,与谢佳佳等[26]研究相似,说明伊乐藻的PSⅡ系统受到不同程度的影响。随着初始铀浓度的不断上升使得伊乐藻的ABS/CS0RC/CS0、TR0/CS0、ET0/CS0均呈现下降趋势,在30 mg/L初始铀浓度下,伊乐藻的PSⅡ受到了严重的影响。许多研究发现[27-30],植物的荧光动力指数会随着胁迫程度的上升,出现下降的趋势。本研究也出现了相似的趋势,可能是铀胁迫下导致伊乐藻PSⅡ反应中心活性和原初光能转换效率降低,PSⅡ潜在活性被抑制,PSⅡ的电子传递能力下降,使得伊乐藻的PSⅡ活性下降。典型的快速荧光动力学曲线在荧光上升阶段有O、J、I和P相,由图5-D可以看出,伊乐藻的曲线形状随着初始铀浓度的增加逐渐变得平缓,与Appenroth等[31]研究紫背萍在镉胁迫下的趋势相似,说明铀胁迫下引起伊乐藻的荧光曲线改变,同时反应出在铀胁迫下损伤了PSⅡ受体侧的电子传递[32-34]。表明铀胁迫对伊乐藻的叶片光合机构影响主要是PSⅡ及光系统反应中心受到损伤,电子传递过程受到了抑制。
植物在受到胁迫时其光合速率下降受到气孔限制和非气孔限制两方面影响[35]。随着初始铀浓度的增加,伊乐藻的Pn、Ga、Ci均呈现下降趋势,同时伊乐藻Ci随Ga下降而下降,说明Pn下降主要受气孔限制的影响。
4 结论
本实验对不同初始铀浓度下伊乐藻的生理响应及富集特性进行研究,从伊乐藻的抗氧化酶活性、丙二醛含量、荧光动力学指标、叶绿素、光合参数的变化情况来看,伊乐藻对铀有耐受能力。但是伊乐藻未达到铀超富集植物的标准,且在封闭室内条件下进行存在一定的限制,不会造成生态破坏,而伊乐藻在开放的环境下的生理特性和富集特性还需要进行更深入的探究。

