术后放疗在pT1-2N0M0乳腺癌中的作用—基于倾向性匹配评分法分析*
朱婷,单蓉,汪凤,李战战,黄隽,周卫兵
(中南大学湘雅医院 1.肿瘤放疗科;2.乳腺外科,湖南 长沙 410008)
在早期浸润性乳腺癌治疗中,T1、T2期伴腋淋巴结转移≥4个者具有术后放疗指征已取得广泛共识[1],但淋巴结阴性患者,放疗的价值仍存有很大争议。对pT1-2N0M0患者而言,总体复发率低,预后好,一般不需要术后放疗[2],美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南也不建议常规行术后放疗[3],但有研究显示,pT1-2N0M0患者中高危亚组患者复发率高达20%以上,建议pT1-2N0M0患者给予选择性放疗[4-7]。本研究回顾性分析了993例pT1-2N0M0浸润性乳腺癌患者,在未放疗患者中分析术后影响局部复发率的独立预后因素,并运用倾向性匹配评分法分析探讨术后放疗价值,现报道如下。
1 资料与方法
1.1 临床资料
收集1998年8月- 2008年8月根治术后pT1-2N0M0浸润性乳腺癌[国际抗癌联盟(Union for International Cancer Control,UICC)第七版]993例。按是否行术后放疗分为放疗(postmastectomy radiotherapy,PMRT)组和未放疗(non-postmastectomy radiotherapy,NPMRT) 组。PMRT组116例(11.7%),NPMRT组877例(88.3%)。年龄(50±11)岁,T1期352例,T2期641例,中位淋巴结清扫数目(14±5)枚。患者临床病理特征见表1。
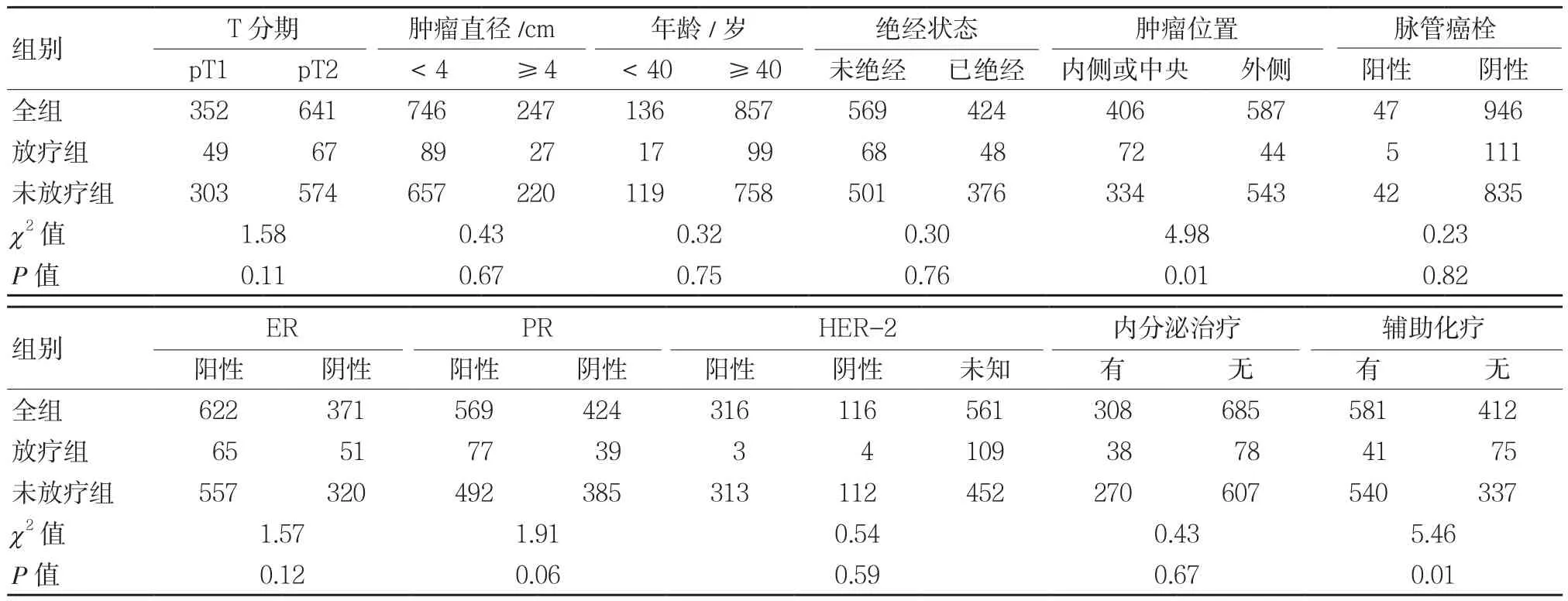
表1 患者临床病理特征 例
1.2 治疗方式
①手术治疗:根治术554例,改良根治术439 例。②术后放疗:共116例患者术后接受放疗,开始放疗时间距手术时间(54±38)d,其中手术至放疗时间>6个月的2例。所有患者均接受了同侧锁骨上及内乳淋巴结引流区的放疗。分次剂量为 1.8~2.0 Gy,总剂量46~50 Gy,中位剂量50 Gy,分25次。③术后化疗:581例接受术后辅助化疗,化疗方案为CMF(环磷酰胺+甲氨蝶呤 +氟尿嘧啶)(576例)/CEF(环磷酰胺+表柔比星+氟尿嘧啶)(5例),化疗周期为4~6周期。④术后内分泌治疗:308例雌激素受体(estrogen receptor,ER)阳性/阴性或孕激素受体(progesterone receptor,PR)阳性患者接受内分泌治疗,口服三苯氧胺中位时间(3±2)年。⑤靶向治疗:316例人表皮生长因子受体-2(human epidermal growth receptor 2,HER- 2)阳性患者均未接受曲妥珠单抗靶向治疗。
1.3 统计学方法
本研究主要目标是局部区域复发率和总生存率。局部区域复发率(local regional recurrence,LRR):同侧胸壁、锁骨区域、腋窝或内乳区域复发 ;总生存率(overall survival,OS)确定为任何原因导致的死亡,从手术时间到死亡时间或最后一次随访时间进行计算。
使用SPSS 23.0统计软件包建立数据库,采用Kaplan-Meier法分析局部区域复发率和总生存率,用Logrank法检验各亚组间的差异。采用Cox回归模型进行单因素和多因素分析。P<0.05为差异有统计学意义。应用SPSS 23.0的拓展程序倾向评分匹配法(Propensity Score Matching,PSM)分析,采用1∶3最近邻匹配法,设定卡钳值为0.2进行倾向性匹配分析。
2 结果
2.1 全组局部复发与总生存情况
中位随访时间(97±33)个月,8例失随访,随访率99.2%。共65例复发,复发中位时间(29±33)个月。局部复发部位有:同侧胸壁31例、同侧锁骨区域11例、同侧腋窝1例、内乳1例、胸壁伴锁骨区域14例、胸壁伴腋窝2例、胸壁伴内乳2例、胸壁伴锁骨及内乳3例。117例死亡,中位时间(63±23)个月,死亡原因有远处转移59例、复发伴转移53例、脑溢血2例、肝硬化失代偿1例、死因不详2例。
2.2 局部区域复发对生存的影响
全组患者5、10年LRR分别是5.6%、6.8%。全组患者5、10年OS分别是94.5%、86.8%。出现和未出现局部区域复发患者两组的5年OS分别为66.2%和96.5%,差异具有统计学意义(P=0.001)。
2.3 生存情况和预后因素分析
NPMRT组和PMRT组患者的5年LRR分别为6.1%和5.5%,10年LRR分别为6.9%和6.4%,差异无统计学意义(P=0.761)。NPMRT组和PMRT组患者的5年总生存率分别为94.4%和95.7%,10年OS分别为86.5%和88.4%,差异无统计学意义(P=0.437)。
NPMRT组中单因素结果分析显示LRR的危险因素有:年龄<40岁(P=0.001)、未绝经状态(P=0.001)、肿瘤直径≥4 cm(P=0.012)、位于内侧或中央区(P=0.014)及ER阴性(P=0.001);多因素分析显示LRR的独立危险因素有:未绝经状态(P=0.017)、肿瘤直径≥4 cm(P=0.040)、位于内侧或中央区(P=0.018) 及 ER阴 性(P=0.002),见表 2。
按危险因素的个数将pT1-2N0M0乳腺癌分为高危组、中危组和低危组。将同时具备4个危险因素定义为高危组,同时具备3个危险因素定义为中危组,2个或以下定义为低危组。进一步分层分析的结果显示高风险组5年/10年LRR为21.1%/24.5%,中危组5年/10年LRR为14.2%/15.1%,低危组5年/10年LRR为3.2%/4.4%(P=0.001)。全组人群中各个亚组LRR和OS见图1。
采用PSM进行1∶3最近邻匹配法,370名PSM匹配患者(NPMRT组:PMRT组 =254∶116),匹配后整体均衡性采用独立样本t检验,具体临床特征见表3。

表2 NPMRT组10年LRR的单因素与多因素分析结果
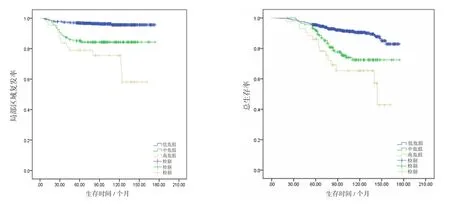
图1 低危组、中危组和高危险组的局部区域复发率与生存率
PSM分布图也提示匹配优良,评分分布直方图见图2。
在不同亚组间比较放疗对LRR或OS的意义,其中在低危组、中危组无明显差异(P=0.715/0.215、P=0.880/0.377),高危组术后放疗对减少局部复发及改善总生存有意义(P=0.035/0.034)。各个亚组的LRR见图3,各个亚组的OS见图4。
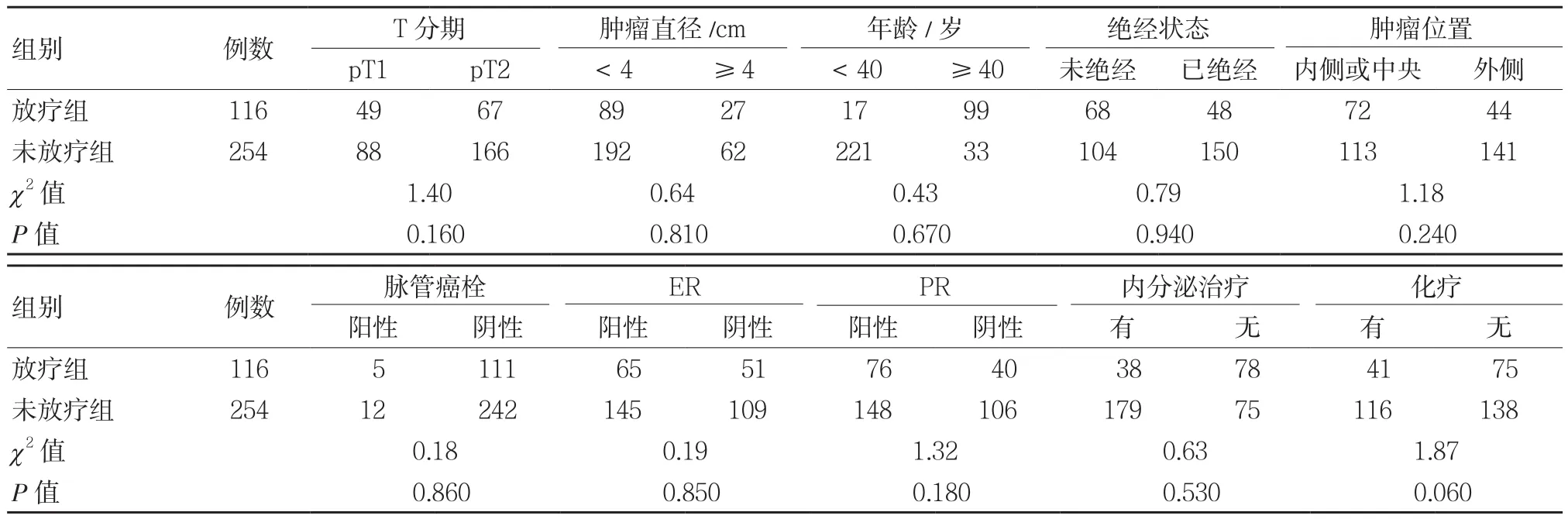
表3 倾向评分匹配后370例患者的临床特征 例
图2 倾向评分分布直方图
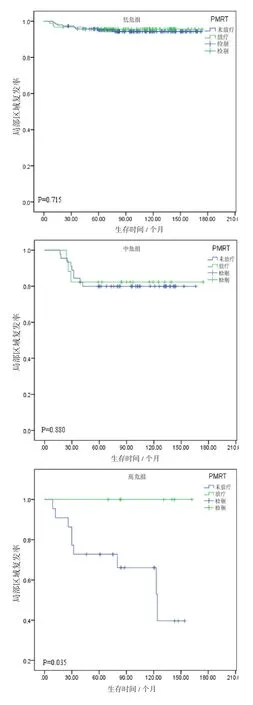
图3 匹配后低危组、中危组和高危险组的区域复发率比较
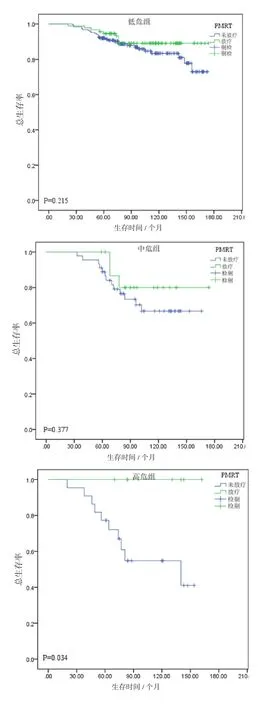
图4 匹配后低危组、中危组和高危险组的总生存率比较
3 讨论
乳腺癌被认为是一种异质性疾病,术后局部复发多出现在术后2年左右,而局部复发易致远处转移和影响总生存,直接导致部分患者治疗的失败[8]。乳腺癌根治术后放射治疗通过减少乳腺癌局部复发来降低乳腺癌的死亡率,目前根治术后放疗的指征主要基于腋窝淋巴结状态[9-11]。有部分研究报道pT1-2N0M0患者术后放疗无获益,由于术后放疗导致心血管疾病和肺癌的风险增加,特别是在放射治疗后的第2个十年,非乳腺癌死亡率的上升部分抵消了乳腺癌特有死亡的减少[11-14]。加拿大临床试验组国家癌症研究所(NCICCTG)MA20[15]和欧洲组织的癌症研究和治疗(EORTC)22922[16]随机对照试验的10年结果显示,在包括高危N0患者在内的患者群体中,在全乳腺放疗中增加了区域淋巴结放射治疗,从而提高了无病生存率。pT1-2N0M0组高复发亚组患者因为转移负荷低,放疗减低局部复发后可能更容易转化为生存获益。NCCN指南[3]也建议pT1-2N0乳腺癌位于中央/中心肿瘤或T2,合并年龄≤40岁或广泛脉管癌栓等高危因素的患者考虑行术后放疗,但是指征宽泛,造成临床选择困惑。
目前具体pT1-2N0M0乳腺癌局部复发高危亚组的特征尚无共识。有研究表明年轻患者具有更高的侵袭性,这可能与其ER阴性率伴高级别、HER-2阳性率和3阴性乳腺癌发生率高相关,且年轻患者乳腺癌1号基因(breast cancer susceptibitity gene 1,BRCA 1)或乳腺癌2号基因(breast cancer susceptibitity gene 2,BRCA 2)突变率更高,更易导致乳腺癌发生[17]。Kent等[5]对12项研究进行meta分析,结果表明年龄≤40岁是局部复发相关的一个独立的重要因素。Sharma等[18]也报告了类似的结果。本研究中,年轻是一个危险因素,但并非独立风险因素,绝经前状态是独立风险因素,可能是因为未绝经患者大都年龄 <40 岁。绝经前患者的10年LRR发生率为9.4%,绝经后患者为3.7%(P=0.001)。虽然大部分关于淋巴结阴性早期乳腺癌危险因素研究中未提及这一因素,但Jagsi等[4]认为绝经前状态是LRR的重要独立预测因素(HR2.8;P=0.005)。
分子亚型对淋巴结阴性乳腺癌患者LRR的影响也是有争议的。3阴性、HER-2过表达与高LRR相关,但本研究HER-2表达与LRR关系不具备显著性差异。但ER阴性患者在本研究中属于独立预后因素。Truong等[6]分析了1 505个T1- 2N0的乳腺癌患者也认为ER阴性患者较高局部复发率(P<0.05)。Trovo等[19]也支持这个结果。
肿瘤大小的增加与pT1-2N0M0乳腺癌的高LRR有关。Jagsi等[4]在分析淋巴结阴性乳腺癌患者影响LRR因素的研究中,肿瘤直径 >2 cm是LRR最显著的独立预测因素(HR 3.8;P=0024)。肿瘤直径>2 cm的患者10年LRR率为 11%,≤2 cm者为 3.1%(P=0.001)。Truong等[6]报道了类似结果。不同试验中,对肿瘤大小的界定是不一致的。在笔者的研究中,肿瘤直径 ≥4 cm的患者5年OS为7.1%,肿瘤直径 <4 cm患者的5年OS为9.4%(P=0.01)。Katz等[20]支持这个结果。因此对于pT1-2N0M0患者,肿瘤直径 ≥4 cm是影响LRR的危险因素。
肿瘤位于中央或内侧被认为更容易出现复发及转移。对于腋窝淋巴结受累的乳腺癌肿瘤位于内下象限较外上象限复发概率高[21]。EORTC22922/10925研究[16]中对N0肿瘤位于中央或内侧具备高LRR,本研究也正证实这一点。
总体来说pT1-2N0M0患者复发率低,并非所有的患者都能从放射治疗中获益。2014年早期乳腺癌试验协作组(early breast cancer trialists collaborative group,EBCTCG)[22]的Meta分析结果认为pT1-2N0M0患者放疗并未减少局部复发、总复发及乳腺癌特异死亡率。本研究结果也提示在pT1-2N0M0乳腺癌总人群中,术后放疗无明显获益,但同时具有肿瘤直径≥4 cm、肿瘤位置(中央区或内侧)、未绝经状态以及ER阴性为高危复发亚组人群的特征。本研究993例患者中有43例(4.3%)符合高危复发患者,需进行术后放疗;经PSM匹配后高危患者29例,其中行术后放疗的6例患者10年内均未出现局部区域复发。因此,pT1-2N0M0乳腺癌需要行术后放疗的为一小部分,高度选择人群,到目前为止,临床、病理、免疫组化与生物特征仍是预测个体复发风险的主要方法。据报导21基因检测、循环肿瘤细胞等可预测乳腺癌患者的LRR和放疗价值[23]。本研究属于回顾性分析并缺乏抗HER-2治疗手段,需进一步联合基因检测、病理特征及治疗反应等生物学信息,进行大样本前瞻性研究pT1-2N0M0术后放疗的高选择性人群。

