52例重症患儿万古霉素应用合理性评价及血药浓度监测分析*
季 兴,孙 尧,许 静
南京医科大学附属儿童医院 药学部,南京 210008
万古霉素为临床上常用的糖肽类抗菌药物,在儿科广泛用于治疗耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)引起的严重感染[1]。美国感染病学会(Infectious Diseases Society of America,IDSA)于 2011 年发布的“指南”中提出了万古霉素用于治疗成人和儿童MRSA感染的治疗方案[2]。为了提高临床有效性,减少耐药突变菌的产生,“指南”推荐给予肾功能正常的患儿万古霉素 15 mg·kg-1,每 6 h一次,即 60 mg·d-1;对于一些由金葡菌导致的复杂性感染,如菌血症、心内膜炎、脑膜炎等,推荐万古霉素的血药谷浓度保持在15~20mg·L-1。随着MRSA检出率的增加,在患儿中如何合理有效地应用万古霉素治疗、在重症患儿中常规的给药剂量是否能够达到目标血药浓度等,仍是临床需要解决的问题。本文旨在对我院儿童重症监护病房(PICU)内万古霉素的使用情况、血药浓度检测结果及临床疗效进行分析,以期为促进万古霉素在PICU临床使用的个体化给药方案提供参考。
1 资料与方法
1.1 一般资料
作回顾性分析。收集2015年7月~2016年12月PICU应用万古霉素的患儿病例。同时收集患儿相关的临床信息,统计信息包括:患儿的一般资料、临床诊断、万古霉素使用剂量、频率和疗程、血药浓度检测时间及结果、病原学送检率及培养结果、临床感染指标、临床转归及住院天数等。
所有纳入调查的患儿均静脉使用万古霉素进行抗感染治疗,用药时间不少于3 d;药物浓度监测时间为用药第3天血药浓度稳态后,于下次给药前5~10 min采取静脉血进行万古霉素血药浓度的测定。
1.2 仪器与方法
Viva-E全自动药物检测分析仪 (德国Siemens公司)。血浆样品采用均相酶放大免疫法(enzyme multiplied immunoassay technique,EMIT)进行分析检测。
1.3 疗效评价
根据患儿体温、血常规、炎症指标 (PCT and CRP)、影像学检查及细菌培养等情况,将患儿的疗效评价分为治愈、好转和无效。治愈:体温、血常规、CRP、PCT等实验室检查及病原学检查均恢复正常;好转:临床表现好转,生命体征平稳,影像学指标好转或白细胞计数(WBC)、中性粒细胞百分比(N%)等实验室指标内有1项恢复正常;无效:疗程结束,体温未恢复正常,病情无明显改善甚至加重。
有效率(%)=(治愈例数+好转例数)/总例数×100%
1.4 用药合理性评价
评价标准:综合药品说明书 (厂家:Eli Lilly-Japan K.K,)、《抗菌药物临床应用指导原则》、《万古霉素临床应用中国专家共识》[3]、《万古霉素临床应用剂量中国专家共识》[4]、美国《万古霉素治疗成人金黄色葡萄球菌感染的治疗监测实践指南》[2]、《抗菌药物临床应用管理办法》中的相关规定,从以下几个方面进行评价:①药物选择(适应症):万古霉素为治疗MRSA所致感染的首选药,也可治疗PRSP、氨苄西林耐药的肠球菌等耐药的革兰阳性球菌所致严重感染,如脓毒症、感染性休克、感染性心内膜炎、骨髓炎、脑膜炎等。②病原学检查:患者血液、体液或分泌物培养检出万古霉素敏感的病原菌。③给药剂量:儿童、婴儿每天 40 mg·kg-1,分 2~4次静滴。④给药浓度:万古霉素配制时溶媒为0.9%氯化钠注射液或5%葡萄糖注射液,药物配制浓度应低于0.5%(1 g/100 mL)。⑤用药疗程:用药疗程小于3 d为用药疗程不合理。
1.5 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以均数±标准差)表示,患者一般资料组间比较采用t检验,疗效分析采用Mann-Whitney秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况
本研究共纳入2015年7月~2016年12月入住PICU且使用万古霉素进行抗感染治疗的重症患儿52例,其中应用万古霉素治疗且进行血药浓度检测的为24例,设为TDM组;使用万古霉素进行治疗但未进行血药浓度检测的为28例,设为非TDM组。TDM组中男性19例,占79.17%;非TDM组男性18例,占64.28%;年龄分布于2个月~13岁,平均年龄30.8个月,其中小于1岁的患儿27例,占51.92。患儿的临床诊断包括脓毒症、感染性休克、重症肺炎、急性肾衰竭等;平均住院天数28.38天。两组患儿的性别、年龄分布、用药疗程无统计学差异。
2.2 用药情况
2.2.1 病原学检查 52名患儿均在万古霉素使用前进行了病原学检查,送检标本包括血液、痰液、导管培养、气管插管、腹水、脑脊液等,病原菌分布及药敏结果见表1。2.2.2 治疗用药 在TDM组中,万古霉素的使用均为治疗性用药,无预防用药,治疗用药率100%;其中,经验性用药16例,占66.7%。在TDM 24名患儿中,10例患儿的药敏结果与药物选择一致;2例未培养出敏感菌,但患儿病情好转,故继续用药;2例患儿未培养出敏感菌且病情无好转则更换治疗药物;2例患儿因发生药物不良反应而停药。治疗性用药8例,占33.3%,均培养出万古霉素敏感菌,根据药敏试验结果选择治疗药物。两组患儿也在用药前留取标本进行细菌培养和药敏试验。病原菌培养送检率100%。

表1 TDM组与非TDM组患儿病原菌培养分布及药敏试验结果
2.3 治疗结果
2.3.1 用药合理性 52名患儿均采用静脉滴注的给药方式,初始剂量给予万古霉素10 mg·kg-1q6h,给药时间为30min内,平均用药疗程为12.5 d。给药途径和给药剂量、疗程均为合理。所有患儿均在用药前留取标本进行细菌培养和药敏试验,根据患儿病情和临床指征等经验性使用抗菌药物,并根据药敏试验结果及时进行治疗药物调整,药物选择及病原学指标合理。52名患儿中2例患儿给药浓度超过0.5%,为药物浓度不适宜,属万古霉素稀释浓度未达评价标准。浓度过高可能会增加肾毒性,经药师建议后调整到适宜的浓度范围内。总体用药合理性为 96.1%(50/52)。
2.3.2 血药浓度分布 在52名使用万古霉素的患儿中,24名患儿在用药后进行了万古霉素的治疗药物监测,万古霉素TDM监测率为46.15%。TDM组的万古霉素平均血药谷浓度为14.1mg·L-1。
初次血药谷浓度检测维持在目标浓度范围10~20 mg·L-1的有8例,占33.3%,其中达到重症患者血药浓度范围标准的仅4例,占16.67%;8名患儿中有1名因肝衰竭并同时进行CRRT治疗、而在血药浓度未达稳态时停药换成利奈唑胺治疗,记为退出;初次血药浓度检测谷浓度<10 mg·L-1的有10例,占比41.67%,其中4名患儿万古霉素调整给药剂量后再次进行血药浓度检测则浓度达标;1名患儿经两次调整给药剂量后,谷浓度仍未达到有效浓度范围内,记为无效,治疗药物更换为利奈唑胺;2名患儿因药敏结果显示非敏感菌且病情无好转而换药,记为退出。
初次血药浓度检测谷浓度>20 mg·L-1的有6例,占25%,其中2名患儿因出现皮疹而停药,记为退出;1名患儿调整给药剂量后血药浓度仍未达到治疗目标范围内、且病情无好转,记为无效;3名患儿调整万古霉素给药剂量减量后达到目标浓度范围。
血药浓度达标率由调整前的33.3%(8/24)上升至调整后的62.5%(15/24),调整前后的血药浓度分布见图1。
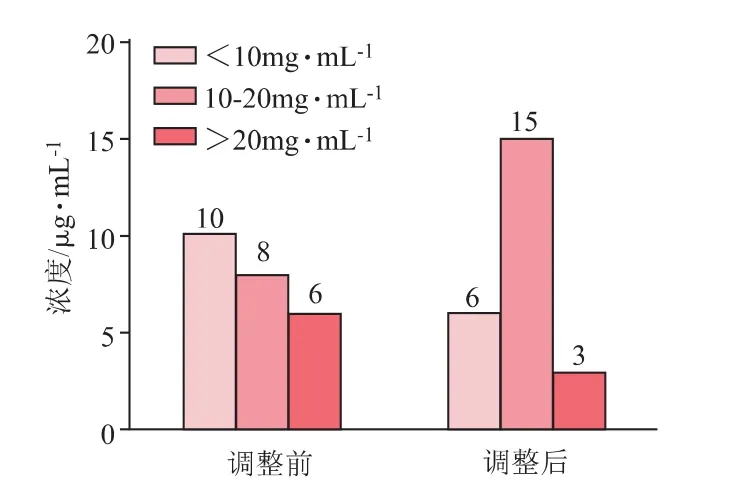
图1 万古霉素给药剂量调整前后TDM分布情况
2.3.3 临床疗效 TDM组与非TDM组的临床疗效比较结果见表2。在TDM组的24名患儿中,共5名患儿因药物不良反应或培养出非万古霉素敏感菌而停药,记为退出,治疗有效率 78.95%(15/19);非TDM组治疗有效率57.14%(16/28);两组患儿间万古霉素治疗的临床有效率,经秩和检验具有统计学差异(P<0.05)。万古霉素初次血药浓度测定与浓度调整结果见表3。其中,低浓度组中的4名患儿与高浓度组的3名患儿进行了给药剂量调整,调整后的谷浓度均保持在 10~20 mg·mL-1,临床表现好转,目标浓度组的有效率较低浓度组、高浓度组具有统计学差异(P<0.05)。

表2TDM组和非TDM组的疗效比较
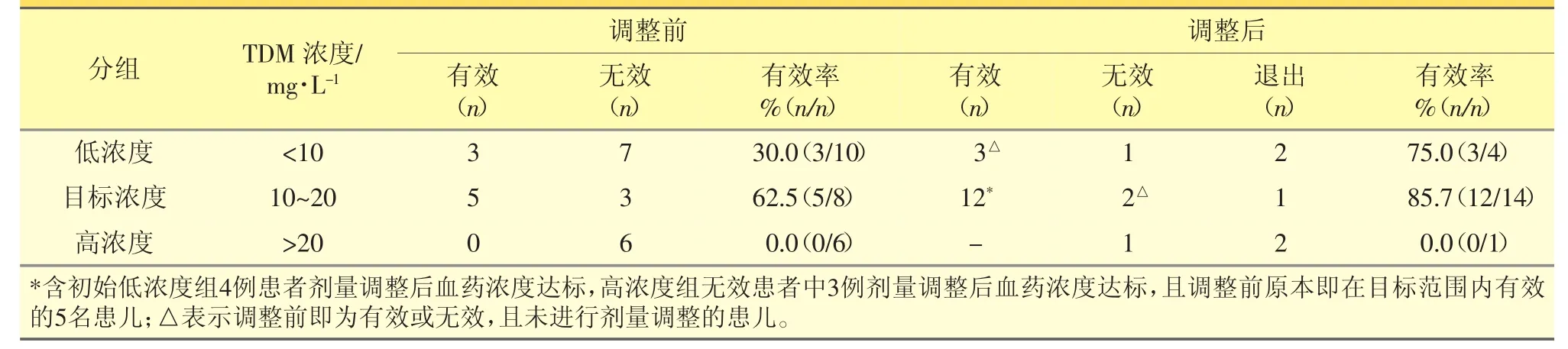
表3 TDM组万古霉素血药谷浓度(3种浓度)调整前后临床疗效
3 讨 论
3.1 药物使用合理性
ICU住院患者多合并院内感染,研究表明,其中75%的感染对一线抗菌药物呈耐药[5],其引起的相关感染与ICU患者死亡率密切相关。重症感染是ICU患者的主要死亡原因之一,特别是并发感染性休克的患者,其病死亡率高达80%[6]。早期适当的抗菌药物治疗可以降低重症患者的死亡率,提高生存率,改善临床预后。万古霉素作为特殊使用级抗菌药物,临床上用于治疗MRSA、PRSP、氨苄西林耐药的肠球菌等革兰阳性菌所致的感染。本研究纳入的52名重症患儿,均在使用抗菌药物之前进行了标本的留取和细菌培养,微生物送检率100%,达到特殊使用级抗生素使用前标本送检率不得低于80%的要求。后期根据微生物培养结果进行抗菌药物的调整,虽然经验性用药比例较高,但培养结果显示多为敏感菌,故治疗有效率较高,药物的选择基本合理。
3.2 治疗药物监测的必要性
万古霉素在治疗由MRSA引起的医院获得性肺炎、脑膜炎、心内膜炎等难治性感染时,血药谷浓度应在15~20 mg·L-1。而对于重症患者、特别是儿科重症患儿,其在不同的年龄段各器官功能发育不完全成熟,免疫力较成人低下,肝肾功能容易受损,药物在体内的过程有较大的个体间差异,按照“指南”推荐的60 mg·kg-1的日剂量使用,无法保证血药浓度能够保持在有效治疗范围内。国内对重症感染患儿的研究表明[7],小于7月龄患儿的血药浓度明显高于7月龄以上的患儿 (54.39 mg·L-1对32.77 mg·L-1),认为小于7月龄的患儿肾脏功能不够完善,万古霉素在体内代谢和排泄缓慢,其速度可能接近于新生儿水平,推荐按照新生儿给药方案用药,或通过监测血药浓度、结果来调整治疗方案。治疗药物监测不仅能为药物治疗的目标或抗菌药物剂量调整提供参考依据,还能间接反映抗菌药物使用的合理性,防止抗菌药物的滥用。《万古霉素临床应用剂量中国专家共识》[4]中也提出,万古霉素血药谷浓度是指导剂量调整最关键和最实用的方法。《美国感染病学会治疗成人及儿童甲氧西林耐药金黄色葡萄球菌感染临床实践指南》[8]建议,常规行TDM的患者主要包括新生儿、严重感染患者等。在本研究中,低浓度组4名患儿与高浓度组3名患儿均在TDM监测后及时调整了给药剂量,使血药浓度达到了治疗目标范围内,患儿最终表现为病情好转,TDM组的整体治疗有效率明显升高 (33.3%vs.78.95%,P<0.05)。
2011年IDSA提出,肾功能正常的重症感染患儿在分次用药至第4次给药前30 min内、测定万古霉素稳定血药谷浓度,最佳值应是15~20 mg·L-1,此时AUC/MIC,即AUIC常达到400,药物组织穿透力和临床预后均可明显改善[9],然而,万古霉素在体内的个体化差异,以及其较窄的有效浓度治疗窗,决定了其临床有效率在不同的患者、年龄、病理生理状态下具有较大的差异。研究表明[10],万古霉素临床治疗失败率从26.3%~64.4%不等。本研究发现,在纳入的52名患儿中,万古霉素的TDM检测率仅为46.15%,比例较低,多数患儿为医生根据经验和临床转归来调整给药剂量。TDM组的患儿接受“指南”推荐的万古霉素剂量10 mg·kg-1q6h的给药方式后,平均谷浓度为14.1 mg·L-1,但其中仅8例患儿在血药浓度达稳态后能够达到有效治疗范围内,达标率33.3%,而其中达到重症患者血药浓度标准15~20mg·L-1的仅4例,血药浓度达标率仅16.67%;根据TDM结果调整给药剂量后,万古霉素血药浓度达标率上升到62.5%,整体的治疗有效率也显示提高至78.95%,且较调整前具有统计学差异,表明TDM在临床治疗方案调整时,可提供重要的参考依据,并提高药物治疗的有效性和治疗成功率。
3.3 影响万古霉素谷浓度的因素分析
血药谷浓度的达标率较低可能与患者在重症感染下的病理生理因素有关。本研究纳入的均为重症患儿,且诊断多为重症肺炎、脓毒症等,由于其特殊的疾病状态和治疗措施等因素影响,患儿体内血浆蛋白含量、组织渗透性受炎症影响较大,万古霉素在体内药物代谢动力学过程也会发生一定变化。同时,部分患儿进行了输血、液体复苏治疗等,导致了其机体血容量改变、组织血流灌注改变,这些因素都能够干扰药物在血浆和组织之间的弥散和分布。OCAMPOS等[11]的研究显示,脓毒症患者中万古霉素的清除率会有明显的增加,导致其血药浓度降低,因此在使用万古霉素进行治疗时可能需要更高的负荷剂量,以使血药浓度尽快达到有效治疗范围内。由此可见,对于重症患儿的革兰阳性球菌引起的严重感染,按照临床常规剂量进行给药显然是不够的。也有研究表明[12],40~60 mg·kg-1·d-1的万古霉素剂量对于儿童重症患者往往达不到所需要治疗窗、即15~20 mg·L-1的谷浓度,故临床上不仅需要考虑患儿的病理生理状态,如根据患儿的肌酐清除率和每日的液体出入量来计算万古霉素的负荷剂量,并且要进行TDM检测,以便及时根据血药浓度来调整给药剂量和方式,同时需要根据患者的临床转归和指征判断药物治疗的有效性,再综合以上因素制定适宜的给药方案。但本研究中TDM组和非TDM组万古霉素治疗的临床有效率经过统计学分析并无差异,因考虑观察周期较短且样本量较小、纳入患儿的基本病理生理情况差异较大,后期拟继续收集更多样本加以研究。还要改进多点采血,进一步进行给药后AUC的计算,分析药动学(Pharmacokinetic,Pk)参数,以获得更加准确的结果。
对重症患儿应用万古霉素后进行治疗药物监测,有助于了解药物在体内的过程,及时根据病情调整给药方案,同时提高用药安全性,避免或减缓耐药菌的产生,提高临床治疗有效率,对提高患儿的治愈率至关重要。

