乳头状甲状腺癌术后功能减低患者肠道 微生物群落的结构性变化
宋影春, 郁霞青, 李 丹
(同济大学附属第十人民医院核医学科,上海 200072)
甲状腺癌是一种多阶段、多因素的疾病,包括遗传易感性、生活方式、环境因素等[1-2],尚未发现哪种机制在抗肿瘤作用中占主导。微生态学研究认为,生命的本质是生物与其环境形成的生态平衡,而疾病的本质是神经-内分泌-代谢-微生物-免疫交叉网络系统中的生态失调[3]。近年来,肠道微生物群落成为新的研究热门。研究发现,基本所有慢性疾病的进程都与肠道微生物密切相关,包括代谢性疾病、自身免疫病甚至肿瘤[1-5]。乳头状甲状腺癌(papillary thyroid carcinoma, PTC)与代谢紊乱、自身免疫异常等密不可分。目前仍未有研究探索PTC与肠道微生物群落之间的关系。
人体有70%以上的黏膜免疫发生在肠道,通过复杂的免疫机制,肠道微生物群落与全身各器官发生紧密联系,其分布、产物及功能代谢通过调节宿主的免疫系统甚至分子信号通路从而产生深远影响[6]。从组织胚胎学看,甲状腺和甲状旁腺由原始消化管的前肠分化而来,提示甲状腺与肠道组织胚胎发育的同源性,表明了其与肠道菌群微生态失衡具有相似的病理结构基础。
目前,已有少量研究[7-8]初步报道了肠道微生物在自身免疫性甲状腺炎和甲亢中的作用;然而,PTC作为甲状腺疾病中最常见的恶性肿瘤,对于探究其发病过程中肠道微生态的研究仍无迹可求。本研究提出了假设,推测肠道微生物群落也与甲状腺癌病程息息相关;尝试性地探索了肠道微生物群落在甲状腺癌的特定病程中的变化,并与正常健康人群比较,希望能够对PTC相关肠道微生物群落的变化有新的认知。
1 资料与方法
1.1 样本收集
于2017年1—6月在同济大学附属第十人民医院核医学科住院病区,收集64例PTC甲状腺切除术后拟行131I清甲治疗的住院患者的粪便样本,所有患者入院前均已停用左甲状腺素钠片(优甲乐)4周,归类为甲癌(TC)组。所有患者根据病理结果入院时均诊断为PTC切除术后。此外,本研究对TC组进行再分类,以TPOAb=40IU/mL为桥本甲状腺炎诊断阈值,高于该阈值认定为阳性诊断。根据此标准将TC组的甲状腺癌患者分为合并桥本甲状腺炎(TPOAb+)组和不合并桥本甲状腺炎(TPOAb-)组。另招募15名健康志愿者为HC组。采集患者服用131I之前的粪便样本以及志愿者的粪便样本于-80℃保存。所有的患者与志愿者均排除肠道疾病及内分泌系统疾病,取样前1个月内未服用抗生素、微生物等。研究经我院伦理委员会批准,所有患者和志愿者在知情同意书上签名。
1.2 实验室检查
对64例PTC术后患者和15名健康对照者进行了血清学检测及粪便标本微生物组学分析。其中,血清学检测包括游离三碘甲状腺原氨酸(free triiodothyronine, FT3)、游离甲状腺素(free thyroxine, FT4)、甲状腺原氨酸(total triiodothyronine, TT3)、甲状腺素(total thyroxine, TT4)、促甲状腺素(thyroid-stimulating hormone, TSH)、TSH受体抗体(thyroid stimulating hormone receptor antibody, TRAb)、甲状腺球蛋白(human thyroglobulin, HTG)、甲状腺球蛋白抗体(anti-thyroglobulin antibody, TGAb)、甲状腺微粒体抗体(thyroid microsome antibody, TMAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody, TPOAb)、反三碘甲状腺原氨酸(reverse triiodothyro-nine, r-T3)、2h 甲状腺摄碘率(t2h)、24h甲状腺摄碘率(t24h)。
1.3 DNA抽提和PCR扩增
根据EZNA®Soil试剂盒(Omega Bio-tek, Norcross GA, US)说明书进行总DNA抽提,DNA纯度和浓度利用NanoDrop 2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;用正义链(5′-ACTCCTACGGGAGGCAGCAG-3′)和反义链(5′-GGACTACHVGGGTWTCTAAT-3′)对V3-V4可变区进行PCR扩增。
1.4 DNA测序
使用2%的琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Extraction Kit(Axygen Biosciences)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega, USA)进行检测定量。根据Illumina Miseq平台(Illumina Sandiego, USA)标准操作规程将纯化后的扩增片段构建双端(paired-end, PE)测序的文库并进行测序。
1.5 数据处理
使用UPARSE软件(Version 7.1 ,http://drive5.com/uparse)及RDP分类器(http://rdp.cme.msu.edu/)对序列进行操作分类单元(operational taxonomic units,OTU)聚类与细菌分类的注释。将TC组和HC组的数据分为两组,根据OTU聚类分析结果及分类信息,在属水平对群落结构进行统计分析。利用Majorbio I-Sanger Cloud(www.i-sanger.com)免费在线平台,与KEGG(Kyoto Encydopedia of Gene and Genomes)数据库,获得KEGG PATHWAY信息,用环境因子关联分析对两组患者的差异细菌与临床因素及功能代谢的相关性等多样本群落组成和系统发育信息进行深入的统计和可视化分析。
1.6 统计学处理
采用R语言包(V.3.4.3)对数据进行处理,用Student’st检验进行两组指数间及物种间差异比较。Mann-Whitney U检验用于比较组间临床因子的差异。应用Spearman秩检验处理相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 样本特征及测序信息
TC组和HC组的临床特征和实验室检查结果见表1。16S rRNA测序的结果显示,79个样本中得到了1941662个序列的信息,通过质量控制、过滤及重叠关系合并处理后,得到24578个读段,最终鉴别出1072个OTU用于后续分析。
2.2 PTC患者肠道微生物群失调
两组微生物的丰度及多样性分析结果如表1所示。TC组中Sobs、Ace、Chao这三种反映微生物丰富度的指数以及覆盖指数显著低于HC组(P<0.05)。此外,TC组中反映肠道微生物区系丰富度和均匀度的Shannon指数和Simpson指数也低于HC组,但差异无统计学意义(P>0.05)。上述结果提示,相比于HC组,TC组细菌丰富度降低。进一步分析了PTC术后患者中的TPOAb+组与TPOAb-组,结果显示两组间的TPOAb水平的差异具有统计学意义(P=0.045),而反映两组肠道微生物群落丰度及多样性的指数间的差异并无统计学意义(P>0.05)。
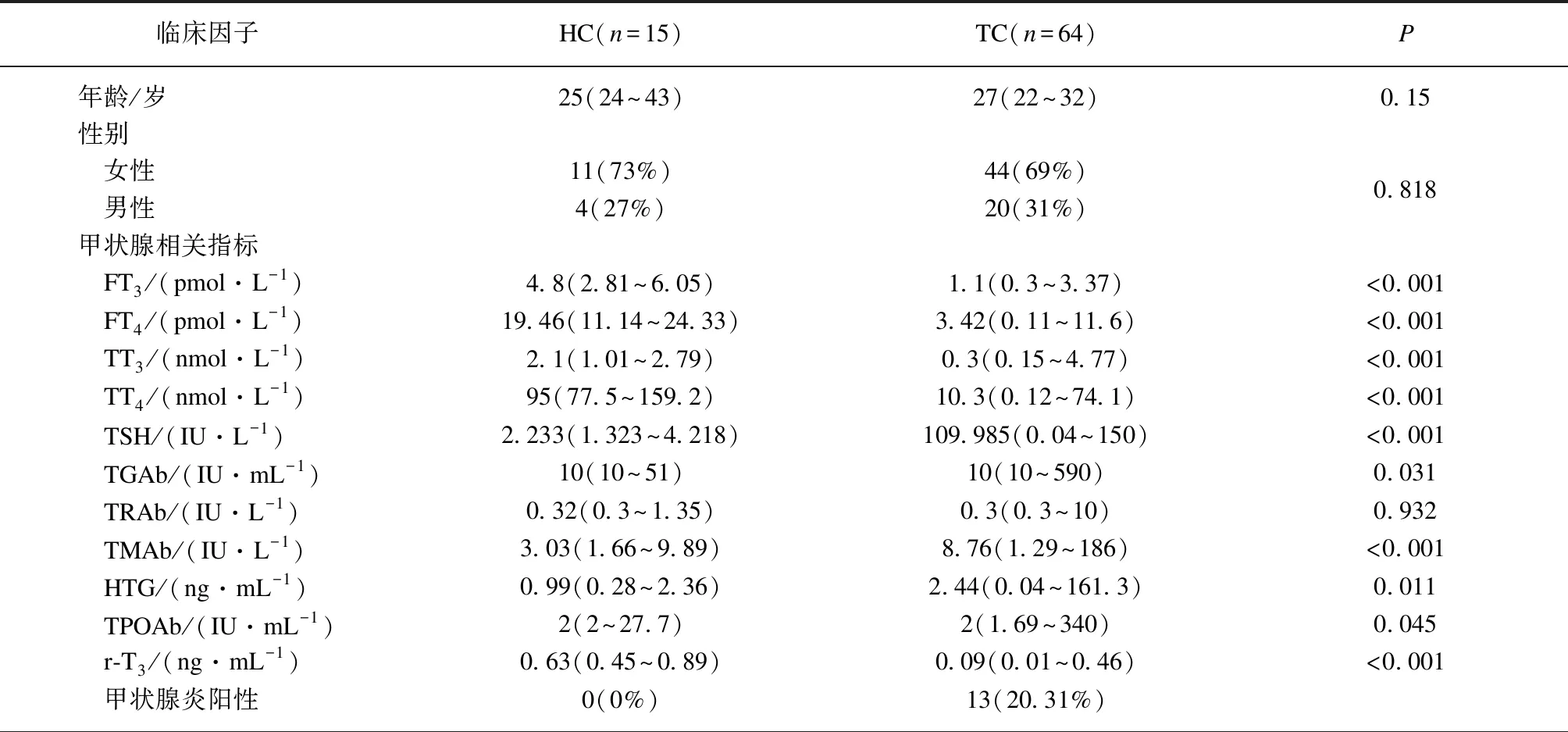
表1 甲状腺癌患者和健康对照的基本特征和临床指标
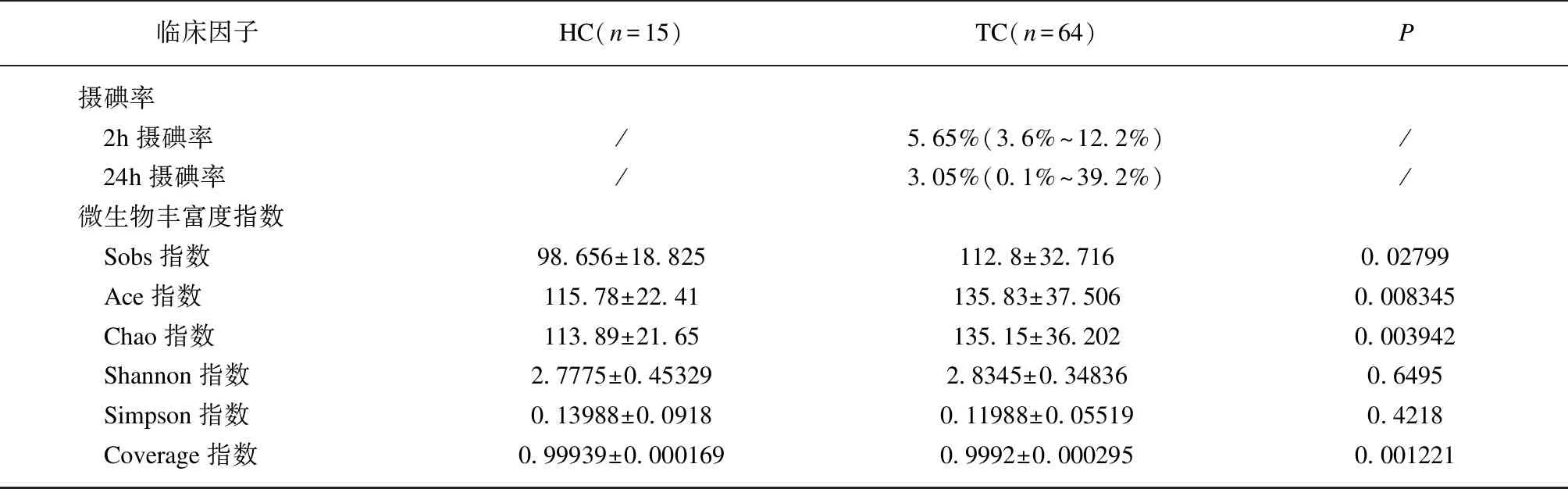
(续表1)


图1 属水平上肠道微生物群落的相对丰度Fig.1 The relative abundance of the gut microbiota on genus level
图1直观展示了TC组与HC组在属水平上的肠道微生物群落物种组成。属水平的物种差异分析结果显示拟杆菌(Bacteroides)、布劳特氏菌(Blautia)、直肠真杆菌(Eubacteriumrectalegroup)、双歧杆菌(Bifidobacterium)、Fusicatenibacter菌、霍氏真杆菌(Eubacteriumhalliigroup)的丰度在TC组与HC组间存在统计学差异(P<0.05)。其中,布劳特菌、直肠真杆菌、双歧杆菌、Fusicatenibacter菌、霍氏真杆菌在TC组中的丰度低于HC组,而拟杆菌在TC组中的丰度高于HC组,见图2。同时,这6种菌群表达在TPOAb+组和TPOAb-组之间的差异无统计学意义(P>0.05)。
2.3 差异菌与临床特征之间的相关性及差异菌功能注释分析
TC组6种不同细菌类群与PTC患者临床因素的相关性分析显示: TC组低丰度的布劳特菌与患者的年龄呈负相关(r=-0.3,P=0.016);直肠真杆菌与和2h摄碘率和24h摄碘率均呈负相关(r=-0.292,P=0.019);Fusicatenibacter菌与HTG水平(r=0.355,P=0.004)呈正相关,而与TGAb水平(r=-0.285,P=0.023)和TPOAb水平(r=-0.266,P=0.034)呈负相关,见图3。
另外,本研究用KEGG数据库的功能注释分析以及环境因子关联分析探索了两组间6种差异菌与功能性代谢之间的相关性。结果显示,拟杆菌与细胞膜和胞内结构分子呈正相关(r=0.351,P=0.004),与异喹啉生物碱生物合成呈负相关(r=-0.321,P=0.01);布劳特菌与异喹啉生物碱生物合成呈正相关(r=0.251,P=0.045);直肠真杆菌与细胞膜和胞内结构分子(r=-0.359,P=0.004)和糖基生物合成(r=-0.438,P<0.001)呈负相关;Fusicatenibacter菌与细胞膜和胞内结构分子呈负相关(r=-0.534,P<0.001)。

图2 属水平上的TC组和HC组间物种差异图Fig.2 Difference of species between TC group and HC group on genus level左侧为肠道微生物群落名称,柱长表示该微生物群落在该组内的相对丰度的比例;*P<0.05,**P<0.01,***P<0.001
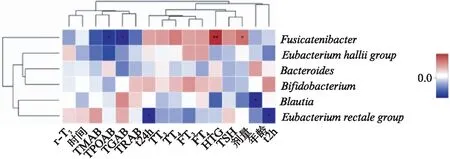
图3 肠道微生物群落与PTC相关临床指标相关性分析热图Fig.3 Heatmap of correlative analysis between related indicators in PTC and gut microbiota右侧为肠道微生物群落名称,下方为临床因子;*P<0.05,**P<0.01,***P<0.001
3 讨 论
人体肠道微生物组学研究需严格把控标本采集条件,避免外源性微生物污染。本研究纳入的标本均来自同济大学附属第十人民医院核医学病房待行131I核素治疗的患者。相对于门诊,在住院条件下采集患者粪,对于外源性微生物污染的影响因素的可控性较强。值得一提的是,本研究中所有患者具有一致的乳头状甲状腺恶性肿瘤病史,经甲状腺切除术后停止服用优甲乐4周,伴有“甲状腺功能减退”的临床表现。本研究只关注这些特殊情况下的PTC患者。在本研究中,PTC术后患者的甲状腺相关抗体水平高于正常人,反映了PTC术后患者的甲状腺免疫功能仍处于失调状态。研究[9]证明,PTC的发病过程伴随自身免疫疾病的参与。因此,本研究结果中的PTC术后患者的甲状腺免疫失调可能源于术前长期的PTC发生发展过程及术后干预的综合影响,而非单一因素的影响。本研究着重于观察甲状腺癌术后“甲减阶段”这一特殊群体的肠道微生物结构性变化,结果发现TC组与HC组间的确存在肠道微生物群落结构性差异,这从一定程度上或许可以帮助揭示PTC患者发病以来的、综合因素影响下的肠道环境的变化,从而为进一步研究肠道微生物群落变化与甲状腺癌发病机制间可能存在的相关性提供可能。
本研究发现,TC组微生物丰富度显著低于HC组。这一结果与最近的Graves病患者[10]和甲状腺功能亢进的动物模型[11]中肠道菌群研究结果一致。而在桥本甲状腺炎(Hashimoto’s thyroiditis, HT)患者的肠道微生物群落的研究中,HT患者肠道微生物群落的丰富度和多样性与健康对照相比稍高,但差异无统计学意义[12]。
此外,本研究显示,在属的层面上,6种肠道微生物群类在TC组中存在显著的丰度改变。这些微生物群类在肠道中的改变亦在其他疾病中报道过,包括Fusicatenibacter菌、霍氏真杆菌在溃疡性结肠炎患者中丰度的降低[13-14]、布劳特菌在炎性肠病患者中丰度的降低[15]、直肠真杆菌在糖尿病和肺结核患者中丰度的降低[16-17]。HT作为一种自身免疫疾病,参与PTC的病理过程[9]。而在甲状腺疾病HT患者的肠道微生物群落的研究中,布劳特菌、直肠真杆菌及霍氏真杆菌的相对丰度较健康对照是升高的,这恰巧与本研究结果相反。这些相反的结果可能与HT并存的不同的病理进程造成的肠道微生物群落的过度生长有关[12]。
而本次研究所收集的PTC患者中有20.31%合并HT,因此分析了TPOAb+和TPOAb-组之间的肠道菌群丰富度、多样性以及肠道微生物群类差异,以观察HT与肠道微生物群落改变之间是否存在相关性。结果显示,两组之间的肠道菌群丰富度和多样性指数以及肠道菌群的差异均无统计学意义,且TC组与HC组之间的差异菌在TPOAb+和TPOAb-组之间也无差异,这提示了在PTC患者中TPOAb的水平不是影响肠道变化的主要因素,HT可能也只是肿瘤的相关过程中的继发反应[18],本研究中在TC组中出现的肠道微生物群类差异更可能来源于PTC的影响。
从多个关于肠道微生物群落与其他器官的肿瘤关系的研究中可知,肠道微生物群落可以通过影响DNA损伤和凋亡、表观遗传修饰酶、免疫反应等途径产生致癌作用[19-21]。
TC组存在微生物群类显著改变是本研究的重要发现。研究表明,布劳特菌、Fusicatenibacter菌、双歧杆菌、直肠真杆菌与霍氏真杆菌均具有产生短链脂肪酸(short-chain fatty acids, SCFAs)的能力[13,15,22-23]。SCFAs被普遍认为对维持人体健康具有多种重要作用,除保护肠道黏膜屏障、降低人体炎症水平等作用[23],其主要成分包括醋酸、丙酸和丁酸诱导肿瘤细胞凋亡的能力在体内外均得到证实[24-25]。部分差异菌丰度的下降则会导致其代谢产物SCFAs的减少,削弱SCFAs对肿瘤细胞凋亡的诱导作用。
甲状腺与肠道在机体的空间分布距离虽然较远,但却共有丰富的血运及淋巴系统。已证实肠道微生物及其代谢产物能够通过淋巴液影响机体生理[26]。已经观察到HT患者的肠通透性增加[27],从而毒素、抗原或细菌代谢物可以由肠道进入淋巴循环系统[28]。因此,推测差异菌产生的SCFAs的变化可能通过这种机制作用于甲状腺癌的发生发展过程。
肠道环境中的微生物亦可能通过调节宿主的免疫对癌症的发生发展进行调节。研究表明,辅助T细胞17/调节性T细胞(Th17/Treg)的平衡向Th17倾斜,是PTC的发病机制[29]。而双歧杆菌会刺激T细胞向Treg细胞的分化[30],Treg细胞释放的IL-10可以改善癌症患者受损的抗肿瘤免疫功能[29]。在本研究中,双歧杆菌在TC组中显著减少,这可能导致Treg细胞分化的降低和IL-10水平下降。此外,双歧杆菌能使肿瘤细胞代谢的关键酶失活,阻断肿瘤细胞代谢的能量供应,使DNA合成的限速酶核糖核酸酶失活,从而抑制肿瘤细胞的增殖[31]。另外,直肠真杆菌及霍氏真杆菌产生的大量丁酸可以直接抑制免疫细胞中的一类细胞核组蛋白脱乙酰基酶和激活组蛋白乙酰转移酶的活性,影响机体的免疫功能[23],且两者均能抑制核转录因子NF-κB的激活,从而诱导细胞凋亡[32]。当双歧杆菌、直肠真杆菌及霍氏真杆菌的丰度下降时,其对于癌症代谢相关的酶类及转录相关因子的抑制作用减低,使得机体对于肿瘤细胞的监控作用减弱,从而导致肿瘤的发生。双歧杆菌丰度的降低介导肿瘤的发生已经在研究中得到验证[33]。推测双歧杆菌、直肠真杆菌及霍氏真杆菌的相对丰度的减低对甲状腺癌的发生也起到了一定的作用。
在本研究中,患者在甲状腺全切术后均按照医嘱服用优甲乐,甲状腺激素保持在相对正常的水平,在准备行131I消融治疗前停药4周,伴随出现激素水平发生改变的只有T3、T4及TSH。已知甲状腺激素可以影响消化道,故本研究只关注了差异菌群与甲状腺功能临床指标T3、T4及TSH的关系,结果显示差异菌群与甲状腺激素水平之间无显著相关。但是癌症对机体的影响不仅仅是甲状腺功能的改变,因此关于PTC对肠道微生物群落的影响还需进行进一步的探索。
本研究还发现直肠真杆菌与N-糖基的生物合成相关,已知N-糖聚糖与肿瘤的发生、复发和转移有关,这提示直肠真杆菌相对丰度的降低可能促进PTC的进展。但其机制尚不清楚,有待进一步研究。
当然,本研究也存在局限性。首先,参加本研究的受试者人数很少,未来应该继续增加采样。其次,虽然粪便样本易于获取,但粪便中的肠道微生物无法完全反映肠黏膜上的肠道微生物。此外,是否有定植细菌存在于甲状腺及其周围仍有待探索。本研究发现的现象的分子机制需要在体外和体内验证。同时,研究对象均为甲状腺切除术后甲减,随后的研究需增加那些最初被诊断为PTC而没有接受任何治疗的患者。
本研究发现了PTC患者术后131I治疗前伴随甲减表现的病程中,肠道微生物结构出现明显改变,这或许能为PTC相关的肠道微生物群落的变化提供新的认知。

