标本放置时间对单核细胞亚群检测结果的影响及原因分析
栾正云,黄 燕,沙 敏,徐 捷,叶 军,郭 婷
(泰州市人民医院 中心实验室,江苏 泰州225300)
单核细胞在调节炎症和参与炎性反应中发挥重要作用。外周血单核细胞依据CD14、CD16 的表达强度分为三个亚群:Mon1、Mon2、Mon3,其中Mon1 具有吞噬、蛋白水解及促炎作用[1],还能分泌促炎因子及粘附分子,能向发挥促炎作用的M1 型巨噬细胞分化,发挥免疫清除功能[2]。在炎症刺激的情况下,Mon2 单核细胞上的CD163被刺激并脱落,Mon2向Mon1转变[3]。这些不同亚群的单核细胞在疾病发生、发展中具有重要的意义。目前对单核细胞或单个核细胞检测结果受标本放置时间的影响有较多研究[4-7],但有关标本放置时间对单核细胞中不同亚群检测结果的影响尚未见相关研究。我们比较标本采集后不同的放置时间对单核细胞不同亚群检测结果的差异,为单核细胞不同亚群的临床检测和科研工作提供依据。
1 材料和方法
1.1 材料
1.1.1 仪器 流式细胞仪(FACSCalibur,美国BD)产品,用CELLQuest软件(美国BD)获取和分析实验数据。
1.1.2 试剂 CD45-PerCP (Code NO:347464)、CD14-FITC(Code NO:347493)和同型对照Mouse IgG2a-FITC(Code NO:349051)由BD Bioscience 公司提供;PE Mouse Anti-Human CD16(Clone:3G8)同型对照Mouse IgG1-PE(Clone:349043)由BD Phamingen公司提供。
1.2 方法
1.2.1 标本采集及保存 样本来源于完全随机法选择的20例我院健康体检者,所有受试者均于空腹抽取外周静脉血2mL,EDTA-K2抗凝,标本第一次检测于采集后1小时之内,随后在25℃放置4小时、8小时测定。
1.2.2 标本染色处理 将试管分为两组,测定组加 入CD45-PerCP 和CD14-FITC、CD16-PE 各20µL,对照组加入CD45-PerCP 和Mouse IgG2a-FITC、Mouse IgG1-PE各20µL;将标本充分混匀,分别加50µL标本于上述两管中,震荡器上充分混匀,避光放置15min;分别加入溶血素各2mL,充分震荡,避光放置10min。1500rpm 离心5 min 弃上清,各加入生理盐水2mL 震荡,1500rpm 离心5min 弃上清,各加入生理盐水100µL,充分震荡混匀,待测。
1.2.3 流式细胞仪器设置及数据分析 用FACSComp 调整仪器前向角(FSC)、侧向角(SSC)、荧光一(FL1)、荧光二(FL2)、荧光三(FL3)的电压及补偿。以SSC 为纵坐标,分别以FSC、CD45、CD14为横坐标获取数据,在三种图上分别选定单核细胞群设门,用CELLQuest 软件获取2000 个单核细胞进行分析,分析Mon1、Mon2、Mon3的比例。
1.3 统计学处理 研究采用SigmaPlot 12.0软件进行统计分析,文中正态分布数据以x+s表示。两组间比较样本放置时间对检测结果影响时采用配对t 检验进行分析,以P<0.05为有统计学差异。
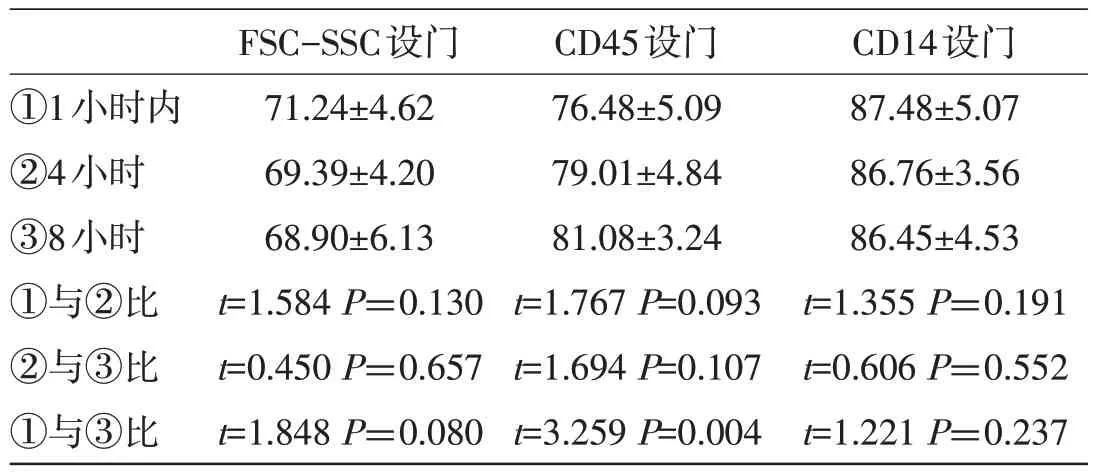
表1 标本放置不同时间对单核细胞Mon1亚群检测结果比较(%)
2 结果
2.1 标本放置时间对不同设门检测单核细胞亚群的影响 20 例样本采集后1 小时内、室温放置4小时、8小时检测,不同设门方法对检测Mon1、Mon2、Mon3结果的比较(见表1、2、3)。结果显示:样本放置8 小时与1 小时内相比较,FSC-SSC的设门方法、CD14设门方法检测的Mon2群细胞显著上升(P<0.05),Mon3群细胞显著下降(P<0.05);而CD45设门方法,随着时间的延长,Mon1群细胞显著上升(P<0.05),Mon3 细胞显著下降(P<0.05)。而8 小时与4 小时内比较,FSC-SSC 设门时Mon2显著升高(P<0.05),而CD45 设 门、CD14 设门检测Mon3 细胞显著下降(P<0.05),其余不同设门方法Mon1、Mon2、Mon3 比例均无统计学差异(P>0.05)。
2.2 不同时间点FSC-SSC 设门检测单核细胞亚群的分析(见图1、表4)标本室温条件下,随着放置时间的延长,单核细胞SSC 方向检测信号下降(见图2)。随着时间的延长,单核细胞出现分群,SSC检测信号较高的群(SSChi)和SSC检测信号较低的群(SSClow),其Mon1、Mon2、Mon3 表达见表1。结果显示,与样本放置4小时相比,样本放置8 小时,SSClowMon1、Mon2、Mon3 的比例有显著性差异(P<0.05),而SSChi中Mon1、Mon2、Mon3的比例无显著性差异(P>0.05)。

表2 标本放置不同时间对单核细胞Mon2亚群检测结果比较(%)

表3 标本放置不同时间对单核细胞Mon3亚群检测结果比较(%)
标本室温条件下放置4小时,SSClow与SSChi相比Mon1、Mon3 有 显 著 性 差 异(t=17.946,P<0.001;t=12.177,P<0.001)),Mon2 相比无显著性差异(t=0.232,P=0.821)。而室温放置8 小时,SSClow与SSChi相比Mon1、Mon2、Mon3 均有显著性差异(t=8.278,P<0.001;t=2.864,P=0.019;t=7.323,P<0.001)。
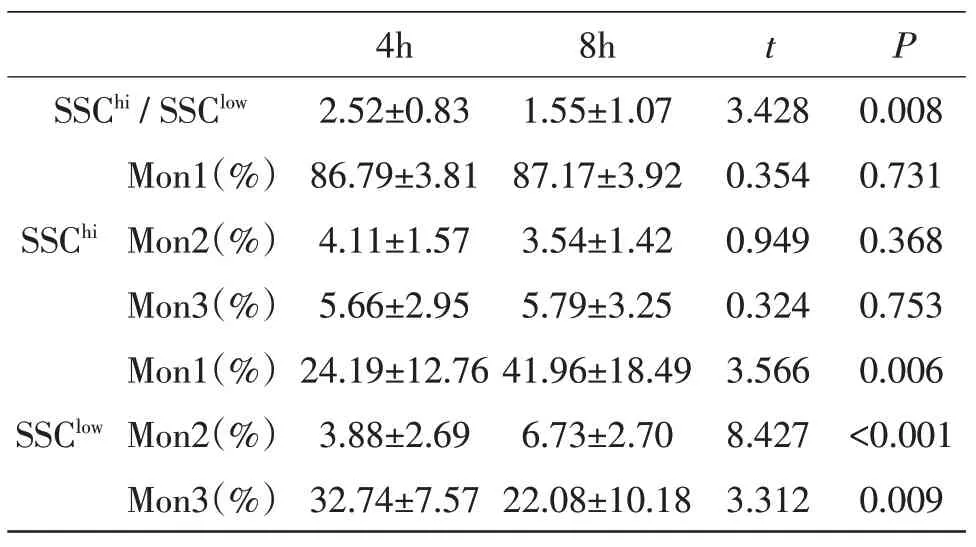
表4 不同时间点SSChi、SSClow单核细胞亚群分析
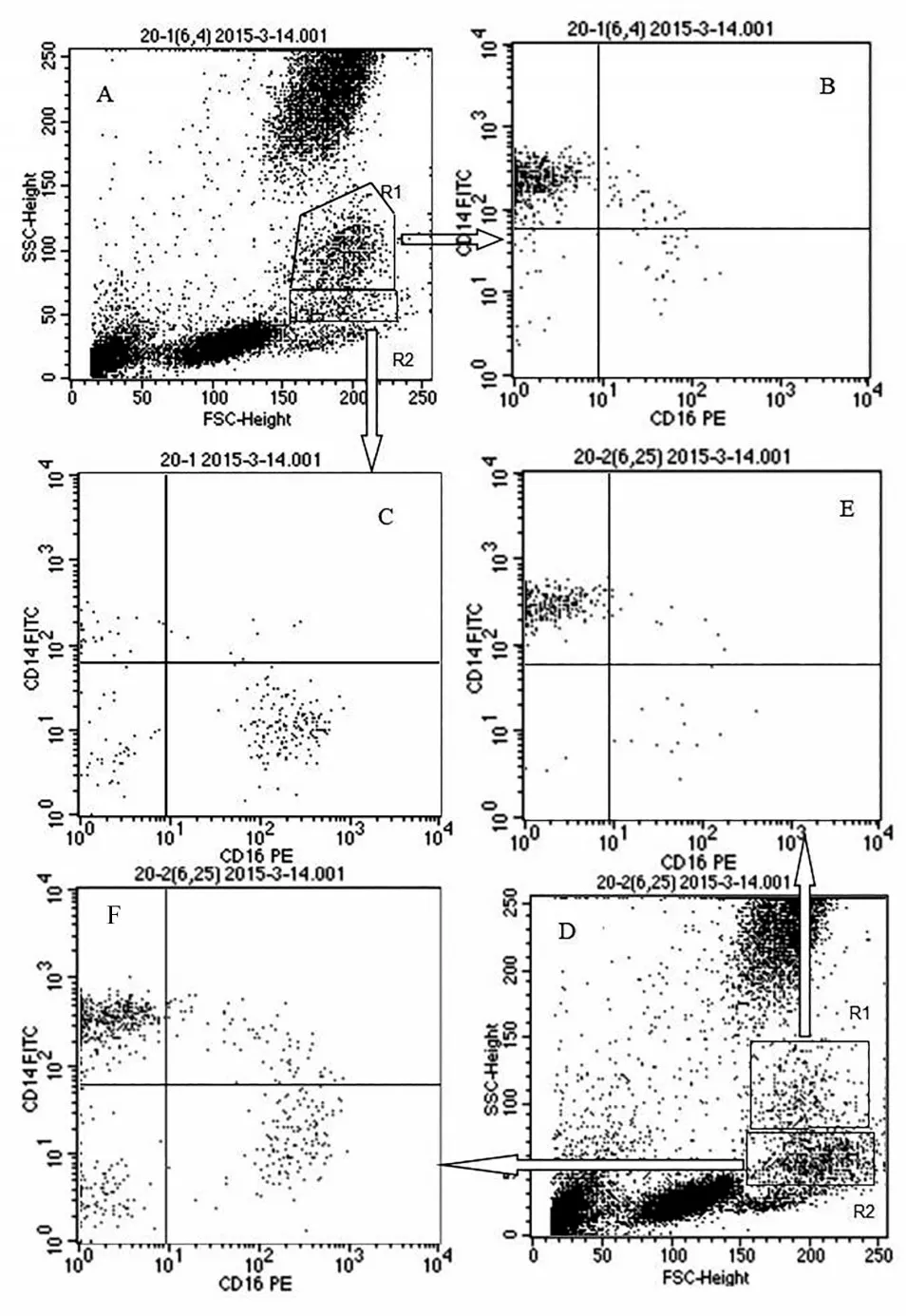
图1 标本放置不同时间单核细胞不同亚群的表达(R1:SSChi,R2:SSCdim)
2.3 标本放置不同时间CD45 设门检测单核细胞亚群的分析 采用CD45 设门检测单核细胞亚群时,随着标本放置时间的的延长,SSC 方向检测信号下降,放置8小时,单核细胞SSC方向信号与淋巴细胞分界不明显,见图2。

图2 不同时间CD45设门方法
3 讨论
研究显示,标本采集时间对检测结果有较大的影响[4-7]。如汪毅、马南花等研究标本放置时间对单核细胞分类计数影响[4,5]。宋建新等研究了标本放置温度及时间对外周血CD34+细胞及单个核细胞(MNC)计数结果的影响[6]。连文萍等报道血液检验结果与血标本放置时间的关系,结果显示,血清K+在1h 后即明显升高,血清Cl-于4h 后明显下降,而Na+稍有下降。单核细胞与血小板随着血液标本放置2h后明显提高,放置4h后白细胞计数明显减低[7]。
我们观察标本放置时间对不同的设门方法检测单核细胞亚群结果的影响,结果显示,样本放置8 小时,FSC-SSC 的设门方法、CD14 设门方法Mon2 群细胞显著上升,Mon3 群细胞显著下降。可能的原因是,单核细胞亚群在一定程度上代表了不同的分化发育阶段,随着Mon1 到Mon2 到Mon3细胞不断成熟,因此随着时间的延长,一部分Mon1 转化为Mon2,而一部分Mon2 转化为Mon3,一部分Mon3 死亡。但因Mon1 数量较高,Mon2 数量较低,因此随着时间的延长,Mon2 的比例上升,而Mon3 比例下降。CD45 设门的方法与标本放置的时间有关,随着时间的延长,Mon1群细胞显著上升,Mon3细胞显著下降。其原因除上述因素外,我们还观察到,随着时间的延长,细胞形态发生改变,室温放置4小时单核细胞SSC的信号下降、FSC 信号增加,出现明显分群现象(见图2)。并且随着放置时间从4 小时延长到8 小时,SSChi/SSClow显著下降。其中出现SSCloww群中部分细胞与淋巴细胞SSC方向信号重合,我们对SSChi和SSClow分析显示,SSChi中Mon3 细胞显著低于SSClow中Mon3细胞。因此采用CD45设门时导致部分单核细胞群转到淋巴细胞中,而Mon3绝大多数处于这部分主要细胞内(见图2),所以导致Mon3比例下降。因此标本采集后放置时间对单核细胞亚群的检测结果影响较大。
综上所述,为确保检测结果的准确性,室温保存条件下,对单核细胞亚群检测应在采集6 小时内送检。

