CT能谱成像在食管鳞癌病理分级诊断中的应用价值
王 奕,何 亮,丁少华,夏建国
(泰州市人民医院 医学影像科,江苏 泰州 225300)
食管癌具有较强侵袭性和高死亡率[1],据统计2018 年每20 例癌症死亡病例中就有1 例死于食管癌[2]。食管癌的主要组织病理学亚型是鳞状细胞癌[3,4],占我国食管癌的绝大多数[5],食管鳞状细胞癌患者5年生存率低于15%[6]。临床上,医学影像学检查在肿瘤病理分类和分期中起着辅助作用,传统的CT及MRI扫描在早期鉴别食管鳞癌的病理分类和肿瘤分期方面有局限性。能谱CT成像基于不同能量水平X射线的CT衰减系数,有助于病理亚型的术前诊断[7]。本研究对59 例不同病理分级食管鳞癌患者行能谱CT增强扫描,旨在定量比较不同病理分级病灶的CT能谱参数是否有差异。
1 资料与方法
1.1 临床资料 搜集2018 年6 月~2019 年3 月至泰州市人民医院就诊的食管占位患者80例,所有患者均行能谱CT 增强扫描,且在CT 检查后进行手术切除。纳入标准:(1)CT检查前未经过任何治疗;(2)无CT增强扫描检查相关禁忌症;(3)经手术切除且证实为食管鳞癌;(4)图像质量佳符合诊断要求。80例手术患者中,有10例术前经过放化疗、10 例病理证实为食管腺癌、1 例病理证实为小细胞神经内分泌癌全部予以剔除,共纳入59 例患者。患者年龄53~78 岁,平均(69±6)岁,其中男性49例,女性10例。
1.2 检查方法 CT 检查采用美国GE Revolution CT,能谱CT 成像扫描。动脉期扫描时间采用Smart Phase 阈值触发技术确定,监测层面置于降主动脉,动脉期扫描完成后延迟20s 行静脉期扫描。GSI扫描参数:管电压140 kV和80 kV在0.25 ms瞬时切换,采用Smart Dose 自动管电流追踪技术,图像噪声比NI值为7.0,层厚、层间距均为5 mm,转速0.5 s/r,螺距0.992:1。
1.3 图像的后处理及数据分析 将获得的动脉期原始数据传至GE AW4.7 后处理工作站进行后处理,采用GSI Viewer软件处理得出单能量40~140 keV下的CT 值图、碘基图、水基图及有效原子序数图,并结合病理结果,由两名影像科医师共同协商,选择食管鳞癌患者病变区域最大的三个层面,将ROI 放置在病变区域相对应的CT 值图、碘基图、水基图及有效原子序数图上。病变区域既要是阳性手术区域又是影像科医师在CT上看到的病变区域,对于不止一个病理证实的病变区域,要选取最具有侵袭性的病变区域。ROI 的大小范围为26~150mm2。所有患者的ROI 由同一个影像科医师来画以避免观察者之间的误差,画ROI 时要注意避开坏死、出血、囊变、血管及空气等区域以减少CT值计算的误差,肿瘤区域的ROI均进行3次测量并取其平均值。绘制ROI能谱曲线,并计算能谱曲线斜率(λHU): λHU= (CT40 keV-CT70 keV) /|40 keV-70keV|。
1.4 病理分类标准 本研究参照术后病理结果,共分为三组:高分化组(n=6)、中分化组(n=23)及低分化组(n=30)。
1.5 统计学分析 采用SPSS 17.0 软件对上述数据进行统计学分析,定量资料用均数±标准差(s)表示。组间比较采用单因素方差分析、最小显著性差异法检验;不满足条件的采用Kruskal-Wallis H 检验,成对比较。以手术结果为金标准,采用受试者工作特征(receiver operating characteristic,ROC)曲线,计算各单独参数鉴别低分化与非低分化食管鳞癌的诊断效能。以P<0.05 为差异有统计学意义。
2 结果
2.1 能谱曲线 在同一坐标系中的不同单能量下,将不同分化程度的食管鳞癌所对应的CT值重新生成能谱衰减曲线,结果显示三组平均能谱衰减曲线均呈递减型,从上至下依次为低分化、中分化及高分化鳞癌,如图1所示。
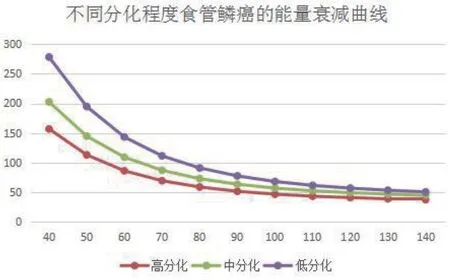
图1 低分化与中高分化食管鳞癌的能谱衰减曲线
2.2 食管鳞癌动脉期能谱CT 定量参数的比较随着病理分级的增加,动脉期病灶的IC、λHU及Eff-Z均逐步增高;不同病理分级患者之间病灶的IC、λHU及Eff-Z 差异均有统计学意义(P<0.05),而WC 不随病理分级的增加而增高,且不同病理分级患者之间病灶的WC 值差异无统计学意义(P>0.05),见表1。

表1 不同分级食管鳞癌能谱CT定量参数的比较
2.3 食管鳞癌在动脉期能谱CT 定量参数的诊断效能 对有统计学意义的参数IC、Eff-Z 及λHU行ROC 曲线分析,IC 诊断低分化与中高分化食管鳞癌的AUC为0.809,95%置信区间(0.686,0.900),Eff-Z 诊断低分化与中高分化食管鳞癌的AUC 为0.813,95%置信区间(0.690,0.902),λHU 值诊断低分化与中高分化食管鳞癌的AUC 为0.810,95%置信区间(0.687,0.900),见图2~4。
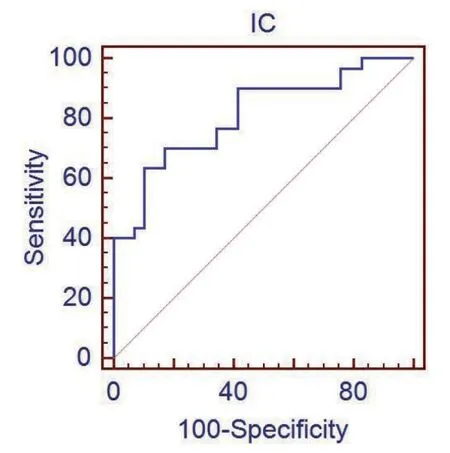
图2 动脉期IC鉴别低分化与中高分化食管鳞癌的ROC曲线
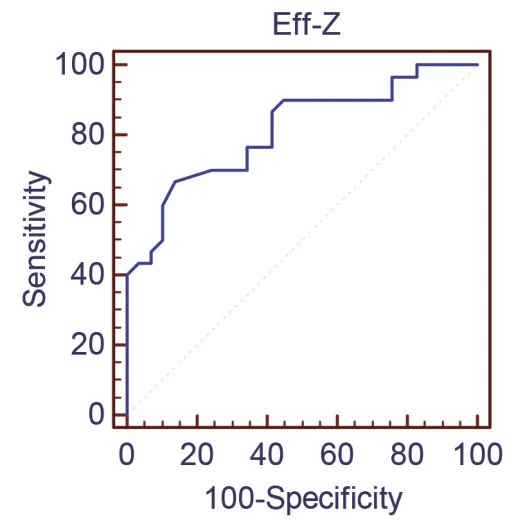
图3 动脉期Eff-Z鉴别低分化与中高分化食管鳞癌的ROC曲线
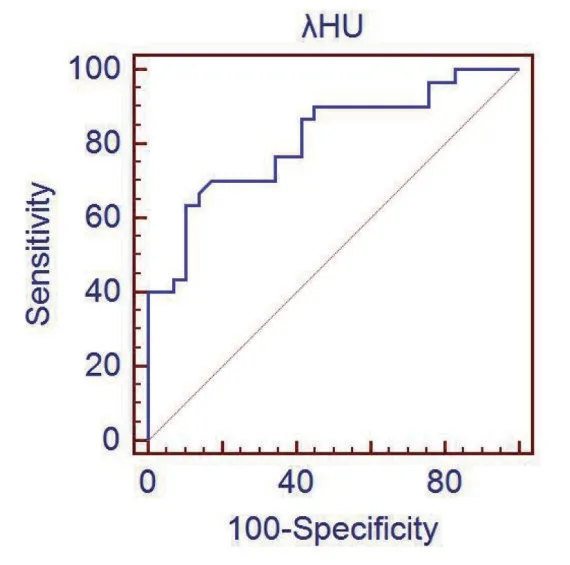
图4 动脉期λHU鉴别低分化与中高分化食管鳞癌的ROC曲线
3 讨论
与传统CT 相比,能谱CT 成像的碘基图、水基图、CT值图、有效原子序数图及能谱曲线为临床应用提供了更准确和完整的信息[8]。
一些研究者认为,CT的病理鉴别主要取决于病变的组成和局部灌注[9,10]。肿瘤的血管化是一种建立营养联系,加速肿瘤发展的生物学行为。病理类型、肿瘤起源、微血管结构和灌注特性影响增强模式和碘基参数。我们的研究结果显示低分化鳞癌组的碘浓度高于其余两组,且差异有统计学意义。这是因为碘浓度反映了病灶的血管化状态,病灶越富血供,碘浓度越高,故本结果显示低分化鳞癌较中高分化鳞癌的血供丰富,这与贾鑫鑫[11]及刘月华[12]的研究结果一致。
能谱曲线和有效原子序数取决于X 射线反射的衰减系数[13-15]。通过识别病灶中的原子序数或能谱曲线,可以鉴别物质和成分。能谱曲线斜率之间的差异表示灌注差(碘基差)和成分差(原子序数差)。我们的研究发现低分化鳞癌组的λHU高于其余两组,且差异有统计学意义,考虑是因为低分化组的碘浓度高于其余两组,低KeV 条件及碘对比剂增强不同组质量吸收系数的差别[16]。因此低能量水平可以通过提高图像对比度来区分食管病变的不同病理类型。由于组分的不同,我们的研究结果表明食管低分化鳞癌组Eff-Z值高于其余两组且差异有统计学意义。
我们的研究与贾鑫鑫等[11]及刘月华等[12]相比,剔除了穿刺活检证实为食管鳞癌的病例,所有病例均经手术切除证实,所以结果相对更准确。多个研究结果显示动脉期能谱参数较静脉期具有更高的敏感性与特异性,且鉴别诊断效能更高[12,17,18],所以此次研究我们选择了动脉期进行能谱参数的比较。
此次研究尚存在以下局限性:第一,高分化组的病例过少,将来还需要扩大样本量进一步研究。第二,由于搜集病例过程中,笔者发现食管腺癌病例较少,未对食管腺癌进行研究。第三,本研究只着重于研究食管病变,未对周围淋巴结累及情况进行研究。第四,未对一些不能手术的食管癌晚期患者放化疗前后的能谱参数变化进行研究。在未来的研究中,尚需要进一步扩大样本量,持续收集食管腺癌病例,对食管周围淋巴结累及情况以及放化疗前后能谱参数是否有变化进行进一步研究,从而更好地评估能谱参数结果。

