水系钠离子电池普鲁士蓝正极材料的制备与电化学性能研究
李 勇,何玮鑫,郑芯月,于胜兰,李海同,黎弘毅,张 蓉,王 雨
(1.南昌大学 材料科学与工程学院,南昌330031;2.东华理工大学 化学生物与材料科学学院,南昌330013)
随着传统化石能源的日趋枯竭以及随之带来的环境问题,大力开发新能源被认为是实现人类社会可持续发展的首要课题。然而新能源存在稳定性差等缺点,因此通过发展储能技术解决新能源的稳定性问题越来越受到重视[1]。在众多二次能源体系中,钠离子电池由于钠的储量丰富、价格低廉而备受关注[2-4]。其中水系钠离子电池由于设备简单以及安全性能高,更是受到众多研究者青睐[5]。当前已开发出多种钠离子电池的正极材料,如钴酸钠[6-8]、锰酸钠[9-10]和普鲁士蓝[11]等。其中普鲁士蓝MxNy[Fe(CN)6](Prussian Blue,PB)是一种简单的金属有机骨架配合物,分子式中M为钠、钾等碱金属元素,N则是过渡金属元素铁。由于PB具有完整的立方晶型结构,且存在大量配位空隙[11-15],有利于碱金属离子在晶格中的嵌入与脱出;同时得益于其稳定的有机骨架,在碱金属离子的嵌入与脱嵌过程中不会产生过大的形变,所以 PB在钠离子电池领域引起了广泛关注。然而,在制备PB过程中所形成的晶体结构如空位缺陷、间隙水以及微观形貌等,均会影响其电化学性能。因此,研究PB的合成规律和电化学性能的影响因素具有重要意义。
PB的合成方法有电化学沉积法、水热法、模板合成法、共沉淀法和单一源法等[16]。其中单一源法只需单一前驱体,实验操作简单,实验过程容易控制,且生成的PB颗粒尺寸均匀性较好。因此采用单一源法制备 PB,主要探究反应温度、反应时间、盐酸浓度对PB的微观形貌结构和电化学性能的影响。
1 实验方法
1.1 实验原料
十水合亚铁氰化钠(Na4Fe(CN)6⋅10H2O,AR,上海阿拉丁生化科技股份有限公司),氯化钠(NaCl,AR,上海阿拉丁生化科技股份有限公司),抗坏血酸(C6H8O6,VC,AR,上海阿拉丁生化科技股份有限公司),无水硫酸钠(Na2SO4,AR,上海阿拉丁生化科技股份有限公司),科琴黑(KB,EC600JD,Ketjenblack International),浓盐酸(HCl,37wt%,GR,西陇科学股份有限公司),聚偏氟乙烯((C2H2F2)x,PVDF,电池级,广州市南屋电子商务责任有限公司),N-甲基吡咯烷酮(C5H9NO,NMP,AR,天津市大茂化学试剂厂),钛箔(电池级,仁信金属材料有限公司)。
1.2 制备普鲁士蓝
采用单一源法制备PB并原位复合KB。将去离子水加热到 80 ℃,并快速用该热水溶剂制备100 mL 20 mmol/L的 Na4Fe(CN)6溶液,再加入48 mg KB,超声 15 min,使 KB均匀分散在Na4Fe(CN)6溶液中,超声后在溶液中加入 14.5 g NaCl和 0.088 g 还原剂 VC,将上述溶液放入水浴锅中,待温度上升到反应温度加入一定量的 HCl,持续搅拌,反应结束后得到沉淀物,用去离子水离心洗涤3~5次,转速10000 r/min,时间3 min,直至离心后的上层清液pH=7,80 ℃真空烘干24 h后得到目标产物。控制反应时间为4 h、盐酸浓度为0.10 mol/L不变,通过改变反应温度(50、60、65、70或80 ℃)探究温度的影响,样品分别标记为 PB-50℃、PB-60℃、PB-65℃、PB-70℃和 PB-80℃;控制反应温度为65 ℃、盐酸浓度为0.10 mol/L不变,研究反应时间(4、6、8或10 h)的影响,样品分别标记为PB-4h、PB-6h、PB-8h 和 PB-10h;控制反应温度为 65 ℃、反应时间为4 h不变,研究盐酸浓度(0.05、0.10、0.15或0.20 mol/L)的影响,样品分别标记为PB-0.05M、PB-0.10M、PB-0.15M和PB-0.20M。
1.3 电池制备
将1.2制得的样品作为活性物质。先称取10 mg粘结剂PVDF,加入适量的溶剂NMP配成3wt%的胶体,再加入90 mg充分研磨过的活性物质并搅拌均匀制得浆料。此后把制得的浆料均匀涂敷在钛箔上,然后放入60 ℃烘箱烘2 h,再在90 ℃的真空干燥箱中真空干燥10 h,取出后称重待用。采用1 mol/L的 Na2SO4溶液作为电解液,普鲁士蓝电极材料(普鲁士蓝载量:2 mg∙cm-2)作为工作电极和对电极,以饱和甘汞电极作为参比电极构成完整的水系电池测试体系。以 PB-50℃、PB-60℃、PB-65℃、PB-70℃或 PB-80℃作为电极材料所得电池分别标记为BPB-50℃、BPB-60℃、BPB-65℃、BPB-70℃和BPB-80℃;类似地,采用 BPB-4h、BPB-6h、BPB-8h、BPB-10h、BPB-0.05M、BPB-0.10M、BPB-0.15M和BPB-0.20M 分别指代以 PB-4h、PB-6h、PB-8h、PB-10h、PB-0.05M、PB-0.10M、PB-0.15M 或PB-0.20M作为电极材料所得电池。
1.4 表征与测试
采用X射线衍射仪(XRD,D8 ADVANCE,德国布鲁克公司)进行结构表征,2θ=10°~90°。采用扫描电子显微镜(SEM,JSM 6701F,日本电子株式会社)进行形貌表征。采用透射电子显微镜(TEM,JEM-2100,JEOL)表征纳米级别材料的形貌结构。采用蓝电电池测试系统(CT2001A,武汉市蓝电电子股份有限公司)进行电化学性能测试。
2 结果与讨论
2.1 单一源法合成普鲁士蓝的机理
前驱体Na4Fe(CN)6在酸性氛围下,部分Fe(CN)64-中的 Fe2+会分离出来,并可能被氧化成 Fe3+。Fe3+和Fe2+都可与未分解的Fe(CN)64-结合,生成PB沉淀(图1)。因此温度、时间和盐酸浓度等因素均会影响PB的微观形貌和晶体结构,进而改变PB的电化学性能。
2.2 反应温度的影响
图2为不同反应温度下所合成PB的XRD图谱。从 XRD图谱可以看出,不同温度条件下合成的样品衍射峰相同,说明合成的样品具有相同的面心立方晶体结构[11]。同时,PB-50℃的XRD衍射峰宽化相对严重,说明该样品晶粒小、结晶性差;而其余样品的衍射峰比较尖锐,说明样品结晶性更好。总体而言,衍射峰随着反应温度的上升而更为尖锐,说明反应温度越高,PB的结晶性越好。
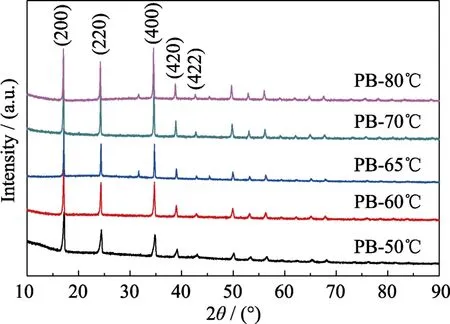
图2 不同反应温度下所合成PB的XRD图谱Fig.2 XRD patterns of PB synthesized at different reaction temperatures

图3 不同反应温度下所合成PB的(a)~(e)SEM和(f)TEM照片Fig.3(a-e)SEM and(f)TEM images of PB synthesized at different reaction temperatures
图3为不同反应温度下所合成PB的SEM和TEM照片。PB-50℃晶粒结晶性差(图3(a));PB-60℃棱角清晰分明,颗粒分布在KB表面(图3(b));PB-65℃分散性较好(图3(c)),与此同时,从 PB-65℃的透射电镜照片(图3(f))可以看出PB-65℃晶粒的立方形貌清晰,棱角分明;PB-70℃出现多层堆积现象,颗粒较小的PB大多出现在较低一层PB的边角处(图3(d));PB-80℃堆积现象更加明显(图3(e))。从产率曲线(图4)可以看出PB产率随反应温度升高而升高,其中PB-80℃产率为96.5%。KB可以为PB晶粒的成核提供形核位点[16],温度较低(50 ℃)时,PB在KB上的成核速率较低,导致形成的PB晶粒较少。当温度上升至 60 ℃及以上时,有利于PB晶粒成核生长,因此形成的 PB晶粒都具有完整的立方体形貌[17-18]。当温度较高时,先形成的 PB晶粒也能提供形核位点[19],这种形核位点更易出现在 PB晶粒的边角处,直观表现为PB晶粒向上倾斜堆积,且随着温度升高,PB能提供更多的形核位点,因此PB堆积现象加剧,产率也随之升高。
从XRD图谱和形貌照片可以看出,PB-50℃结晶性最差,PB-65℃结晶性和分散性都较好,PB-80℃结晶性最好但团聚现象严重,因此本研究选用 BPB-50℃,BPB-65℃,BPB-80℃进行电化学性能分析(图5~图7)。从充放电曲线(图5)可以看出,BPB-50℃,BPB-65℃,BPB-80℃表现出不同的初始放电能力,其放电比容量分别为63.9,99.9和52.7 mAh/g,其中BPB-50℃、BPB-65℃出现两个电压平台,分别为高电压平台(0.6~1.0 V)和低电压平台(0.0~0.2 V),因此比容量较高;而 BPB-80℃没有出现高电压平台,比容量较低。对不同样品进行循环性能测试(图6),发现BPB-80℃具有优异的循环稳定性,在100圈循环后容量保持率达93.9%,而BPB-65℃的容量保持率仅 39.3%。结合充放电曲线分析可知,BPB-65℃充放电时出现两个平台,会有更多的 Na+嵌入脱出,导致其晶体结构不稳定,这也是 BPB-65℃循环稳定性较差的原因。通过倍率性能测试(图7)可以发现,不同的电池在进行高倍率充放电后,进行小电流充放电依然能得到较高的比容量,这说明在大电流密度充放电过程中 PB材料结构稳定性优异,其中BPB-65℃具有更佳的倍率性能,在 1.0 A/g的充放电电流密度下,其比容量依然达到 48.1 mAh/g,当电流密度从1.0 A/g回到0.1 A/g时,比容量保持率达到93.1%。
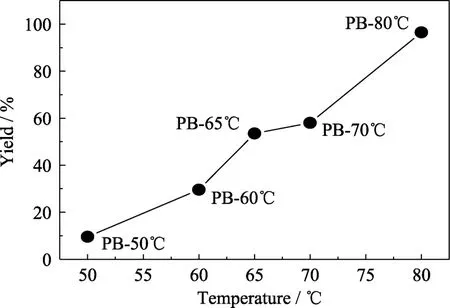
图4 不同反应温度下所合成PB的产率曲线Fig.4 Yield curve of PB synthesized at different reaction temperatures
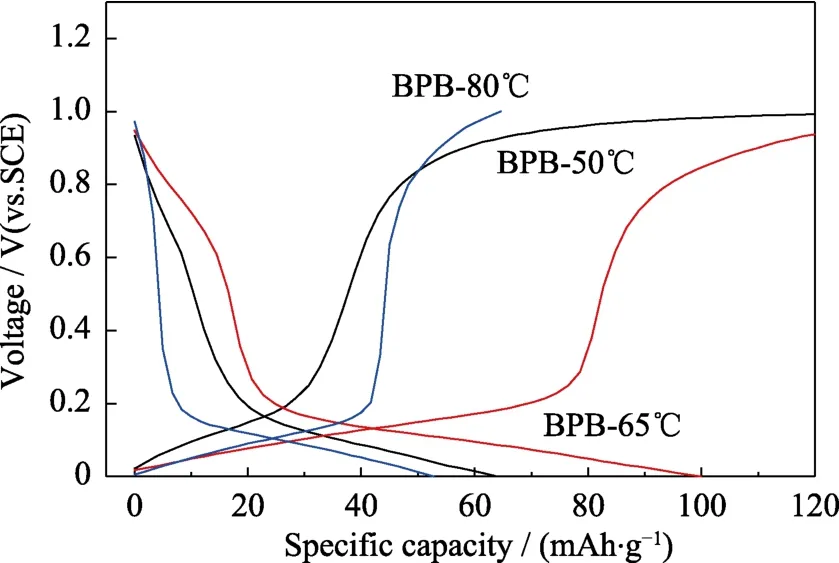
图5 以不同反应温度下所得PB作为电极材料的电池的充放电曲线Fig.5 Charge/discharge curves of batteries based on PB synthesized at different reaction temperatures

图6 以不同反应温度下所得PB作为电极材料的电池的循环性能Fig.6 Cycle performances of batteries based on PB synthesized at different reaction temperatures
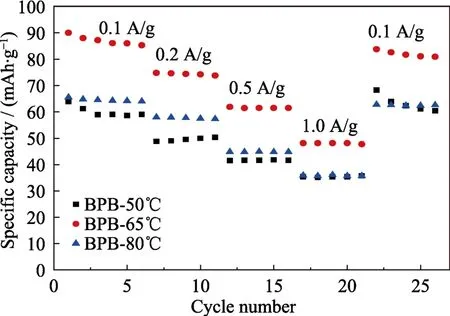
图7 以不同反应温度下所得PB作为电极材料的电池的倍率性能Fig.7 Rate performances of batteries based on PB synthesized at different reaction temperatures
2.3 反应时间的影响
图8为不同反应下时间所合成PB的XRD图谱。可以看出,样品都具有相同的PB特征峰。PB-4h衍射峰相对宽化,表明该样品的晶粒较小。随着反应时间延长,衍射峰越来越尖锐,说明通过延长反应时间可以提高PB的结晶性。
图9为不同反应时间下所合成PB的SEM照片。如图9所示,PB-4h晶粒粒径为500 nm左右,堆积现象不明显;当时间达到6 h或更长,形成的PB晶粒粒径范围为 1~2 µm,且都出现了堆积的现象;PB-4h和PB-6h的SEM照片表明,PB晶粒的粒径随着反应时间的延长而增大。但是进一步延长反应时间,PB晶粒粒径不再增大,粒径曲线图可看出粒径在6 h后基本不变(图10(a)),这是由于随着PB晶粒体积的增大,晶粒的比表面积下降,晶界能也随之降低,导致 PB晶粒更趋向于稳定,因此晶粒不再进一步长大[20]。从图10(b)可以看出,PB-6h、PB-8h、PB-10h的产率相近,这是由于相同温度下,KB和PB能提供的形核位点有限,延长反应时间不能促进形核。
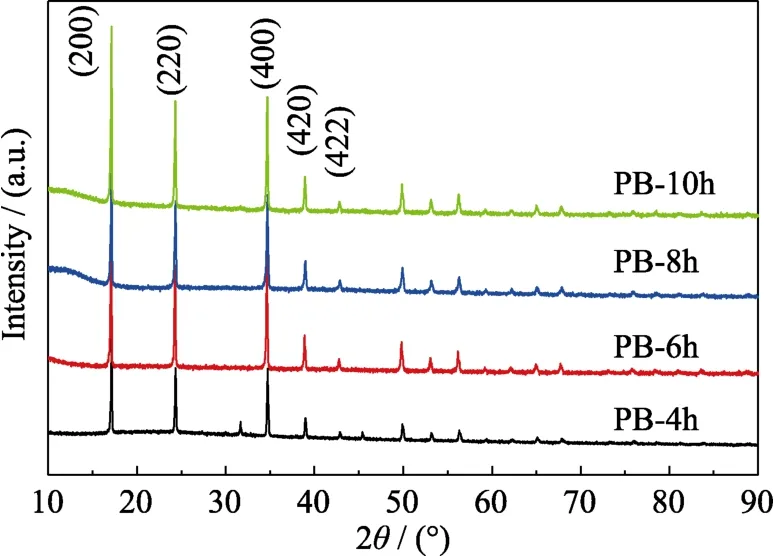
图8 不同反应时间下所合成PB的XRD图谱Fig.8 XRD patterns of PB synthesized with different reaction time

图9 不同反应时间下所合成PB的SEM照片Fig.9 SEM images of PB synthesized with different reaction time
由于 PB-4h粒径最小,而 PB-10h结晶性最好,所以选用BPB-4h和BPB-10h进行电化学性能分析(图11~图13)。BPB-4h和BPB-10h的初始放电比容量分别为99.9和61.2 mAh/g(图11),BPB-4h出现高电压平台,表现出更高的比容量。而BPB-10h充放电过程中只出现低电压平台,所以在 Na+嵌入与脱出过程中不容易引起结构性的破坏,因此循环性能更优异,其在 100圈循环后容量保持率达到90%,相比之下,BPB-4h容量保持率仅有 39.3%(图12)。通过倍率性能测试(图13)发现BPB-10h在大电流密度充放电后回到 0.1 A/g后依然具有56.3 mAh/g 的放电比容量,保持率为 95.1%,高于BPB-4h的93.1%。
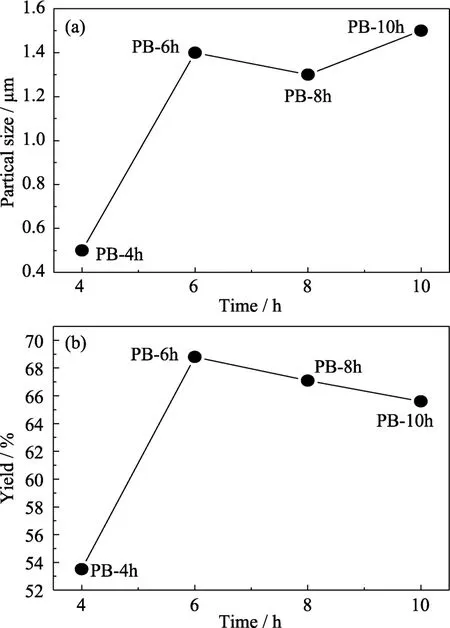
图10 不同反应时间下所合成 PB的(a)粒径曲线和(b)产率曲线Fig.10(a)Particle size and(b)yield curves of PB synthesized with different reaction time
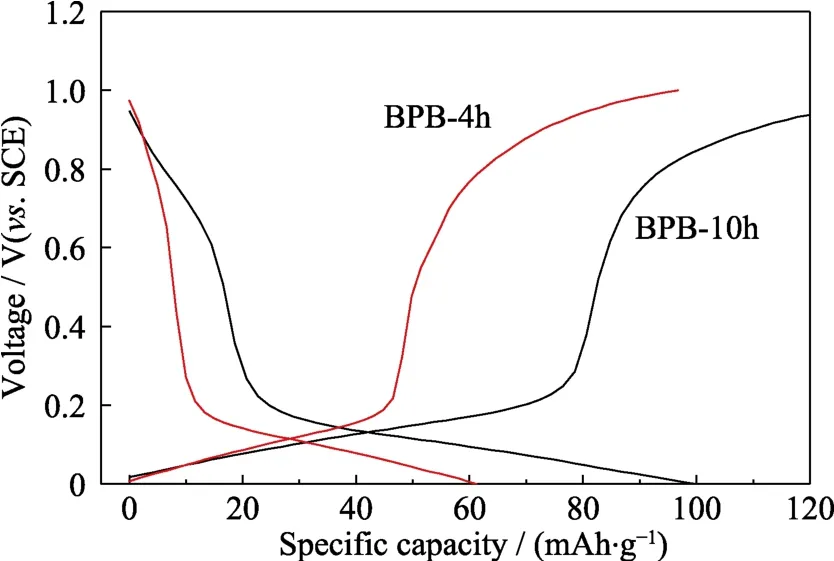
图11 以不同反应时间下所得PB作为电极材料的电池的充放电曲线Fig.11 Charge/discharge curves of batteries based on PB synthesized with different reaction time
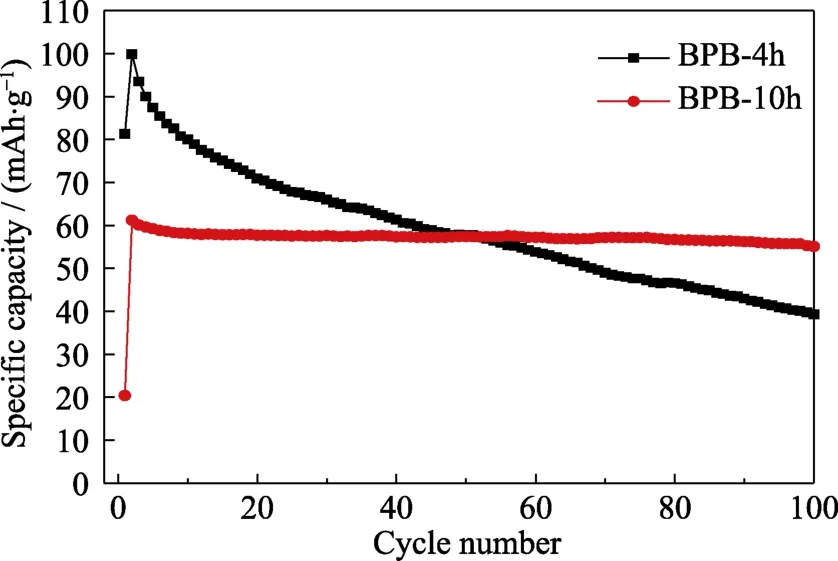
图12 以不同反应时间下所得PB作为电极材料的电池的循环性能Fig.12 Cycle performances of batteries based on PB synthesized with different reaction time
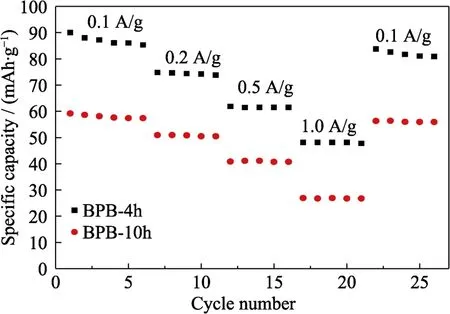
图13 以不同反应时间下所得PB作为电极材料的电池的倍率性能Fig.13 Rate performances of batteries based on PB synthesized with different reaction times
2.4 盐酸浓度的影响
图14为在不同盐酸浓度下所合成PB的XRD图谱。可以看出,样品都具有相同的衍射峰,说明都形成了PB。不同反应条件会引起样品晶格常数的变化,从(200)晶面的衍射峰放大图可以看出,随着盐酸浓度提高,衍射峰渐渐右移,说明晶格常数变小。
图15为不同盐酸浓度下所合成PB的SEM照片。PB-0.05M和PB-0.10M都具有完整的立方形貌,晶粒粒径在1 µm以下(图15(a)~(b)),同时通过产率曲线可以看出PB-0.10M的产率高于PB-0.05M(图16)。而 PB-0.15M 和 PB-0.20M 的晶粒形貌不规则(图15(c)~(d))。这是由于在酸性氛围下,Fe(CN)64-会分离出 Fe2+,因此适当提高盐酸浓度有利于 Fe2+的分离,从而提高 PB的产率。但是盐酸浓度过高,会腐蚀溶液中形成的PB,导致PB失去原有的立方体形貌。
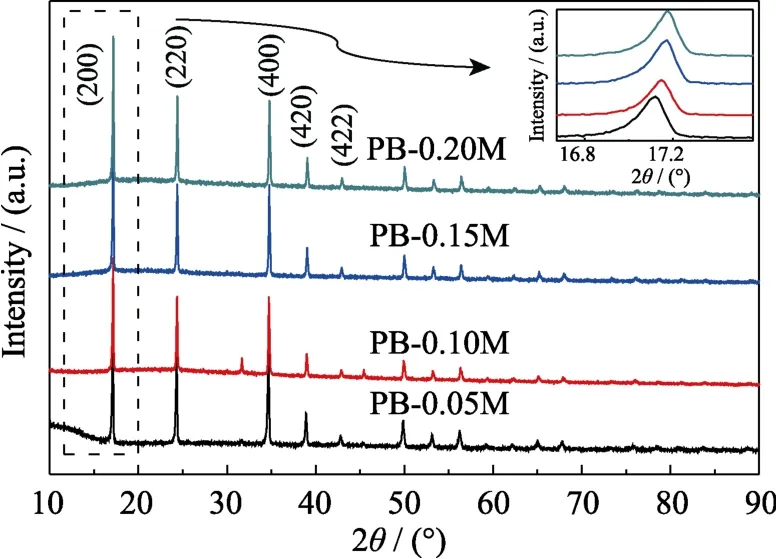
图14 不同盐酸浓度下所合成PB 的XRD图谱Fig.14 XRD patterns of PB synthesized at different concentrations of hydrochloric acid

图15 不同盐酸浓度下所合成PB的SEM照片Fig.15 SEM images of PB synthesized at different concentrations of hydrochloric acid
从SEM照片可以看出,PB-0.10M颗粒大少分布较为均匀,而PB-0.20M腐蚀最严重,因此本研究选用BPB-0.10M和BPB-0.20M进行电化学性能分析(图17~图19)。从充放电曲线(图17)可以看出BPB-0.10M和BPB-0.20M初始放电比容量相近,分别为99.9 和99.0 mAh/g,两者的电化学行为类似。通过循环性能测试(图18)可以看出,BPB-0.10M在100圈循环后,放电比容量只有39.3 mAh/g,而BPB- 0.20M仍然保持 67.5 mAh/g的放电比容量,容量保持率为68.2%。因此,相比于BPB-0.10M,BPB- 0.20M的循环稳定性得到了明显的改善,这是由于腐蚀后 PB的Na+扩散路径更短,使得 Na+的嵌入脱出过程更加顺畅,因而改善了循环稳定性,这与文献[21]一致。倍率性能测试(图19)发现BPB-0.20M具有更加优异的高倍率性能,其在1.0 A/g的大电流密度充放电下依然具有51.1 mAh/g的比容量,这可能是由于PB-0.20M 因腐蚀而晶粒的尺寸缩小,钠离子的嵌入脱嵌路程缩短。
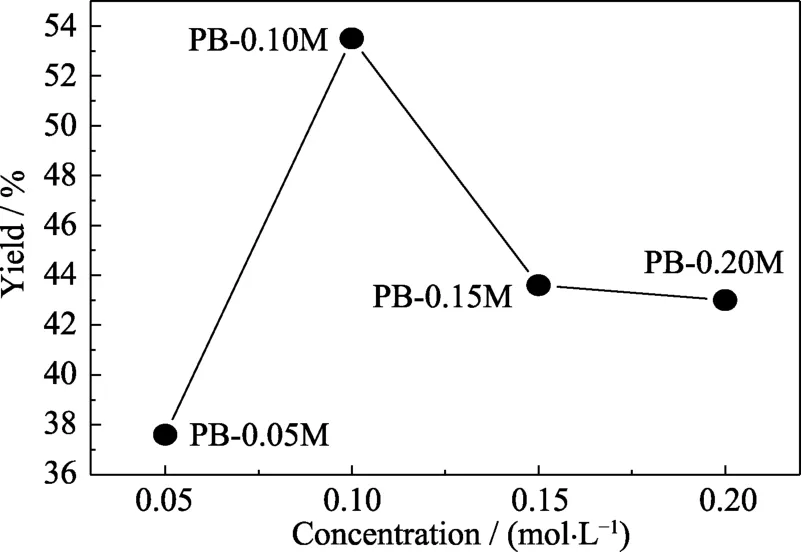
图16 不同盐酸浓度下所合成PB的产率曲线Fig.16 Yield curve of PB synthesized at different concentrations of hydrochloric acid
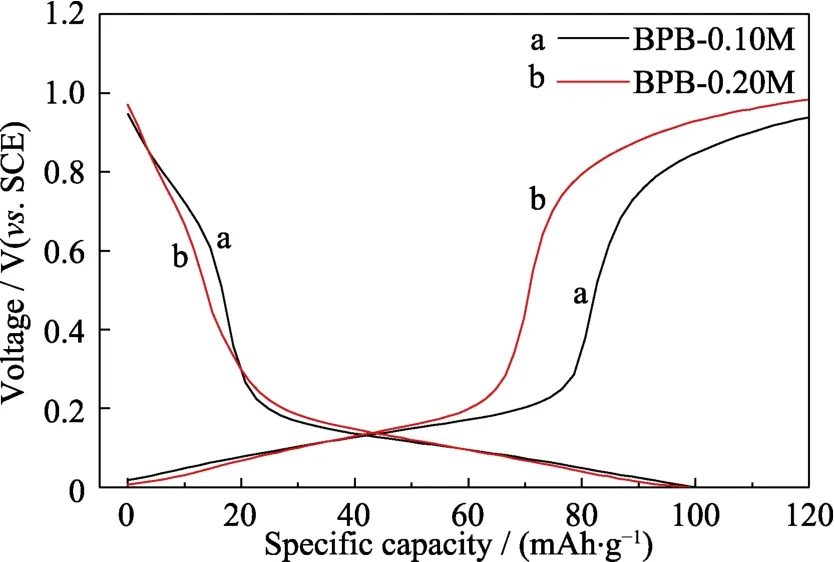
图17 以不同盐酸浓度下所得PB作为电极材料的电池的充放电曲线Fig.17 Charge/discharge curves of batteries based on PB synthesized at different concentrations of hydrochloric acid

图18 以不同盐酸浓度下所得PB作为电极材料的电池的循环性能Fig.18 Cycle performances of batteries based on PB synthesized at different concentrations of hydrochloric acid

图19 以不同盐酸浓度下所得PB作为电极材料的电池的倍率性能Fig.19 Rate performances of batteries based on PB synthesized at different concentrations of hydrochloric acid
3 结论
普鲁士蓝(PB)在水系钠离子电池储能领域有广泛的应用,研究 PB的合成规律以及电化学性能具有重要意义。本文采用单一源法制备PB复合材料,系统研究了反应温度、反应时间和盐酸浓度对 PB形貌结构和电化学性能的影响,研究发现:
1)反应温度对PB的结晶性、堆积情况和产率等都有影响,在 50~80 ℃的条件下,随着温度上升,形成的 PB晶粒结晶性越来越好,而堆积现象则越来越严重,产率也随之提高,其中80 ℃条件下所合成PB的产率达到96.5%。电化学性能测试表明,以80 ℃合成的 PB作正极材料组装的电池具有优异的循环性能,100圈充放电循环后容量保持率达到93.9%。而65 ℃合成的PB组装的电池具有较好的倍率性能,其在 1.0 A/g的充放电电流密度下的放电比容量为48.1 mAh/g。
2)反应时间对PB晶粒的粒径有影响,4 h合成的PB粒径在500 nm左右,粒径随着反应时间的延长增大到1~2 µm,但超过6 h以后由于表面能降低,晶粒不再进一步长大。10 h合成的PB所组装的电池展现出较好的循环性能,在 100圈充放电循环后容量保持率达到90%。
3)盐酸浓度会改变 PB的形貌和晶格常数,在盐酸浓度为0.05和0.10 mol/L的条件下,不影响PB形貌,只影响产率,其中浓度为 0.10 mol/L时产率更高。而浓度为0.15和0.20 mol/L则会改变PB的形貌,其中浓度为0.20 mol/L可以明显改善PB作正极材料所组装的电池的循环稳定性和倍率性能。

