Cr3+掺杂LiSn2(PO4)3负极材料的电化学性能研究
冯晓晶,王恭凯,2,3,王晓然,何 珺,王 新,彭会芬,2,3
(河北工业大学 1.材料科学与工程学院;2.能源装备材料技术研究院;3.天津市材料层状复合与界面控制技术重点实验室,天津 300130)
Sn基材料由于理论容量远高于石墨负极而成为锂离子电池一种极具潜力的负极材料[1-2]。然而,该材料在电化学反应过程中会产生巨大的体积变化,导致其在随后的充放电循环中容量迅速衰减,从而限制了它们在锂离子电池中的应用[3-5]。为此,人们巧妙地设计了Sn-M(M=Cu,Co,Sb,Ni,Fe等)合金以避免上述问题[6-11]。其中,M是过渡金属元素,充当“基体”,有助于提高电极的电子电导和活性物质的利用率,从而改善材料的循环稳定性[7,9,12]。虽然Sn-M 合金体系对锡基负极材料的电化学性能有一定程度的改善,但在充放电循环过程中,人们仍能观察到Sn粒子的聚集现象。因此,如何找到一种稳定的缓冲基体是这类材料商业应用的关键。
Cui等[13]报道了 Sn原子在 Li3PO4基体中高度分散的实例,该基体是 LiSn2(PO4)3的分解产物,电导率较高(8.62×10-8S/cm),能起到促进Li+与Sn之间电化学反应的作用。他们的研究结果表明:纯LiSn2(PO4)3电极在100 mA/g电流密度下50次充放电循环后的放电容量为320 mAh/g。为了进一步改善其电化学性能,Naren等[14]利用蔗糖对LiSn2(PO4)3进行包覆,获得的LiSn2(PO4)3/C复合材料在100 mA/g电流密度下的可逆容量达到448.6 mAh/g。且在100~500 mA/g范围内变倍率循环后再回到100 mA/g电流密度时,材料的容量仍达到408.6 mAh/g,说明碳包覆能显著改善LiSn2(PO4)3的电化学性能。尽管如此,这一容量仍无法满足工业应用的需求。
最近,关于 Nasicon型固体电解质和电极材料的研究表明[15-18]:Cr3+阳离子掺杂是改善材料电化学性能的有力措施。因此,Cr3+阳离子掺杂也有望对具有Nasicon结构的LiSn2(PO4)3负极材料发挥类似的积极作用。如果Cr3+阳离子掺杂仍无法避免该化合物在嵌锂/脱锂过程中发生分解,那么其分解产物应该包括Li3PO4、Sn和Cr。由于Li3PO4化合物占据的空间比金属Sn和Cr大得多,后两者应弥散分布于 Li3PO4中。据此,可推断在充放电过程中 Cr与 Li3PO4一方面能作为基体有效防止 Sn的团聚,另一方面 Cr作为电子导体可起到辅助导电剂的作用,促进Sn电化学反应的进行。故掺杂的Cr3+阳离子不会对LiSn2(PO4)3负极材料的电化学性能产生负面影响。为此,本研究尝试用Cr3+部分替代LiSn2(PO4)3中的Sn4+,以期进一步改善材料的电化学性能。
1 实验方法
1.1 样品的制备
以 CH3COOLi·2H2O(科密欧化学,99%)、SnCl4·5H2O(大茂化学,99%)、Cr(NO3)3·9H2O(大茂化学,99%)、NH4H2PO4(风船化工,98%)为原料,采用溶胶-凝胶法制备 Cr3+掺杂的 Li1+xCrxSn2-x(PO4)3(x=0~0.5)化合物。按照分子式的化学计量比称取原料,并溶解在去离子水中,搅拌形成浓度为 0.1 mol/L的均匀溶液;将柠檬酸(博迪化工,99.5%)和乙二醇(博迪化工,99%)分别作为络合剂和分散剂、以1 :1的摩尔比加入到上述均匀溶液中,搅拌均匀后添加适量的氨水(大茂化学,20%)调节pH为5左右,保持30 min;然后将溶液加热至70 ℃,蒸发掉多余水分形成凝胶。将凝胶静置24 h,在缓慢升温至150 ℃的过程中,去除溶胶中的易挥发物质得到干凝胶。最后,将干凝胶在空气中 650~950 ℃进行热处理得到目标产物。
1.2 结构表征及性能测试
以制备的产物为活性物质,科琴黑为导电剂,以7 :2的质量比分别称取两种物质,混合均匀后置于不锈钢球磨罐中,添加若干φ10 mm及φ5 mm的不锈钢球,然后将球磨罐在充有 Ar气的手套箱中进行密封,并于Fristch P-7型球磨机上以300 r/min的转速进行球磨。取适量球磨后的粉末与聚偏氟乙烯(PVDF)粘结剂(质量比为 90 :10),于研钵中充分研磨后,滴加适量的N-甲基吡咯烷酮(NMP)研磨形成粘稠浆料,涂覆于铜箔上,并于真空烘箱中进行120 ℃×12 h的干燥处理。
以金属锂片作为负极,Celgard 2400多孔聚丙乙烯膜作为隔膜,1 mol/L LiPF6的碳酸乙烯酯/碳酸二甲酯(EC/DMC,体积比1 :1)溶液作为电解液。电池的整个组装过程都在充有 Ar气的手套箱中进行,静置3 h后进行电池的各项性能测试。
采用德国布鲁克AXS公司的D8 FOCUS型X射线衍射仪进行物相和结构的分析,以 CuKα靶(λ=0.154 nm)为辐射源,管电压和管电流分别为40 kV和 40 mA,2θ=10~60°,扫描速度为 8(°)/min。并针对部分样品在 19.5~21.5°进行局部慢扫,扫描速度为1(°)/min。另外,对放电至不同阶段的极片也进行了XRD 测试,扫描角度为 10~60°,扫描速度为 2(°)/min。采用日本电子公司的JSM-7100F型扫描电镜附带的EDAX能谱仪对样品中的元素进行分析。采用ULVAC-PHI公司的PHI-5000 VersaProbe型X射线光电子能谱仪测试样品的元素及价态情况。以AlKα(hυ=1486.6 eV)为辐射源,步长为 0.2 eV,并以C1s的化学键合能(284.8 eV)为参照对其它元素的化学结合能进行标定。
采用武汉LAND 公司的CT2001A型测试系统进行电池的充放电测试,电压范围为5 mV~2.0 V。由于LiSn2(PO4)3在首次放电过程中发生的电化学反应不可逆,故本研究未加注明的都是第二次及以后的充放电数据。采用德国Zahner IM6e型电化学工作站测试交流阻抗谱,电压为10 mV,频率为0.1 Hz~1 MHz。
2 结果与讨论
图1(a)是成分为Li1.4Cr0.4Sn1.6(PO4)3的干凝胶在不同温度下热处理后所得产物的 XRD图谱和标准PDF卡片。观察发现,700 ℃热处理的主要产物为Nasicon 型α-LiSn2(PO4)3(JCPDS:49-1175,Cc),但还存在一定量SnO2和未知相的衍射峰。随着热处理温度的升高,对应α-LiSn2(PO4)3的衍射峰增强,SnO2和未知相的衍射峰强度减弱,说明产物中α-LiSn2(PO4)3相数量增加,SnO2和未知相的含量减少。当热处理温度超过 900 ℃时,产物的衍射峰基本和α-LiSn2(PO4)3标准物质完全对应,但伴随有微量的SnO2。由于上述产物中没有发现有关含Cr及其化合物的XRD峰,表明加入的Cr3+阳离子应该完全固溶于LiSn2(PO4)3中,起到部分取代Sn4+的作用。图1(b)是对应图1(a)中各个样品装配的电池于100 mA/g电流密度下的第二次充放电曲线,尽管差别不大,但相对而言热处理温度为900 ℃样品装配的电池具有最高的放电容量523.5 mAh/g,比Cui等[13]报道的纯LiSn2(PO4)3高出39.0%,这与该温度下所得产物纯度较高有关,故将 Cr3+掺杂样品的热处理温度定为900 ℃。
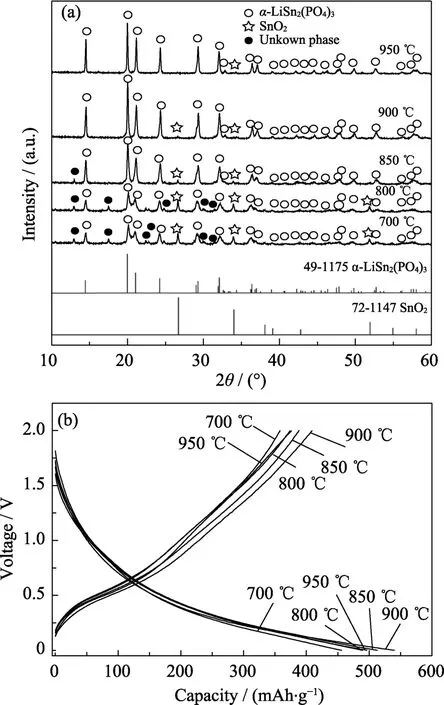
图1 Cr3+掺杂浓度为0.4的样品于不同温度热处理的XRD图谱(a)及100 mA/g电流密度下的第二次充放电曲线(b)Fig.1 XRD patterns(a)and the second charge-discharge curves at 100 mA/g(b)of the products heat-treated at various temperatures with Cr3+ content of 0.4
图2(a)是不同浓度Cr3+对LiSn2(PO4)3进行掺杂后制备的干凝胶经不同温度热处理后的XRD图谱。未掺杂的样品(x=0)650 ℃热处理后的XRD图谱以为主,但在2θ=19.9°和 20.9°的衍射峰与α-LiSn2(PO4)3(JCPDS:49-1175,Cc)相对应,在 2θ=19.3°、22.3°等位置的衍射峰则与 SnP2O7相对应,说明此时的产物是由β-LiSn2(PO4)3、α-LiSn2(PO4)3和 SnP2O7多相组成的。900 ℃热处理的 XRD图谱中对应SnP2O7的相衍射峰消失。值得注意的是,在2θ=16.5°和32.0°存在的两个微弱衍射峰则很难找到其对应的产物,故将其定义为未知相。添加Cr使样品的XRD图谱发生了很大变化,β-LiSn2(PO4)3相对应的XRD峰完全消失,取而代之的是尖锐的对应α-LiSn2(PO4)3相的 XRD峰,说明 Cr掺杂使低温α相变得更加稳定。当Cr掺杂浓度为 0.1~0.3时,样品的 XRD 图谱完全由α-LiSn2(PO4)3相组成。进一步提高Cr3+掺杂浓度,会出现微量的SnO2相、甚至未知相的XRD峰。上述研究结果表明:Cr3+离子的引入会影响 LiSn2(PO4)3中各原子间的相互作用,这是导致产物中出现第二相的主要原因。对图2(a)中样品的主峰(方框区域)进行慢速扫描,结果如图2(b)所示。引入Cr3+阳离子后,样品的 XRD峰略向右移。这是由于 Cr3+的离子半径(0.062 nm)小于Sn4+(0.065 nm)[15],依据布拉格方程可知,当用小尺寸的Cr3+离子取代LiSn2(PO4)3中的Sn4+时,会导致产物的晶格参数减小。
对不同浓度Cr3+掺杂的Li1+xCrxSn2-x(PO4)3(x=0,0.1,0.2,0.3,0.4,0.5)样品形貌和化学成分分析的结果表明:未掺杂样品650 ℃热处理后的颗粒尺寸较大,且形状不规则,团聚较为明显(图 S1(a))。Cr3+掺杂使得样品的颗粒尺寸明显变小,并且形状更加均匀。其中,Li1.3Cr0.3Sn1.7(PO4)3样品颗粒尺寸最为细小、均匀(图 S1(d));掺杂浓度继续增大,颗粒团聚程度又有所加剧。活性物质的颗粒尺寸变小有助于Li+的扩散,能促进电化学反应的进行。对应这些样品的 EDX结果中均存在较强的 Sn、O、P、Cr峰,说明所制备的样品确实是由 Sn、O、P、Cr元素组成的。此外,根据能谱分析结果计算的各样品中Cr/Sn的原子比十分接近它们的理论比值,表明加入的 Cr按照预期固溶于 LiSn2(PO4)3中,起到了取代 Sn的作用。图 S2中各样品 Li1+xCrxSn2-x(PO4)3的Cr 2p3/2峰位置随着Cr3+掺杂浓度的增加几乎未发生改变,并且该峰对应的结合能在577.83~578.37 eV之间,这与文献[17,19]中报道的 Cr3+的数值(577.8 eV)相近,说明加入的Cr在LiSn2(PO4)3中是以三价形式存在于八面体中,进一步验证了Cr3+的掺杂作用。
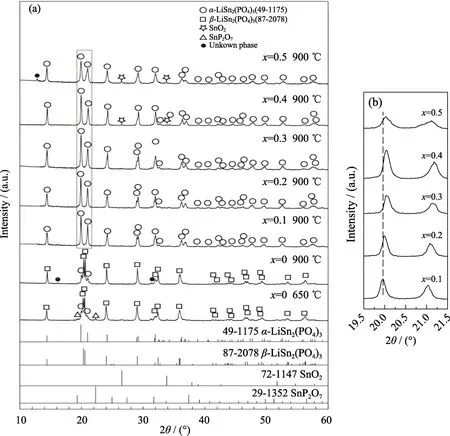
图2 成份为Li1+xCrxSn2-x(PO4)3(x=0~0.5)的干凝胶于不同温度热处理的XRD图谱Fig.2 XRD patterns of the xerogels with Li1+xCrxSn2-x(PO4)3(x=0-0.5)heat-treated at different temperatures(b)Enlarged patterns of(a)

图3 对应图2中(x=0,650 ℃以及x=0.1~0.5,900 ℃)各样品装配成的电池在100 mA/g电流密度下的第二次充放电曲线(a),不同电流密度下的放电容量(b)及Li1Sn2(PO4)3(c),Li1.3Cr0.3Sn1.7(PO4)3(d)的充放电曲线Fig.3 Second charge-discharge curves at 100 mA/g(a)and the discharge capacities at different current densities(b)of the batteries assembled with the samples containing different Cr3+ contents,and the charge-discharge curves at different rates for the samples of Li1Sn2(PO4)3(c)and Li1.3Cr0.3Sn1.7(PO4)3(d)
图3(a)为图2中各样品装配的电池在100 mA/g电流密度下的第二次充放电曲线。放电电压截止到 5 mV 时,未掺杂(x=0,650 ℃)的放电容量为362.2 mAh/g。随着Cr3+掺杂浓度的增大,样品放电容量逐渐增加,并在x=0.3时达到最大值574.6 mAh/g,这一数值比未掺杂的样品提高了 58.6%,比相同电流密度下 Cui等[13]报道的纯 LiSn2(PO4)3提高了52.6%,比 Naren等[14]报道的 LiSn2(PO4)3/C复合电极数据提高了28.2%。继续提高Cr3+的掺杂浓度,材料的放电容量开始下降。这可能与图2中SnO2和未知相的析出有关。尽管如此,x=0.5样品装配的电池放电容量为484.2 mAh/g,比未掺杂的高出33.7%。
图3(b)为Cr3+掺杂样品装配的电池在不同电流密度下放电容量的变化,文献报道的数据也列于其中。Cr3+掺杂使得相同电流密度下样品的放电容量明显提高,随着 Cr3+掺杂浓度的提高,材料的放电容量不断增加。当x=0.3时,电池于不同电流密度下的放电容量均处于最高水平。其中,800 mA/g电流密度下第二次放电容量达到 378.1 mAh/g,这一数值比未掺杂的样品提高了 78.9%,与 Cui等[13]的纯LiSn2(PO4)3电极在100 mA/g电流密度下的放电容量、Naren等[14]的LiSn2(PO4)3/C复合电极在400 mA/g电流密度下的放电容量相近。进一步提高Cr3+浓度,材料的放电容量有所下降。即使如此,x=0.5样品装配的电池在各个电流密度下的放电容量仍高于未掺杂的样品。以上结果充分表明:Cr3+阳离子掺杂能有效地改善LiSn2(PO4)3的电化学性能。
图3(c)和(d)分别为x=0和x=0.3样品装配的电池在不同电流密度下的第二次充放电曲线。对比未掺杂样品在不同电流密度下的第二次充放电曲线,虽然Cr3+掺杂并没有使充放电曲线的形状发生明显的变化,但是充电曲线在各个电流密度下的平台却明显降低、变宽,说明电池内部的极化程度减弱。尽管放电电流密度增加,材料的放电容量逐渐降低,但是在 800 mA/g电流密度下该样品的放电容量比未掺杂样品在100 mA/g电流密度下的数值还要高,充分说明 Cr3+掺杂有效改善了材料的电化学性能,减弱了电池内部的极化。

图4 Li1.3Cr0.3Sn1.7(PO4)3样品装配的电池在100 mA/g电流密度下不同循环的充放电曲线(a),不同电流密度下样品装配的电池放电容量的变化(b)及在100~800 mA/g范围内的变倍率性能(c)Fig.4 Cyclic charge-discharge curves at 100 mA/g of the batteries assembled with the sample Li1.3Cr0.3Sn1.7(PO4)3(a),variation in discharging capacity for the samples of x=0 and x=0.3(b)and rate performance between 100 mA/g and 800 mA/g for the batteries assembled with the Li1.3Cr0.3Sn1.7(PO4)3 sample(c)
图4为Li1.3Cr0.3Sn1.7(PO4)3半电池在100 mA/g电流密度下的充放电曲线及不同循环条件下的放电容量变化,其第一次的放电情况几乎与 Cui等[13]研究的纯LiSn2(PO4)3放电曲线完全相同,说明Cr3+的掺杂未能改变该化合物的充放电机制,难以阻止这种化合物的分解。经过25次循环,充放电曲线的形状基本不发生变化,只是放电容量有所降低,由574.6 mAh/g降为 403.1 mAh/g,容量保持率为70.2%,是未掺杂样品(32.7%)的2.1倍,比Cui等[13]报道的纯LiSn2(PO4)3循环25次后的容量(348 mAh/g)高出15.8%、与Naren等[14]报道的LiSn2(PO4)3/C复合电极循环25次后的容量(395 mAh/g)相近。将该材料对应的半电池放电电流密度提高至 800 mA/g,25次充放电循环后材料的放电容量由378.1 mAh/g降为 241.9 mAh/g,容量保持率达到 64.0%,仍比100 mA/g电流密度下未掺杂的样品提高了一倍。图4(c)是对Li1.3Cr0.3Sn1.7(PO4)3样品在100~800 mA/g范围内进行变倍率循环测试的结果,将该样品在每个电流密度下循环5次。当再次回到100 mA/g时,放电容量(447.8 mAh/g)仍能达到第二次容量的 78.2%,这一数值比Naren等[14]报道的LiSn2(PO4)3/C电极的变倍率循环结果(408.6 mAh/g)提高了9.6%,说明所制备的材料具有较好的循环稳定性,再一次证明了Cr3+阳离子掺杂对改善LiSn2(PO4)3负极材料电化学性能具有很明显的效果。
图5(a)为Li1+xCrxSn2-x(PO4)3/Li半电池的交流阻抗谱。各样品的 Nyquist图皆由高频区的半圆与低频范围的直线组成,其中,阻抗谱半圆与实轴的交点反映的是材料的电荷转移电阻Rct。根据该图计算的各样品Rct值列于表1。随着Cr3+掺杂浓度的增加,Rct的数值不断减小,在x=0.3时达到最小,之后Cr3+掺杂浓度继续增大,Rct又有所增加。这些结果表明 Cr3+掺杂降低了电荷转移阻抗,提高了 LiSn2(PO4)3的电化学活性。同时,依据阻抗谱低频区直线部分实部与角频率的关系(图5(b)),利用式(1)便可计算各样品的锂离子扩散系数D[8,20-22],结果也见表1。

式中,R为气体常数,8.314 J/(mol·K);T为绝对温度;A为极片的面积,0.785 cm2;F为法拉第常数,96485 C/mol;C为Li+的摩尔浓度(mol/L);σ为Warburg系数。
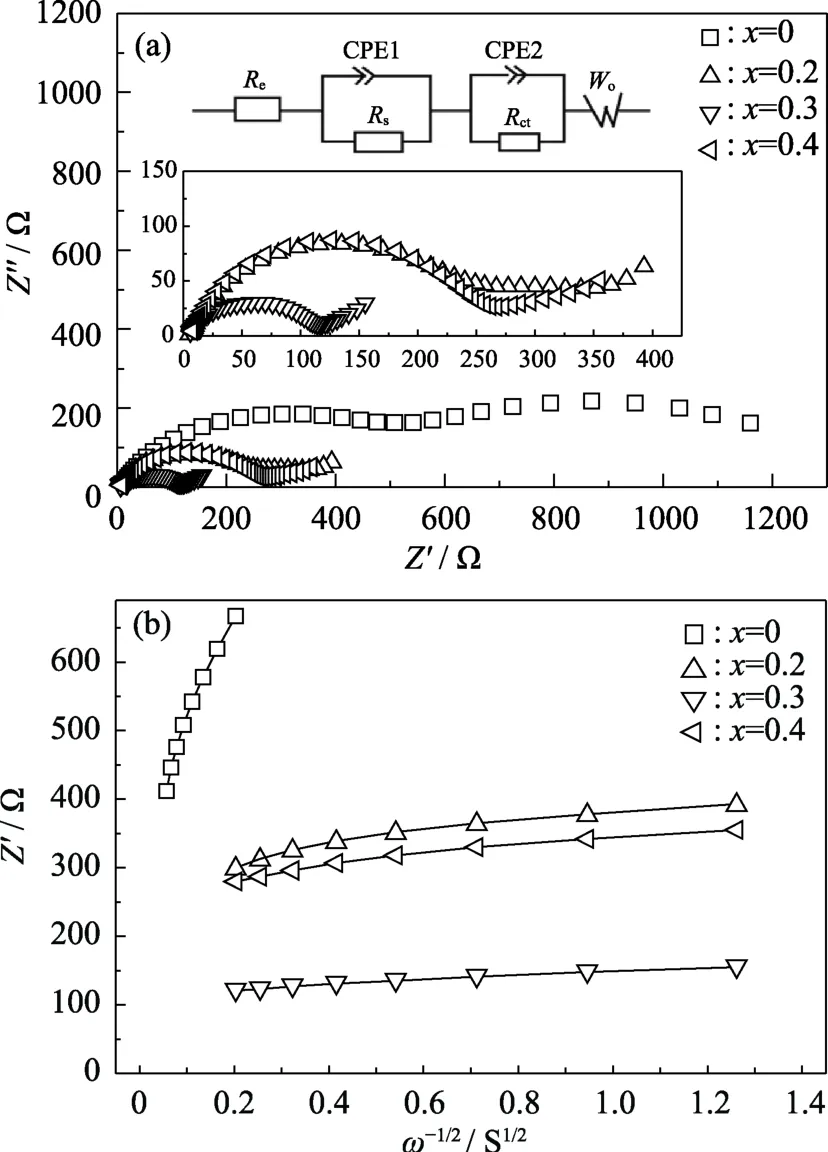
图5 不同浓度 Cr3+掺杂样品的交流阻抗谱(a)和实部 Z′与ω-1/2的关系(b),插图为(a)的局部放大及等效电路图Fig.5 AC impedance spectra(a)and relationship between Z′and ω-1/2of the samples with different Cr3+ contents(b)with inserts showing local magnification of AC impedance spectra and their equivalent circuit
这些数据表明,极片中的锂离子扩散系数随着Cr3+掺杂浓度的增大而增加,在x=0.3时达到最大值 5.46×10-11cm2/s,比未掺杂(x=0)的样品提高了 3个数量级,与前面得到的放电结果、电荷转移阻抗结果相一致。电荷转移或离子扩散与材料电化学反应的动力学过程密切相关,对于材料的实际应用至关重要,再次证明了 Cr3+掺杂可作为提高 LiSn2(PO4)3电化学性能的一种有效措施。
为了检验 Cr3+掺杂后制备的极片在充放电过程中的变化情况,将x=0.3样品对应的极片以100 mA/g电流密度放电至不同电压后进行 XRD测试,结果如图S3所示。同Nasicon型Li3Fe2(PO4)3、Li3V2(PO4)3正极材料与 LiTi2(PO4)3负极材料不同,当极片首次放电至1.1 V时,与未放电极片的XRD图谱完全不同,归属于α-LiSn2(PO4)3的衍射峰基本消失,在2θ=16.9°、22.3°和 23.2°等位置出现了 Li3PO4的衍射峰,在 2θ=32.9°与 44.9°出现的衍射峰则与金属 Sn对应,这与文献[13-14]报道的情况吻合。仔细观察,还可发现在 2θ=44.2°位置(图 S3(b))观察到归属 Cr的衍射峰。这些结果表明加入Cr3+阳离子并不能有效抑制LiSn2(PO4)3在首次放电过程中Nasicon结构的瓦解。结合图4中首次放电曲线在1.3 V左右出现的电压平台,可推理 Cr3+掺杂后 Li1.3Cr0.3Sn1.7(PO4)3在该阶段发生的电化学反应如式(2)所示:

进一步放电至 5 mV 时,可以看到在 2θ=20~25°之间存在一个宽漫散射峰。经过比对,这一漫散射峰与非晶 LixSn合金对应,与 Naren等[14]的报道吻合,说明这一过程发生的反应如式(3)所示:
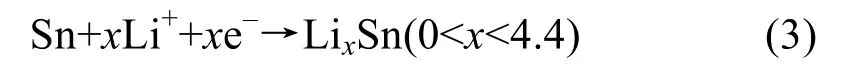
迄今为止,尚未发现有关金属Cr作锂离子电池负极材料的报道,因而,在该阶段发生的反应仅为放电产物Sn参与的电化学反应。当第10次放电至5 mV时,该漫散射峰仍然存在,表明所制备的Cr3+掺杂样品具有较好的循环性和可逆性。然而,图S3放电结束时仍能发现归属于 Sn的衍射峰,这意味着 Cr3+掺杂样品发生的嵌锂反应并不彻底,需要进一步改善它的循环性能。
由式(2)可知,虽然 Cr掺杂使得产物中参与有效电化学反应的Sn浓度降低,理论上讲,材料的放电容量应降低。但是,一个不可忽视的因素是,尽管LiSn2(PO4)3的理论容量较高,可实际放电时材料的容量损失却很大,说明活性物质的利用率较低。并且,目前报道的有关LiSn2(PO4)3负极材料放电时的电流密度也都较低(≯400 mA/g),这意味着在大电流条件下进行电化学反应时,所需的 Li+和 e-不能得到及时补充。正如 Sn-M 合金[6-11]缓冲体系那样,金属Cr的引入一方面提高了上述嵌锂反应的Li+和e-浓度,另一方面,与从外界单纯靠机械混合引入的碳导电剂不同,式(2)中的Cr和Sn同为反应产物。一是两者尺度都较小,活性较高;二是两者接触的紧密程度远高于外来的碳导电剂;三是Cr为易变价元素,它容易失去电子变成离子,而失去的电子则能有效参与上述电化学反应,补充局部导电剂不足引起的电子缺失。此外,一个不可忽视的问题就是电极材料在首次放电过程中形成的分解产物Li3PO4,由于数量多、密度低(2.537 g/cm3),故在整个分解产物中所占体积很大。因此,它作为基体在随后的充放电反应过程中能有效将活性物质 Sn隔离开,从而抑制其团聚长大。几方面共同作用的结果不仅使材料的充放电反应更加容易进行,而且活性物质的利用率得以显著提高,这应是 Cr3+掺杂使得材料放电容量增加的主要原因。但当 Cr3+掺杂浓度太高(>0.3)时,由于参与电化学反应的有效活性物质减少,所以材料的放电容量有所降低。
3 结论
本文利用溶胶-凝胶法制备的干凝胶经900 ℃×6 h热处理得到了不同 Cr3+掺杂浓度的 Li1+xCrxSn2-x(PO4)3(x=0.1~0.5)化合物,当Cr3+掺杂浓度为0.1~0.3时,可以获得均一的α-LiSn2(PO4)3相;掺杂浓度进一步增加,则会有少量第二相(如:SnO2相)析出。电化学性能测试表明:随着Cr3+掺杂浓度的增大,材料的放电容量呈抛物线规律变化,其中,Cr3+掺杂浓度为0.3的样品表现出最佳的电化学性能。100 mA/g电流密度下 25次充放电循环后的放电容量为 403.1 mAh/g,800 mA/g电流密度下的第二次放电容量为378.1 mAh/g,表现出较好的循环性能和倍率性能。Cr3+掺杂后LiSn2(PO4)3电化学性能的改善应归因于Li3PO4和Cr复合基体的空间效应,它改善了电化学反应的环境,有效避免了Sn粒子在充放电循环中的团聚,提高了Sn粒子的利用率。

图S1 Li1+xCrxSn2-x(PO4)3样品的SEM照片和EDX图谱Fig.S1 SEM images and EDX patterns of the Li1+xCrxSn2-x(PO4)3 samples
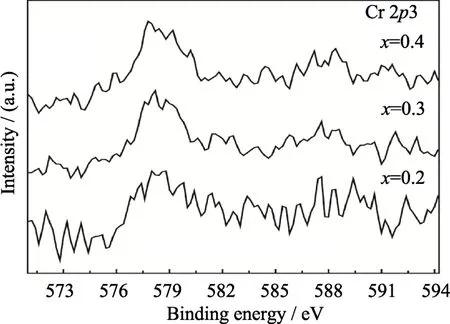
图S2 Li1+xCrxSn2-x(PO4)3(x=0,0.2,0.3,0.4)样品的XPS图谱Fig.S2 XPS spectra for the Li1+xCrxSn2-x(PO4)3 samples with x of 0.2,0.3 and 0.4

图S3 Li1.3Cr0.3Sn1.7(PO4)3充放电至不同电压产物的XRD图谱(a)及对图S3(a)方框区域的放大图谱(b)Fig.S3 XRD patterns of the Li1.3Cr0.3Sn1.7(PO4)3 electrode after charging and discharging at different voltages(a),and enlargement(b)of the box region in(a)

