299 例急性A 型主动脉夹层术后死亡危险因素分析
林曦 王晓武 马涛 袁彬彬 张本 杨博 林钊明 张卫达
海军军医大学附属广州临床医学院(解放军南部战区总医院)心血管外科(广州510010)
急性A 型主动脉夹层(acute type A aortic dissection,AAAD)一直以来都是心血管外科最凶险的疾病之一,及时行外科手术是首选治疗方案,尽管术前诊断技术及手术方法均有了长足进步,但术后早期病死率仍较高[1]。文献[2]报道影响主动脉夹层手术预后的因素有很多,包括:患者术前状态、并发脏器灌注不良、手术时机、手术具体方法、体外循环管理、器官保护等。本研究旨在通过选取解放军南部战区总医院心血管外科2006年8月至2018年9月期间连续手术治疗的299 例AAAD患者,回顾分析患者的临床资料,探讨AAAD 患者术后死亡的危险因素,为更合理地制定临床治疗策略,改善患者预后及生存率提供参考。
1 资料与方法
1.1 一般资料 回顾性分析解放军南部战区总医院心血管外科2006年8月至2018年9月期间连续手术治疗的299 例AAAD 患者(除外发病至就诊时间超过2 周的亚急性或慢性患者、单纯壁间血肿型患者、局限于升主动脉的DebakeyⅡ型夹层),通过询问病史,并结合心脏彩超和胸腹部CT/CTA确诊,术前完善心电图、胸片以及实验室检验。其中,男252 例,女47 例,平均年龄(49.17±12.15)岁,术后死亡61 例(20.4%),其中,2006-2011年死亡10/35 例(28.6%),2012-2016年 死 亡41/179 例(22.9%),2017-2018年死亡10/85例(11.8%)。将死亡患者纳入死亡组(61 例),存活患者纳入存活组(238 例),观察并记录两组患者的围术期资料。术后死亡定义为:(1)住院死亡,任何原因导致的术后住院期间死亡;(2)术后30 d 死亡,无论是否住院期间发生的、任何原因导致的术后30 d内死亡。
1.2 手术方法 首先于腹股沟游离股动脉,右锁骨下游离右腋动脉,正中开胸后游离主动脉弓部分支血管。(1)非全弓置换:采用右侧腋动脉及右心房插管行体外循环,部分患者加用股动脉插管灌注。降温至32 ℃左右,阻闭升主动脉,切开主动脉后直接经冠脉开口冷灌HTK 液,心表冰屑降温。清除夹层内血栓后,行升主动脉人工血管置换或Bentall 手术。如术中需探查主动脉弓部或行半弓置换,则持续降温至24~26 ℃后,阻闭三支头臂血管,停循环行选择性顺行脑灌注,2011年以后大部分患者采用右腋动脉+左颈总动脉双侧脑灌注法,头部戴冰帽降温行脑保护,完成主动脉远端吻合后恢复全身灌注并复温。(2)全弓置换手术:①孙氏手术[3],2015年以前均采用较多。前面步骤同半弓置换术,最低鼻咽温度降至18 ℃,打开主动脉弓后,向胸降主动脉真腔内释放覆膜支架,行人工血管与支架血管近端吻合,然后吻合主动脉根部,最后吻合左颈总动脉、左锁骨下动脉及无名动脉,吻合完毕后开放主动脉阻闭钳并复温。②“弓部优先”重建技术[4],首先于常温非体外循环下行四分叉人工血管与三根头臂血管吻合,然后体外循环-降温至24 ℃-打开主动脉弓部-释放胸降主动脉支架-吻合升主动脉远、近心端。③“弓部分支滞后”移植策略[5],2017年以来全弓置换均采用该策略。右腋动脉+左颈总动脉持续双侧脑灌注,阻闭升主动脉,清除升主动脉夹层血栓,修剪主动脉根部,鼻咽温度降至26 ℃后,停循环低流量脑灌注-打开主动脉弓-释放胸降主动脉支架-吻合升主动脉远、近心端切口后开放主动脉,待心脏顺利复跳后,再依次行四分叉人工血管分支与头臂血管吻合。
1.3 统计学方法 所有数据采用SPSS 24.0 软件包进行分析。计量资料以均数±标准差表示,组间比较采用独立样本t检验。计数资料以频数(率)表示,组间比较采用四格表χ2检验和Fisher 确切概率检验。将单因素分析有统计学差异的指标(P<0.05)纳入多因素Logistic回归分析,以向后逐步法确定患者术后死亡的独立危险因素。ROC 曲线评判所得独立危险因素以及联合预测概率的检验效能,计算曲线下面积(area under the curve,AUC)及95%可信区间。以P<0.05 为差异有统计学意义,采用双侧检验。
2 结果
2.1 两组患者术前情况比较 两组患者的BMI 指数、弓部分支血管受累、急诊手术比率差异无统计学意义(P>0.05)。与存活组比较,死亡组的性别、年龄、术前低氧血症比率、肌酐水平、动脉血乳酸值、术前伴有灌注不良情况方面,差异有统计学意义(P<0.05)。其中,术前合并心脏(冠脉)、肾脏、2 个及以上脏器灌注不良的比率死亡组要明显高于存活组,差异有统计学意义(P<0.05)。见表1。
2.2 两组患者术中及术后并发症数据的比较 两组患者行双侧脑灌注比率和二次开胸发生率差异无统计学意义(P>0.05)。与存活组比较,死亡组在全弓置换手术比率、体外循环时间、主动脉阻闭时间、低流量脑灌注时间、合并冠状动脉旁路移植术(CABG)手术比率、术后并发症情况方面差异有统计学意义(P<0.05)。其中,全弓置换手术方法中,两组行孙氏手术比率差异有统计学意义(P<0.01),而弓部优先及弓部分支滞后两种手术方法的差异无统计学意义(P>0.05)。术后并发症方面,两组间发生永久性神经功能障碍(PND)、脓毒症、低心排、行连续性肾脏替代治疗(CRRT)比率上差异有统计学意义(P<0.01)。见表2。
2.3 多因素Logistic 回归分析 将单因素分析有统计学意义的指标:性别、年龄、低氧血症、肌酐水平、动脉血乳酸值、术前伴灌注不良综合征、心脏(冠脉)灌注不良、肾脏灌注不良、全弓置换手术、孙氏手术、合并CABG 手术、体外循环时间、主动脉阻闭时间、低流量脑灌注时间、PND、脓毒症、CRRT、低心排(P<0.05)纳入多因素Logistic 回归分析。其中计量资料以均值做为分界值进行二分类赋值。最后得出:年龄≥50 岁(OR:13.259,95%CI:1.759~99.943,P= 0.027)、术前伴灌注不良综合征(OR:4.24,95%CI:1.262~14.251,P=0.005)、全弓置换手术方式(孙氏手术)(OR:44.638,95%CI:4.093~486.794,P= 0.003)、术后并发低心排(OR:21.887,95%CI:1.637~292.607,P= 0.000)是患者术后死亡的独立危险因素。见表3。
表1 两组患者术前资料的比较Tab.1 Comparison of preoperative characteristics of two groups ±s,例(%)
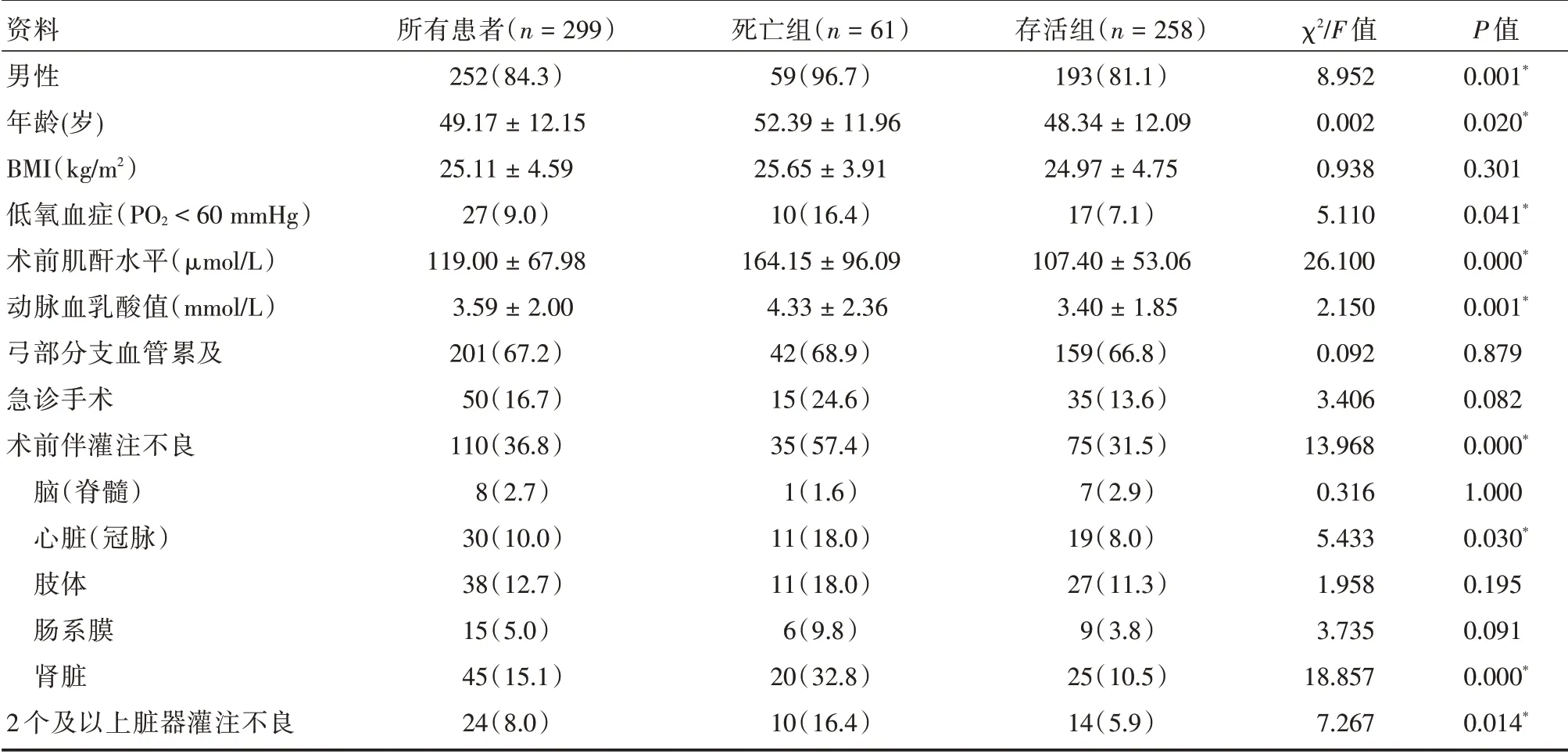
表1 两组患者术前资料的比较Tab.1 Comparison of preoperative characteristics of two groups ±s,例(%)
注:*P<0.05
资料男性年龄(岁)BMI(kg/m2)低氧血症(PO2<60 mmHg)术前肌酐水平(μmol/L)动脉血乳酸值(mmol/L)弓部分支血管累及急诊手术术前伴灌注不良脑(脊髓)心脏(冠脉)肢体肠系膜肾脏2 个及以上脏器灌注不良所有患者(n=299)252(84.3)49.17±12.15 25.11±4.59 27(9.0)119.00±67.98 3.59±2.00 201(67.2)50(16.7)110(36.8)8(2.7)30(10.0)38(12.7)15(5.0)45(15.1)24(8.0)死亡组(n=61)59(96.7)52.39±11.96 25.65±3.91 10(16.4)164.15±96.09 4.33±2.36 42(68.9)15(24.6)35(57.4)1(1.6)11(18.0)11(18.0)6(9.8)20(32.8)10(16.4)存活组(n=258)193(81.1)48.34±12.09 24.97±4.75 17(7.1)107.40±53.06 3.40±1.85 159(66.8)35(13.6)75(31.5)7(2.9)19(8.0)27(11.3)9(3.8)25(10.5)14(5.9)χ2/F 值8.952 0.002 0.938 5.110 26.100 2.150 0.092 3.406 13.968 0.316 5.433 1.958 3.735 18.857 7.267 P 值0.001*0.020*0.301 0.041*0.000*0.001*0.879 0.082 0.000*1.000 0.030*0.195 0.091 0.000*0.014*
表2 两组患者术中及术后并发症资料的比较Tab.2 Comparison of intraoperative characteristics and complications of two groups ±s,例(%)
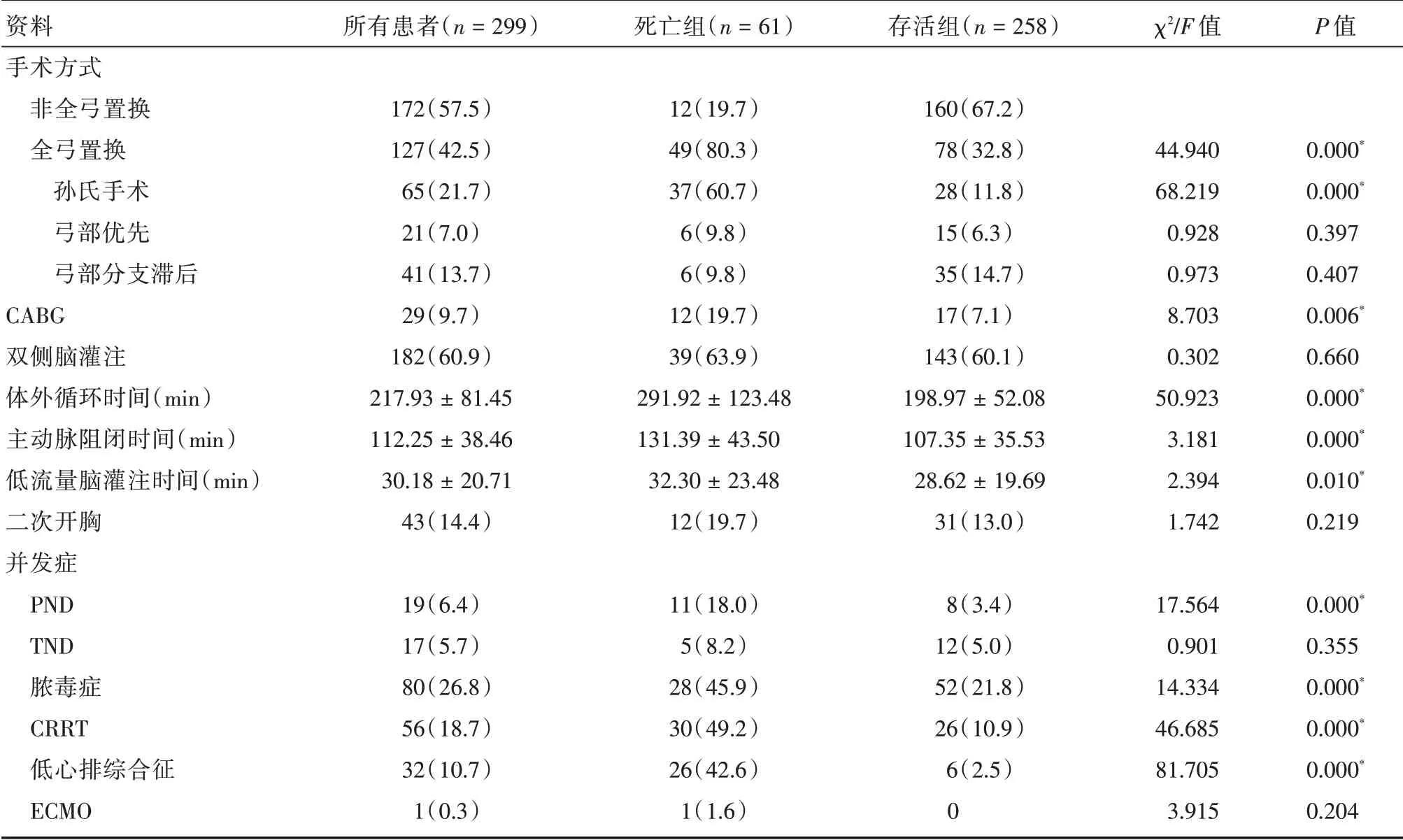
表2 两组患者术中及术后并发症资料的比较Tab.2 Comparison of intraoperative characteristics and complications of two groups ±s,例(%)
注:TND,暂时性神经功能障碍;ECMO,体外膜肺氧合;*P<0.05
资料手术方式非全弓置换全弓置换孙氏手术弓部优先弓部分支滞后CABG双侧脑灌注体外循环时间(min)主动脉阻闭时间(min)低流量脑灌注时间(min)二次开胸并发症PND TND脓毒症CRRT低心排综合征ECMO所有患者(n=299)172(57.5)127(42.5)65(21.7)21(7.0)41(13.7)29(9.7)182(60.9)217.93±81.45 112.25±38.46 30.18±20.71 43(14.4)19(6.4)17(5.7)80(26.8)56(18.7)32(10.7)1(0.3)死亡组(n=61)12(19.7)49(80.3)37(60.7)6(9.8)6(9.8)12(19.7)39(63.9)291.92±123.48 131.39±43.50 32.30±23.48 12(19.7)11(18.0)5(8.2)28(45.9)30(49.2)26(42.6)1(1.6)存活组(n=258)160(67.2)78(32.8)28(11.8)15(6.3)35(14.7)17(7.1)143(60.1)198.97±52.08 107.35±35.53 28.62±19.69 31(13.0)8(3.4)12(5.0)52(21.8)26(10.9)6(2.5)0 χ2/F 值44.940 68.219 0.928 0.973 8.703 0.302 50.923 3.181 2.394 1.742 17.564 0.901 14.334 46.685 81.705 3.915 P 值0.000*0.000*0.397 0.407 0.006*0.660 0.000*0.000*0.010*0.219 0.000*0.355 0.000*0.000*0.000*0.204
2.4 应用ROC 曲线评价危险因素预测效能 以各独立危险因素以及Logit(P)(联合预测概率)进行多变量ROC 曲线分析(图1)。联合预测概率的曲线下面积(AUC)为0.949,95%CI:0.914~0.985,差异有统计学意义(P<0.01,表4),预测敏感性为98.4%,特异性为51.5%。年龄≥50 岁的AUC 为0.607,95%CI为0.529~0.686,P= 0.010;术前伴灌注不良的AUC 为0.711,95%CI为0.638~0.786,P= 0.000;孙 氏 手 术 的AUC 为0.744,95%CI为0.666~0.822,P=0.000;术后并发低心排的AUC 为0.700,95%CI为0.615~0.786,P=0.000。

表3 多因素Logistic 回归分析结果Tab.3 Multiple Logistic regression analysis results

图1 危险因素预测ROC 曲线Fig.1 ROC curve of risk factors
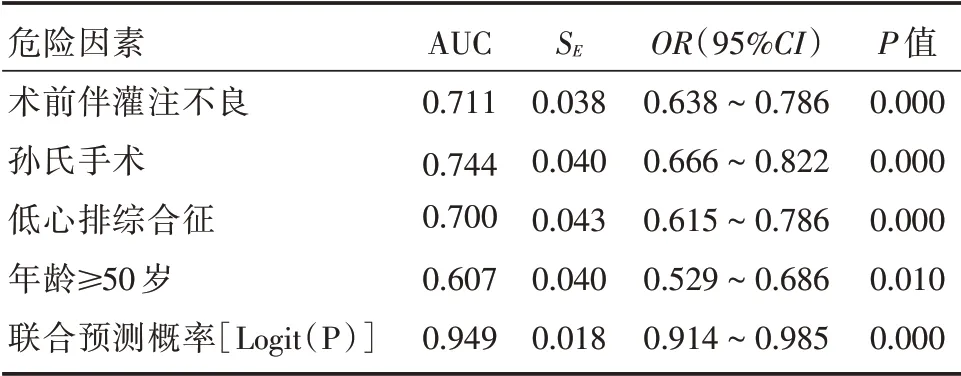
表4 独立危险因素和联合预测概率的曲线下面积比较Tab.4 Comparison of the area under ROC curve of indepentent risk factors and Logit(P)
3 讨论
AAAD 是心血管外科最具挑战性的急症,它不仅仅是主动脉壁的形态学异常,还包括影响心脏功能和重要脏器供血的血流动力学改变及夹层剥离导致的全身炎症反应[6]。尽管不断进步的诊断方法和有效的药物治疗为外科手术争取了时间,医生也在不断努力改进手术策略、提高手术技术,但AAAD早期术后病死率仍然较高,国外报道术后住院死亡率在7%~27%[1,7]。国内相关报道A型夹层住院死亡率在8%~22%左右,其中安贞医院孙立忠团队[3]报道的一组700 多例急性A 型夹层手术致死率为7.98%。孙立忠教授认为其报道夹层致死率较低的原因是:(1)国外A 型夹层多为急诊手术,术前合并灌注不良综合征比例高,导致手术死亡率高;而国内手术时间相对偏晚,很多发生灌注不良的患者已经死亡或者放弃手术治疗;(2)国内手术患者平均年龄约50 岁(比国外患者年轻约15岁),合并症较少,全身状况较好。本研究中,患者术后死亡率为20.4%,相对偏高。但随着本中心主动脉夹层手术量逐年增加,术前诊断、围术期管理技术提高、手术技巧改进,术后病死率逐年下降,尤其是2017-2018年段,术后病死率降至11.8%,接近国内外报道的最好疗效。因此,预测夹层术后死亡的危险因素,进行充分的术前准备、熟练操作,防止发生严重并发症是降低病死率、提高患者生存率的关键。
文献[2,7-9]报道影响AAAD 术后死亡的危险因素有:(1)术前因素:年龄、并发灌注不良综合征、低氧血症、肌酐水平、LVEF≤35%、术前心源性休克、既往有心脏手术史、手术时机等;(2)手术技术因素:全弓置换方法、体外循环时间、主动脉阻闭时间、停循环时间、温度等;(3)术后因素:永久性神经功能障碍、急性肾功能损伤、CRRT、脓毒症、低心排、用血量过大、心包填塞。与本研究得出的结论是相符的。
本研究中,死亡组患者平均年龄同存活组差异有统计学意义(52.4 岁vs.48.3 岁,P<0.05),Logistic 回归分析显示患者年龄≥50 岁是术后死亡独立危险因素。考虑原因有:(1)年龄本身就是心血管疾病的独立危险因素;(2)年龄越大,合并疾病越多,如糖尿病、高血压、冠心病、肾功能不全等。该结论与多数研究报道是一致的[9-10]。
灌注不良综合征是指夹层导致的有临床症状或体征的器官供血不足情况,可发生于任何受累的主动脉主要分支,导致心肌、大脑、脊髓、内脏和或肢体缺血。据报道,有16%~34%的夹层合并灌注不良,是影响预后最严重的并发症之一,患者围术期死亡率可达29%~89%[2,11-12]。对于灌注不良的患者,最佳的治疗方法仍有争议,目前主流认为应尽快手术恢复真腔供血,从而解决分支血管的阻塞及减压假腔[13]。但近年来,腔内技术和杂交手术更多地替代了传统开胸手术。医生对合并灌注不良尤其是多个脏器的夹层病例倾向于遵循“腔内优先”策略,推迟开胸手术[14]。本研究中,术前伴灌注不良是患者死亡的独立危险因素,显示了与其他研究的一致性,提示在今后临床实践中,须更加重视灌注不良的诊断与处理,探寻最理想的治疗策略。
关于是否行全弓置换,国内外很多医生考虑到手术风险和经济因素,选择将手术范围局限在升主动脉。但国内的A 型夹层患者普遍较年轻,选择全弓置换+降主动脉支架植入术可减少再次手术的概率。本研究中,两组患者的全弓置换手术比例差异有统计学意义(死亡组80.3%vs.存活组32.8%,P<0.01),显示行全弓置换的死亡风险更高,而多因素分析显示全弓置换孙氏手术为死亡独立危险因素。针对全弓置换的高难度、高风险,本中心通过持续改进手术技术策略,先后应用弓部优先策略、弓部分支滞后移植策略,以期缩短手术时间、减少手术创伤、提供更好的器官保护,患者术后死亡率有了显著地下降,远期疗效还有待于进一步随访研究。
AAAD 手术创伤大,体外循环、主动脉阻闭、停循环脑灌注时间长,造成心、脑等组织中酸性代谢产物、氧自由基等增多,而机体不能有效清除,随着血供的恢复,儿茶酚胺、氧自由基大量释放、全身炎性反应、缺血再灌注损伤等均可导致心肌损伤,进而引起严重低心排量综合征[15]。本研究死亡组中有26 例出现严重低心排,比例达42.6%,是死亡的主要原因之一,多因素Logistic 回归分析显示术后并发低心排综合征是死亡的独立危险因素。故手术应更重视患者的心肌保护和术后心功能维护,目前本中心术中常规采用顺灌+逆灌HTK 液行心肌保护,术后应用多巴胺、肾上腺素、去甲肾上腺素持续静脉泵注维持循环,同时应用PICCO 检测仪连续监测患者心排量,必要时及时应用体外膜肺氧合治疗。
本研究为单中心回顾性研究,术前尚未对AAAD 患者的诊断、合并症进行系统性的细化分型,对夹层撕裂的程度和范围、炎症反应指标、疗效指标也缺乏量化分析,带有一定的局限性。但通过多因素分析死亡危险因素,有助于提高临床医师对AAAD 手术治疗风险的理解和判断,为制定手术治疗策略提供参考。今后还需开展大样本前瞻性研究以及多中心合作,为临床提供更准确的数据。

