辣椒胞质雄性不育系CaCOX3的克隆与表达分析
王姣 张水 张婧柔 邵贵芳 邓明华
(云南农业大学园林园艺学院 昆明 650201)
辣椒(Capsicum annuumL.)是茄科辣椒属一年生草本植物,在我国蔬菜产业中占有重要地位。优良品种的培育可以提高辣椒的产量和质量,因此,培育出优良的品种有着重要的意义。辣椒是常异花授粉植物,杂交优势明显,在生产中,F1杂交品种已广泛应用。辣椒胞质雄性不育(Cytoplasmic male sterility,CMS)是杂交优势利用的基础和主要途径,是辣椒育种研究的主要方向。CMS在自然界普遍存在,已在200多个物种中发现[1]。CMS植株不能产生正常可育的花粉、花药或雄配子,大量研究表明,这种雄性不育现象与植物的能量代谢异常有关[2]。
线粒体是植物正常生长的能量工厂,为植物提供能量。COX3是线粒体呼吸链第4个复合体亚基细胞色素氧化酶第三亚基编码的基因,是呼吸链的重要组成部分,与线粒体的能量代谢直接有关[3]。线粒体呼吸链包含多个复合体:复合体Ⅰ(NADH脱氢酶)、复合体Ⅱ(琥珀酸脱氢酶)、复合体Ⅲ(细胞色素C还原酶)和复合体Ⅳ(细胞色素C氧化酶)[4]。除此之外,还有复合体Ⅴ,即F0F1-ATP合酶,通常代表F0F1-ATP合酶的F0亚基部分。
在野生型水稻CMS系RT98A和烟草CMSⅠ、CMSⅡ中鉴定到复合体Ⅰ的nad7和nad9[5]。在烟草CMSⅡ中,整个nad7缺失导致CMS,烟草CMSⅠ中,nad7外显子缺失导致CMS[5]。在复合体Ⅳ中,DC-CMS萝卜的orf463序列是由部分COXⅠ序列和一段未知的1 261 bp序列组成[6]。HLCMS水稻中,orfH79与COXⅡ表现出高度的同源性[7]。在复合体Ⅴ中,Boro CMSⅡ-型水稻和向日葵PEF1-CMS,水稻的orf79和atp6共转录[8-9],向日葵中检测到与CMS相关的0.5 kb序列插入到atp9的3′上游序列[10]。同时,在线粒体中有很多与呼吸链相关的基因被克隆,其中,甜菜CMS的atpA、COXⅠ、COXⅡ和orf187被克隆,并进行了表达分析,发现保持系和CMS系编码的氨基酸和核苷酸序列都发生了改变,此外相同基因在两系同一个花蕾发育时期的表达存在差异[11]。周晓娟等[12]发现洋葱atp6在保持系和CMS系之间的表达存在差异。刘科伟等[13]发现辣椒CMS相关基因orf456只在CMS系中表达,推测该基因控制辣椒花药中蛋白的表达,引起小孢子败育,进而导致败育。
在辣椒CMS中,很多能量代谢相关基因在CMS系和保持系的小孢子发育表达量存在差异[14-16]。但有关COX3在辣椒胞质雄性不育中的相关研究未见报道。本研究以辣椒CMS系和保持系为实验材料,分析COX3在两系中的差异,为研究辣椒CMS与能量代谢的关系提供参考。
1 材料与方法
1.1 材料
实验材料为湖南省蔬菜研究所选育的辣椒CMS系9704A和保持系9704B,种植于云南农业大学园林园艺学院试验基地。取盛花期保持系9704B的茎、叶、胎座、果皮、种子5个不同的组织进行表达。同时取两系花蕾的4个不同发育阶段(造孢细胞增殖期、花粉母细胞减数分裂期、小孢子单核期和小孢子成熟期)为实验材料进行发育过程表达分析。
1.2 方法
1.2.1 RNA的提取及cDNA的合成 采用Trizal试剂提取所有材料的RNA,在-80℃保存RNA,利用紫外分光光度计测定其浓度和纯度,对符合要求的RNA样品用TaKaRa试剂盒进行反转录成cDNA,-20℃保存。
1.2.2COX3的克隆 根据NCBI数据库中辣椒线粒体DNA的全序列,用Primer 5.0软件设计特异引物,用于COX3编码区全序列的扩增,上游引物F1 :5′-TCGGGTCATTTCTTGGTG-3′,下游引物 R1 :5′-TAGACCCCAAAGAGCCCT-3′。所用引 物由擎科生物技术有限公司昆明分部合成。PCR反应体系为1 μL cNDA、22 μL 金牌 mix和上下游引物各 1 μL。PCR 反应程序为 98℃ 2 min;98℃ 10 s,56℃ 20 s,72℃ 18 s,35 个循环 ;72℃ 5 min。
1.2.3 生物信息学分析 对获得的PCR扩增条带进行双向测序,根据获得的序列进行相关分析:推导出该基因的氨基酸序列及分子量、等电点;预测蛋白质的二级结构、亚细胞定位情况和保守结构域;分析氨基酸的同源性及构建多种物种进化树。所用的软件及服务器网址参照邵贵芳等[4]报道。
1.2.4 实时荧光定量PCR分析 采用TaKaRa荧光定量试剂盒,以两系4个不同发育阶段的花蕾cDNA为模板,设计引物F2:5′-ACTGCTCGTTTTTCCTTC-C-3′,R2 :5′-TTTTCGGGCTTCTTCTCAT-3′。以辣椒Actin片段为内标(引物F3:5′-TGCAGGAATCCACGAGACTAC-3′和 R3 :5′-TACCACCACTGAGCACAATGTT-3′),运用Applied Biosystem荧光定量PCR仪进行q-PCR扩增。反应体系为10 μL的SYBR Premix ExTaq Ⅱ、上下游引物各 0.8 μL(10 μmol/L)、2 μL的 cDNA模 板、0.4 μL的 POX Reference DyeⅡ 和6 μL的 ddH2O。反应程序为 95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环,每个样品重复3次。数据用2-ΔΔCt法进行相对表达量计算[17]。
2 结果
2.1 CaCOX3的扩增
以辣椒CMS系和保持系的cDNA为模板,采用特异性引物F1和R1扩增CaCOX3(图1)。经测序,获得大小为1 100 bp片段,与预期目的基因大小相符。

图1 辣椒CaCOX3的扩增结果
2.2 CaCOX3的生物信息学分析
经RT-PCR扩增获得目的基因CaCOX3的编码区全长为798 bp,编码265个氨基酸(图2)。生物信息学分析,CaCOX3编码氨基酸的分子量为29.88 kD,等电点为6.854。通过SOPMA程序预测蛋白质二级结构,含有α螺旋135个(50.94%)、延伸链43个(16.23%)、β转角16个(6.04%)和无规则卷曲76个(26.79%)。预测辣椒CaCOX3蛋白定位在细胞质中的概率为94.1%。
2.3 CaCOX3氨基酸序列比对及其进化关系

图2 CaCOX3的CDS全序列及其编码的氨基酸序列
对保持系和CMS系CaCOX3蛋白质一级结构进行对比,两者之间的氨基酸序列没有差异。通过BLASTP比对,辣椒CaCOX3氨基酸序列与烟草(Nicotiana tabacum,BAD83521.2)、 马铃薯(Solanum tuberosum,AAM47526.1)、下垂辣椒(C. baccatum,PHT41048.1)、 酸 浆(Physalis heterophylla,AKZ24 689.1)、维吉尼亚酸浆(Physalis virginiana,AKZ24690.1)、 西 瓜(Citrullus lanatus,YP_003587238.1)、 刺 槐(Rhazya stricta,YP_009041182.1) 和 百 脉 根(Lotus japonicus,YP_005090497.1)的同源性分别为99%、95%、96%、95%、95%、98%、94% 和 98%。 采 用 MegAlin、MEGA7.0等构建COX3进化树,结果(图3和图4)表明,辣椒CaCOX3与烟草的COX3的亲缘关系近。
2.4 CaCOX3的组织表达分析
通过分析CaCOX3在辣椒保持系9704B不同组织的表达(图5)发现,该基因在5个组织中表达存在差异,叶中的表达量最低,果中表达最高,它们之间相差9倍,同茎相比,叶和种子的表达量低于茎。
2.5 CaCOX3在保持系和CMS系花蕾不同发育时期的表达分析
CaCOX3在保持系和CMS系中的表达量如图6所示。保持系9704B中,该基因在造孢细胞增殖期表达量最高,随着小孢子的发育,其表达量不断降低。CMS系9704A中,该基因在小孢子成熟期表达量最高,在小孢子发育的过程中花粉母细胞减数分裂期表达量最低,小孢子单核期、小孢子成熟期表达量呈现上升趋势。在两系小孢子单核期,两者之间的差异不明显,在其他3个时期存在很大差异。在小孢子发育的造孢细胞增殖期,两系存在差异显著性,保持系是CMS系的6.4倍。在花粉母细胞减数分裂期,保持系和CMS系的表达量接近6∶1,保持系明显高于CMS系。在小孢子成熟期,CMS系高于保持系,是保持系的2倍。结果表明,在保持系和CMS系中,该基因的表达量存在较大差异,可能与雄性不育的形成有关。
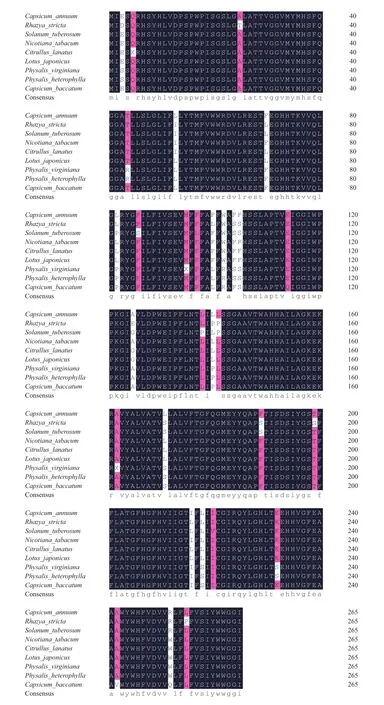
图3 辣椒与其他物种COX3氨基酸比对
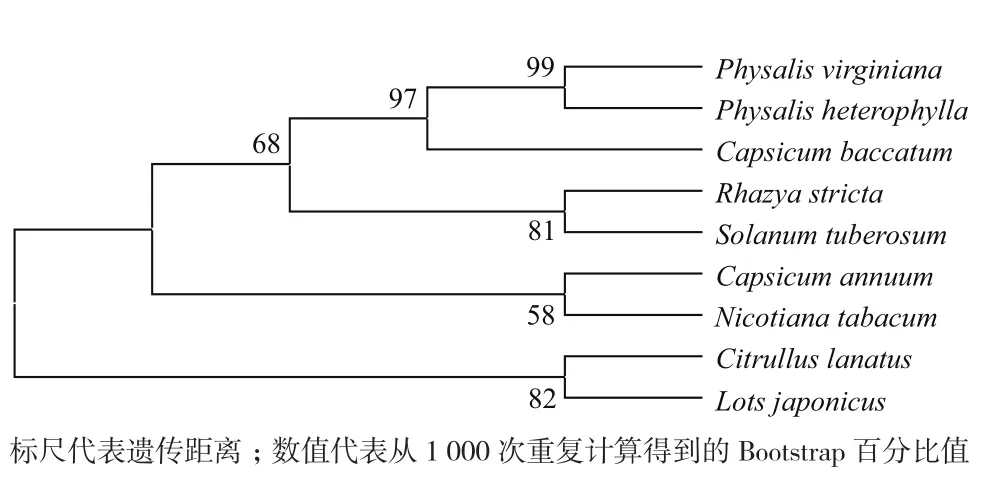
图4 辣椒与其他物种COX3氨基酸进化树分析

图5 CaCOX3在9704B不同组织中的表达分析

图6 9704A和9704B花蕾不同时期CaCOX3的表达分析
3 讨论
线粒体呼吸链的最后一个酶是线粒体细胞色素c氧化酶,它将电子从细胞色素c驱动到氧分子[18]。COX1、COX2和COX3是由线粒体基因组编码的3个细胞色素c氧化酶的核心基因。研究表明,COX3在细胞色素c氧化酶中最保守,常用作物种分子系统演化和分类的有效基因[19]。在红麻CMS系和保持系线粒体基因组研究中,COX3的组织形式在两系中存在差异[20]。在粘类小麦CMS基因研究中,COX3在4种CMS系中的转录本小于保持系,推测基因可能参与粘类小麦CMS的形成[21]。本研究发现,CaCOX3在花蕾的不同时期,保持系在造孢细胞增殖期、花粉母细胞减数分裂期的表达量远高于CMS系。根据目前研究,花粉败育主要发生在单子叶植株小孢子成熟后期,双子叶植物发生在四分体时期或小孢子发育时期[22]。辣椒是典型的双子叶植物,在小孢子发育时,能量代谢发生改变,易造成不育现象的产生。CaCOX3作为呼吸作用中关键性基因,呼吸作用消耗有机物质,释放出能量用于植物的正常发育,保持系中该基因的表达量高,释放出的能量多,而CMS系该基因表达量少,释放出的能量少,因而造成了CMS系的小孢子不能正常生长发育,这可能是造成CMS的原因。在小孢子单核期,两系之间该基因的表达量几乎一致,但由于CMS系在小孢子花粉母细胞减数分裂期能量不足,小孢子正常生长发育被打破,因而后期的能量是否充足,对小孢子能够正常发育的意义不大。
4 结论
克隆获得CaCOX3,其在辣椒胞质雄性不育9704A和保持系9704B中表达量存在差异,可能引起能量代谢异常,造成雄性不育。
——农民邓祚荣曾绘的水稻“两系”育种神话图谱

