融合蛋白基因与抗体基因电转染CHO-S细胞的条件摸索优化
邓晓芬 杨晓佳 易天红 冯英 柯潇 赖维莉
(成都康弘药业集团股份有限公司产品技术中心,成都 610036)
近年来,全球药物研发的重心正在从小分子化药向生物大分子药物转移,比如抗体、疫苗、激素、生长因子、细胞因子、凝血因子和酶等,其中大部分为蛋白类药物。由于多数蛋白类药物分子量较小,半衰期短,为了延长药物的半衰期,蛋白融合技术应运而生[1]。融合蛋白药物是利用基因工程技术将某种具有生物学活性的功能蛋白分子与其他天然蛋白融合而产生的新型蛋白类药物。与传统的蛋白类药物相比,融合蛋白药物具有双功能性[2],既提高了功能蛋白的稳定性,延长在体内的代谢时间,又融合多个功能片段,形成高效靶向药物。
继重组蛋白药物之后,重组抗体药物引领了第2次生物医药产品浪潮,是今后若干年新药研发的主要方向[3]。重组抗体是指利用重组DNA技术或是基因突变的方法改造某种抗体基因的编码序列,使之产生出自然界中原本不存在的抗体蛋白分子[4]。重组抗体类药物从组成上分为两类,一类是抗体本身,而另一类是由抗体本身与治疗药物(如放射性核素,毒素等)结合构成。
随着生物药物的发展,各种重组蛋白表达平台也在发展,其中CHO细胞是表达重组蛋白(特别是融合蛋白和基因工程抗体)最常用的宿主之一[5-6],而重组蛋白基因在宿主细胞内的高效表达,最关键的步骤便是基因的转染。目前常用的转染方法主要有电转染、脂质体转染、显微注射法、磷酸钙共沉淀法等[7]。电转染法相比其他转染技术,具有操作简便、重复性好和转染效率高等优点,电转染几乎适用于所有细胞,但是不同的电转染条件,会导致外源基因的转染效率不同,即便在最优条件下转染相同细胞,不同的外源基因,转染效率也会有所差别。本研究旨在摸索编码融合蛋白和抗体的重组质粒分别转染CHO-S细胞的最佳电转染条件,并对比在最优电转条件下两分子转染CHO-S细胞的效果,为后续电转染重组融合蛋白和重组抗体分子提供一定的数据支持。
1 材料与方法
1.1 材料
1.1.1 质粒与细胞 抗血管内皮细胞生长因子受体融合蛋白表达载体pCMVi-VEGFR(由VEGFR1中的免疫球蛋白样区域2和VEGFR2中的免疫球蛋白样区域3,与人免疫球蛋白 Fc片段经过融合而成),抗肿瘤坏死因子-α抗体表达载体pCMVi-TNF-α由成都康弘药业集团股份有限公司构建并保存。CHO-S细胞,购自美国Life TechnologyTM公司。
1.1.2 主要试剂及仪器 去内毒素质粒抽提试剂盒购自德国QIAGEN公司,限制性内切酶FspⅠ购自美国NEB公司,细胞培养基CD FortiCHO、Anticlumping agent、L-Glutamine均购自美国Gibco公司,电转仪Amaxa Nucleofector-II及试剂盒Amaxa Cell Line Nucleofector Kit V购自瑞士Lonza公司,紫外分光光度计Nanovue购自美国GE公司,细胞计数仪Vi-cell购自美国Beckman公司,Octet Qke Refurb检测仪购自美国Pall公司,CloneMedia-CHO、高通量细胞筛选仪Clone Pix购自美国Molecular Devices公司,CO2培养箱Forma371购自美国Thermo Fisher公司,细胞培养摇床ISF1-X购自瑞士科耐公司。
1.2 方法
1.2.1 转染质粒的提取及线性化 将构建好的重组质粒菌种扩大培养,按照去内毒素质粒抽提试剂盒说明书的方法提取质粒后进行质粒的线性化,37℃过夜酶切后回收质粒,1%琼脂糖凝胶电泳检测质粒DNA的线性化程度,紫外分光光度计检测质粒DNA浓度后于-20℃保存待用。
1.2.2 细胞传代培养 细胞用125 mL摇瓶,于120 r/min,36.5℃,5% CO2摇床培养,每2-3 d进行细胞计数,以2×105vc/mL传代,培养体积为30 mL,细胞传代培养基配制:1 L CD FortiCHO培养基加入40 mL L-Glutamin 和 10 mL Anti-clumping agent,4℃保存,使用前室温预热。
1.2.3 重组质粒电转条件的摸索 将线性化的重组质粒进行以下电转染条件的摸索:电转染程序、质粒用量和细胞用量,具体转染实验设计见表1,首先在细胞用量为1×107个/孔,质粒用量为10 μg/孔的前提下,摸索并确定最佳的电转染程序(U-023、U-024、U-030),接着利用最佳的电转染程序,在细胞用量为1×107个/孔的前提下,摸索并确定电转最佳的质粒用量(5、10、15、20 μg/孔),最后在最佳的电转染程序和最佳的质粒用量前提下,摸索并确定电转最佳的细胞用量(1×107、1.5×107、2×107个/孔)。电转染前,6孔板中各加入2.5 mL细胞传代培养基,37℃培养箱预热;取CHO-S细胞计数,计算使用的细胞体积;电转染按Amaxa Cell line Nucleofector kit V 转染试剂盒操作程序进行;电转染后,6孔板置于36.5℃、5% CO2培养箱静置培养,48 h后取0.5 mL细胞液检测细胞活率和活细胞密度,另取0.5 mL细胞液1000 r/min离心5 min,上清用Octet Qke Refurb检测仪检测蛋白表达量,综合细胞的生长和蛋白表达量判断最佳电转染条件,并最终对比融合蛋白与抗体表达质粒的电转效果。
1.2.4 转染效率的检测 采用高通量细胞筛选仪Clone Pix进行转染后重组细胞阳性克隆数的统计。转染48 h后进行细胞计数,用新鲜培养基将细胞稀释到最佳密度5000 cells/mL;已融化的半固体培养基CloneMedia中加入其它成分,配成100 mL体积:90 mL CloneMedia+7 mL水+1 mL CloneDetect+2 mL Clone XL Reagent;将稀释好的细胞液加入到配好的CloneMedia中,混匀后接种6孔板,2 mL/孔,37℃,5%CO2培养。培养10 d后,观察每个孔长出的克隆数,间接判断细胞的转染效率。

表 1 电转染条件摸索实验设计
2 结果
2.1 重组表达质粒提取及线性化结果
质粒按照去内毒素质粒提取试剂盒方法提取,得到的质粒浓度和纯度均较高,见表2,用限制性内切酶FspⅠ酶切后,采用1%琼脂糖凝胶电泳检测质粒的线性化程度,见图1,结果显示质粒线性化成功,可用于后续转染实验。
2.2 电转染条件摸索试验结果
将编码融合蛋白和抗体的重组质粒分子线性化后,转染CHO-S细胞,分别对两种分子的电转程序、质粒用量和细胞用量进行摸索。采用细胞计数仪检测其活率、密度,Octet Qke Refurb检测仪检测细胞的蛋白表达量,通过对比细胞的状态及蛋白表达量来确定最佳的转染条件。融合蛋白重组质粒电转染条件摸索结果见图2。

表2 重组表达质粒浓度及纯度

图1 1%琼脂糖凝胶电泳检测重组表达质粒的线性化程度
采用不同的电转染程序(U-023、U-024、U-030)电转CHO-S细胞,48 h后检测细胞的活率(2-A)、细胞的密度(2-B)及细胞的蛋白表达量(2-C),结果发现U-030程序下细胞的密度虽然最低,但与其他电转程序下的细胞密度相比,差异并不是特别明显,且该细胞的蛋白表达量最高,因此确定最佳电转染程序为U-030;同理对电转染质粒的用量进行摸索(2-D-F),确定最佳质粒用量为20 μg/孔;对电转染细胞的用量进行摸索(2-G-I),确定最佳的细胞用量为1×107个/孔,最终确定该分子转染CHO-S细胞的最佳电转程序为U-030,最佳质粒用量为20 μg/孔,最佳细胞用量为1×107个/孔。抗体重组质粒电转染条件摸索结果见图3,其中包括对电转程序的摸索结果(3-A-C)、质粒用量的摸索结果(3-D-F)及细胞用量的摸索结果(3-G-I),最终确定该分子转染CHO-S细胞的最佳电转程序为U-024,最佳质粒用量为15 μg/孔,最佳细胞用量为1×107个/孔,两分子的最佳转染条件汇总见表3。

表3 融合蛋白重组质粒和抗体重组质粒的最佳电转条件汇总
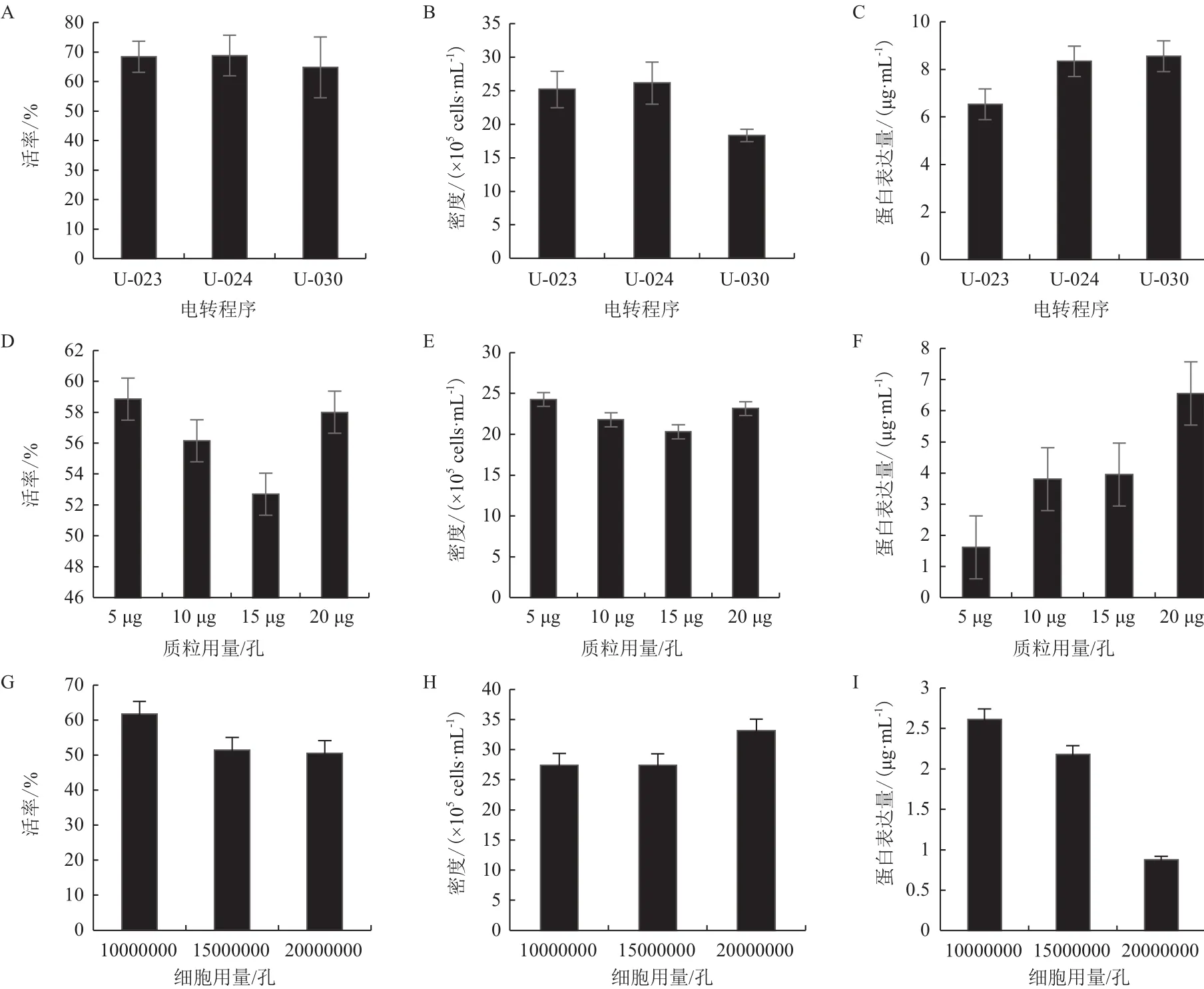
图2 融合蛋白重组质粒电转染条件摸索实验结果
2.3 融合蛋白重组质粒和抗体重组质粒电转CHO-S细胞的效果对比
根据电转染条件摸索实验结果,两个重组质粒均采用最佳条件电转染CHO-S细胞,48 h后对细胞的活率、细胞的密度及蛋白表达量进行检测,结果如图4。电转后两者的细胞活率(4-A)差异不大,抗体重组质粒转染细胞的密度稍高于融合蛋白重组质粒(4-B),且细胞的蛋白表达量也更高(4-C),证明抗体重组质粒转染CHO-S细胞的效果略优于融合蛋白重组质粒。
2.4 半固体培养间接检测重组表达质粒的转染效率
将采用最佳条件电转染的CHO-S细胞48 h后进行半固体培养基接种,培养一段时间后采用高通量细胞筛选仪Clone Pix进行荧光成像,检测两个重组表达质粒转染CHO-S细胞的阳性克隆数。结果如图5,表达抗体的重组细胞形成的阳性克隆个数多于融合蛋白重组细胞(图5-A),且根据平均外部荧光强度判断,抗体重组细胞阳性克隆的荧光强度高于融合蛋白重组细胞(图5-B、5-C),与2.3的结果趋势一致,再一次证明了抗体重组质粒电转染CHO-S细胞的效果优于融合蛋白重组质粒。

图 3 抗体重组质粒电转染条件摸索实验结果

图4 融合蛋白重组质粒与抗体重组质粒转染CHO-S细胞的效果对比
3 讨论
目的基因能否进行表达,取决于表达质粒能否成功转染进宿主细胞,细胞转染作为重组生产用细胞株筛选的第一步,也是最重要的一步。目前常用的细胞转染方法主要有物理方法、化学方法及生物方法[8],电转染作为物理转染方法应用非常广泛,几乎适用于所有细胞类型。但是不同的细胞系有不同的最佳转染条件,即使是相同的细胞,转染入不同的外源基因,也会有不同的最佳条件,况且不同的实验室转染效率也有所不同[9],因此需对不同的基因,细胞类型,用量,转染条件等因素进行摸索和优化。

图5 融合蛋白与抗体重组细胞半固体阳性克隆数及荧光强度对比
本研究利用实验室现有的条件,对融合蛋白重组质粒和抗体重组质粒电转染CHO-S细胞进行了简单的摸索优化,主要从电转染程序、质粒用量及细胞用量三方面入手,通过对比转染后细胞的活率、密度及蛋白表达量的差异,最终确定细胞的最佳电转条件。结果显示,转染相同的CHO-S细胞,融合蛋白分子和抗体分子的最佳转染条件均不同,且抗体分子的蛋白表达效果略优于融合蛋白分子。
利用摸索好的最佳转染条件,对CHO-S细胞电转后进行半固体接种,利用高通量细胞筛选仪Clone Pix对转染的阳性克隆细胞进行统计,结果进一步证实抗体重组质粒转染CHO-S细胞的效果优于融合蛋白重组质粒,这也为以后抗体或融合蛋白分子转染CHO-S细胞,获得最优的蛋白表达提供了一定的数据支持,也提示对于其他类型的细胞,或者其他重组质粒,同样需要设计相应的实验对最佳转染条件进行摸索,进而得到最优的转染效果。
4 结论
融合蛋白重组质粒转染CHO-S细胞的最佳条件为:电转程序U-030,质粒用量为20 μg/孔,细胞用量为1×107个/孔;抗体重组质粒转染CHO-S细胞的最佳条件为:电转程序U-024,质粒用量为15 μg/孔,细胞用量为1×107个/孔,且抗体重组质粒转染CHO-S细胞的效果优于融合蛋白重组质粒。

