根结线虫活体染色条件的优化
高英健,郑雨杭,张琴林,侯钰颖,李 萌,李鸿信,方天一,吕伟兴,赵文超,王绍辉
(北京农学院 植物科学技术学院/农业应用新技术北京市重点实验室,北京 102206)
根结线虫(Root-knot Nematode, RKN)是植物根系内寄生线虫,包括爪哇根结线虫(Meloidogynejavanica),南方根结线虫(Meloidogyneincongnita),花生根结线虫(MeloidogynehaplaChitwood)和北方根结线虫(Meloidogynehapla)等,第二阶段幼虫(J2s)从土壤中的卵孵化,必须找到合适的宿主,机械穿透植物根部,并迁移到维管束组织以完成其生命周期,给生产带来很大的损失[1]。
近年来,关于根结线虫染色方法的报道有很多,如酸性品红染色观察根组织[2];甲苯胺蓝[3]或番红-固绿对染染色观察巨细胞[4];但是这些染色方式均针对于死亡的线虫。对活体幼虫标记所用的染料有异硫氰酸荧光素[5]和荧光素二乙酸酯[6]。本文作者选用的是异硫氰酸荧光素,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)是目前应用最广泛的荧光素,最大吸收光波长为490~495 nm,最大发射光波长520~530 nm,在蓝光或紫外光照射下发出黄绿色荧光。
在之前的研究中,FITC对活体线虫的标记缓冲液的浓度过高,造成线虫的死亡率较高,本文作者对FITC染液的浓度进行了优化,提升了线虫的存活率,可为侵染试验提供更有活力的荧光标记线虫。
1 材料与方法
1.1 试验材料和主要试剂设备
试验所采用的材料为南方根结线虫(Meloidogyneincognita)和番茄CM野生型株系(Solanumlycopersicumcv Castlemart)。
试验中所需的试剂:FITC、章鱼胺盐酸盐、间苯二酚、Sucrose、MS Powder、NaOH、植物凝胶、Pluronic凝胶。
试验中所需的设备:荧光体式显微镜(ZEISS,Discovery.V20)、恒温培养箱、光照培养箱、电子天平、高温灭菌锅。
1.2 试验方法
1.2.1 南方根结线虫的繁育 根结线虫自繁方法如下:用于繁殖根结线虫的株系为易感株系。待植株长到4~5片叶时,将其移栽至20 cm的装有病土的营养钵中,病土和营养钵在使用前需要消毒。接种35~50 d时,观察到其根部有大量淡黄色的卵块时,取出长有卵块的根系。小心的将根系用清水洗干净,挑取上面的卵块,将挑取的卵块放入1%的NaClO溶液中消毒30 s,之后用去离子水冲洗3次。再将卵块放入适量的去离子水中,放至26 ℃恒温箱中孵化2~3 d,收集已孵化出的J2,并计算其密度,用于后续的试验。
1.2.2 番茄幼苗的培育 将番茄种子放入灭过菌的50 mL离心管中,加入适量的灭菌水,放入37 ℃摇床中摇晃6 h。然后在超净工作台中将种子用75%乙醇消毒3 min,4%次氯酸钠消毒8 min,再用灭菌水洗6~8次,将种子放入1/2 MS培养基中铺平,生长7~10 d。
1.2.3 线虫荧光标记条件的设定 前人采用的标记缓冲液浓度为(FITC:0.1 mg/mL、0.5%间苯二酚、30 mmoL章鱼胺盐酸盐)染色时间为6 h[7],在此基础上设置不同的染液浓度,如表1。
将J2浸入不同浓度的FITC染液中,在黑暗条件下培养3、4和6 h,将染色的线虫同染液一起过孔径76 μm的筛子,用清水冲洗几遍,之后将筛子上的线虫洗脱至培养皿中,将洗脱的线虫置于荧光体式显微镜下观察其显色情况,6次重复。
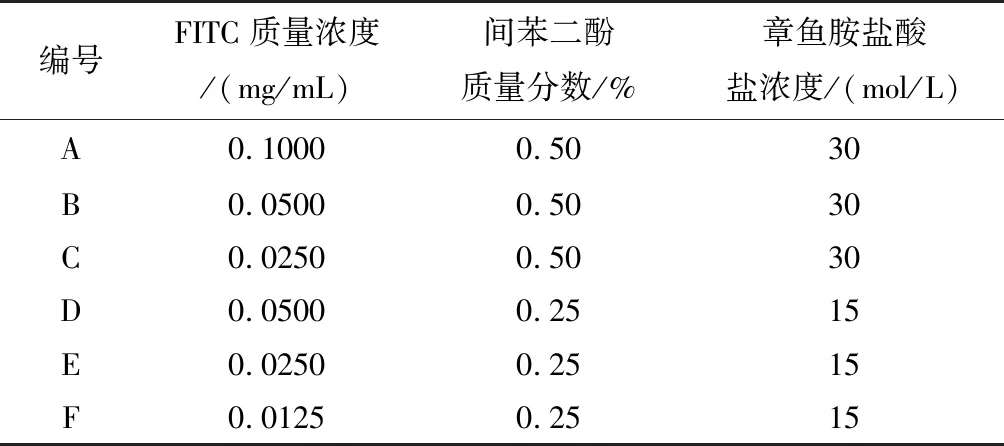
表1 FITC标记缓冲液浓度梯度Tab.1 FITC labeled buffer concentration gradient
1.2.4 存活率的统计 将染色后的线虫吸取20 μL放在培养皿中,在显微镜下,分别统计20 μL里存活的线虫数量与总共的线虫数量,每个梯度和时间点做20个重复,选取最集中的数值按以下公式计算。方差分析采用Duncan’s多重比较法(P<0.05),采用SPSS 20.0软件进行相关性分析,实验数据采用平均数±标准差表示。存活率=存活线虫数/总线虫数。
1.2.5 Pluronic凝胶法观察线虫的入侵 Pluronic凝胶溶液的配制方法为:23 g Pluronic粉末融入100 mL灭菌水中,4 ℃持续振荡24 h,待其全部溶解,4 ℃保存。
将标记后的线虫(约30头)悬浮液加入预先分装的Pluronic凝胶中,静置5 min,使J2均匀分布于凝胶中,再将番茄幼苗根部放置于凝胶中,并放置于26 ℃培养箱中。24 h后在荧光体视显微镜下观察根系线虫的入侵情况。
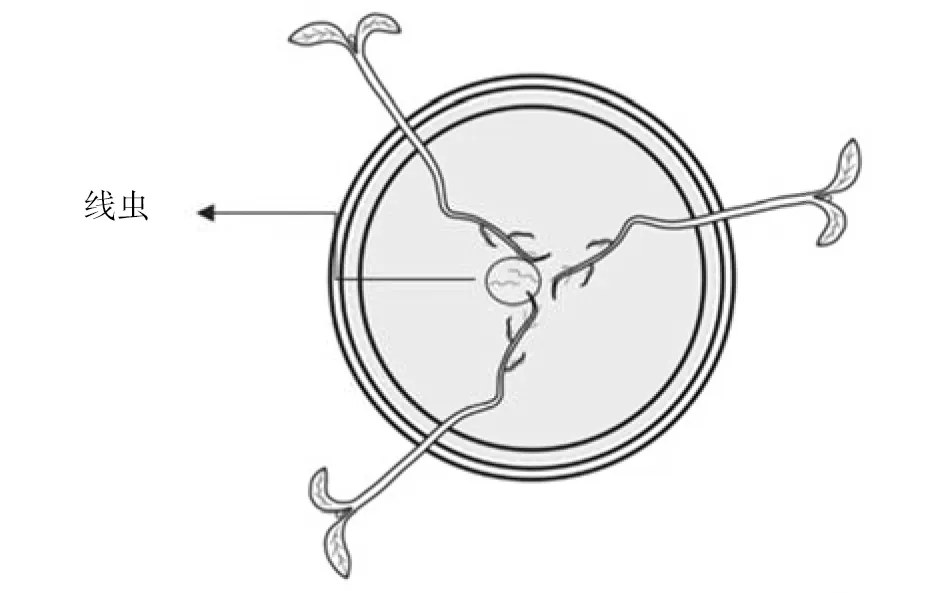
图1 Pluronic凝胶中线虫侵染番茄植株根系示意图Fig.1 Schematic diagram of tomato plant rootsinfected by nematodes in Pluronic gel
2 结果与分析
2.1 线虫存活率统计
根据试验结果可以发现,线虫标记3 h时,D浓度下存活率为78%、E浓度下存活率为95%、F浓度下存活率为97%,存活率相对较高,标记4 h后,线虫在C浓度下存活率为23%、D浓度下存活率为33%、E浓度下存活率为78%、F浓度下存活率为90%,虽然仍有存活,但存活率显著下降,在A、B浓度存活率接近0。标记6 h后,所有浓度的线虫接近死亡状态。
表2 不同标记时间和不同FITC标记缓冲液浓度梯度下线虫存活率
Tab.2 Nematode survival rates at different labeling times and different FITC labeled buffer concentration gradients
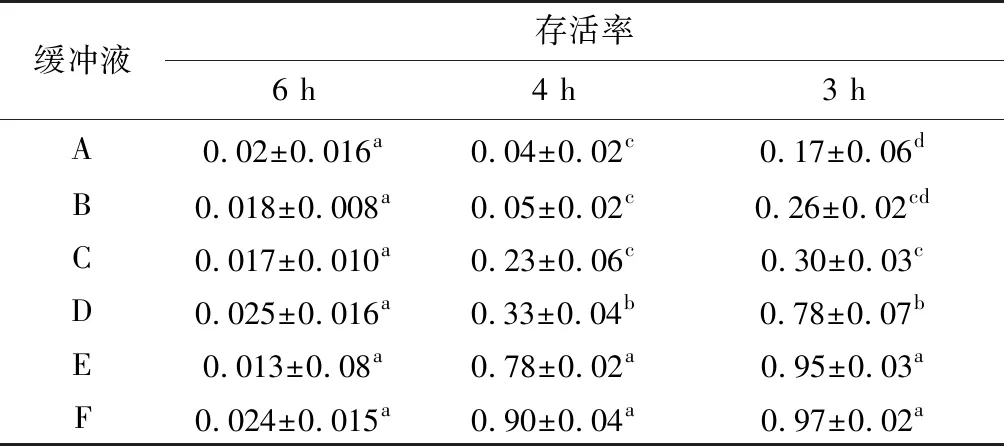
缓冲液存活率6 h4 h3 hA0.02±0.016a0.04±0.02 c0.17±0.06dB0.018±0.008a0.05±0.02c0.26±0.02 cdC0.017±0.010 a0.23±0.06c0.30±0.03 cD0.025±0.016 a0.33±0.04b0.78±0.07 bE0.013±0.08 a0.78±0.02 a0.95±0.03 aF0.024±0.015 a0.90±0.04 a0.97±0.02 a
注:不同小写字母表示差异显著(P<0.05)。
Note: Different lowercase letters indicate statistically different variations atP<0.05.
2.2 不同染液体系和染色时间所标记的线虫荧光强弱的观察
线虫在浓度A-F的条件下标记6 h后观察,在A,B浓度条件下,线虫荧光较亮(图2,A6h和B6h),在F浓度下线虫的荧光亮度极其微弱。在缩短染色时间后,线虫的存活率虽有明显的上升,但是线虫标记的亮度会相应的减弱,标记3 h与4 h比较线虫的荧光显色情况,E浓度下线虫显色较明显,存活率也相对较高。同时在E浓度条件下标记线虫3 h与4 h的荧光显色亮度相近(图2,E3h和E4h),但标记3 h的线虫存活率较高,达到95%。综合所有条件,最终确定FITC:0.025 mg/mL、0.25%间苯二酚、15 mol/L章鱼胺盐酸盐的缓冲液浓度,线虫标记3 h是最优的荧光标记条件。将最优条件下标记的线虫注入番茄幼嫩根系旁,发现被标记后的线虫可以从根尖进入植株根系(图3),仍具有入侵的能力,引起根尖的膨大。

A、B、C、D、E、F分别表示缓冲液A-F浓度下标记的线虫,n=6;Bar:10 μm图2 FITC标记南方根结线虫J2显微观察结果A, B, C, D, E, and F represent the nematodes labeled under the buffer A-F concentration, respectively, n=6; Bar: 10 μmFig.2 Microscopic observation of FITC-labeled M. incognita J2
3 讨 论
FITC的应用十分广泛,是一种常用的荧光探针,主要用于标记多糖、多肽等[8],对线虫的染色试剂有很多,例如甲苯胺蓝,番红-固绿等,但是这些主要针对死线虫,对于活体线虫的标记时,FITC是主要的荧光染料。根据前人的研究,在染色缓冲液条件为:FITC: 0.1 mg/mL, 0.5%间苯二酚和30 mmoL章鱼胺盐酸盐,染色6 h,线虫被标记的荧光很亮[7],但其未检测存活率,我们在该浓度下标记的线虫亮度和前人研究相一致(如图2,A6h),但线虫存活率很低,几乎为0(如表2),线虫存活是后续研究所需的最基本的条件,因此,在我们的研究中发现,通过降低FITC、间苯二酚、以及章鱼胺盐酸盐的浓度和缩短染色时间,可以提高线虫的存活率。在表2中可以发现在标记线虫3 h的存活率较高。在保证线虫存活的条件下考虑标记的亮度,因此舍弃了6 h的标记时间以及a,b两个缓冲液浓度。可以发现e浓度在标记3 h、4 h的亮度相对较亮,因此,选择了在e浓度标记3 h作为最优的标记条件。在最优的标记条件下被标记的线虫具有入侵植物根尖的活力。因此这个方法降低了染液浓度,缩短了染色时间,增加了线虫的存活率,减少了试剂的用量,可以用于靶向和沉默特定的线虫基因,以改变寄主植物的抗性[9]。
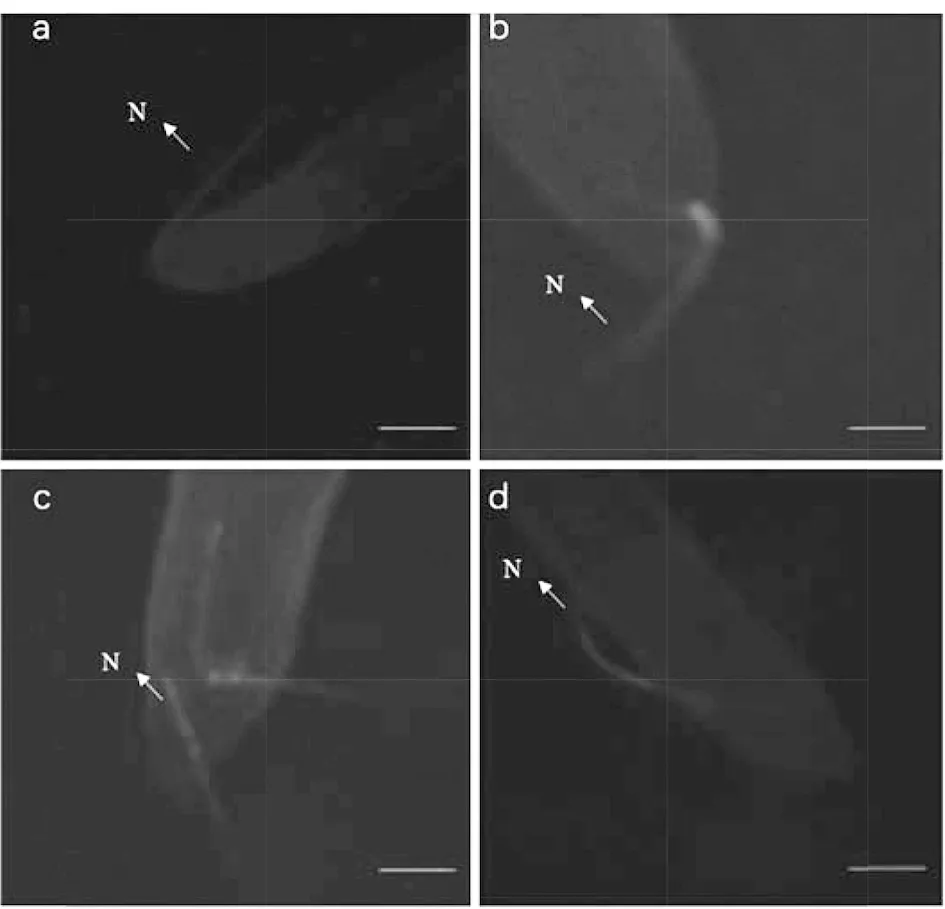
a、b、c、d表示线虫FITC:0.025 mg/mL、0.25%间苯二酚、15 mmoL章鱼胺盐酸盐的缓冲液浓度标记3 h的入侵情况,N:线虫,Bar:20 μm图3 南方根结线虫J2s入侵情况显微观察 a, b, c, d represent the invasion of nematodes marked with FITC: 0.025 mg/ml, 0.25% resorcinol, 15mmoL octopamine hydrochloride for 3 h, N: nematodes;Bar:20 μmFig.3 Microscopy observation of the invasion of M. incognita J2s

