纤维蛋白原Bβ链HinfⅠ基因多态性与胃癌的相关性*
严芝强, 杨 芳
(1.贵州医科大学附院, 贵州 贵阳 550004; 2.贵州医科大学, 贵州 贵阳 550004)
胃癌是常见的消化道肿瘤之一,其发病率在世界范围内排名第4位,死亡率为癌症死因的第2位[1]。根据全国肿瘤登记中心发布的数据,2015年中国胃癌发病例数约为67.9万,死亡例数约为49.8万,其发病率和死亡率都仅次于肺癌而排第2位[2]。随着对胃癌发病机制的深入研究,发现胃癌的发生是由多因素作用、多基因调控、多步骤参与的复杂过程[3]。纤维蛋白原(Fibrinogen,Fg)是一种肝细胞合成和分泌的血浆糖蛋白,其在促进恶性肿瘤发生、发展方面的作用已经得到普遍的认可[4]。Fg主要是作为凝血因子Ⅰ而直接参与凝血过程,促进血栓的形成。恶性肿瘤与凝血功能的改变有密切的关系,肿瘤细胞通过组织因子或其他促凝因子激活Fg,鳞状细胞癌能刺激肝细胞产生大量的Fg,同时Fg可分解形成纤维蛋白,为癌细胞的生长、浸润和转移提供支架,Fg亦可以作为不同的黏附分子的配体,增加血小板(platelet,PLT)及肿瘤细胞间的黏附结合,PLT附着肿瘤细胞的表面,形成瘤栓阻碍免疫细胞攻击肿瘤细胞[5-6]。因此Fg对肿瘤细胞的生长、浸润、转移具有重要的价值。编码β链的基因被认为是影响血浆Fg水平的主要基因,目前的研究大多集中于FgB基因的多态性分析上[7]。但对FgBβ链的基因多态性位点3′端非转录区的Hinf IA/ C位点的临床研究较少[8]。因此,本研究采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)方法对FgBβ-HinfⅠA/ C位点基因多态性进行研究,讨基因多态性与胃癌的相关性。
1 对象与方法
1.1 研究对象
以2013年6月~2015年2月经胃镜和病理活检确诊151例胃癌患者为研究对象,其中男89例、女62例,26~85岁、平均67岁;Ⅰ期36例、Ⅱ期29例、Ⅲ期72例、Ⅳ期13例。以同期151例健康体检者为对照组,其中男91例、女60例, 29~86岁、平均64岁。胃癌组与对照组之间年龄、性别分布差异无统计学意义(P<0.05),具有可比性。
1.2 主要试剂和仪器
Taq DNA 聚合酶上海Sangon生物工程公司,引物合成及Maker(北京天根生化科技有限公司),琼脂糖(西班牙BIOWEST公司),主要仪器PE9700扩增仪(美国ABI公司),DNA成像分析器GelDocEQ(美国Bio-Rad公司),DYY-III-5型稳压稳流电泳仪(北京六一仪器厂),恒温水浴箱(北京长源仪器厂),TGL-16高速离心机(常州国华电子设备公司)。
1.3 方法
1.3.1提取DNA 收集胃癌患者及对照组清晨空腹全血(EDTA-K2抗凝)各151例,白细胞层采用酚-氯仿法提取基因组DNA,-20 ℃保存备用。
1.3.2Fgβ- HinfIA/C位点检测 应用PCR-RFLP技术对Fgβ- HinfIA/C位点进行基因分型。引物序列设计参照元小冬等[10]方法。PCR反应体系,DNA模板1 μL,特异性引物1 μL,上、下游引物1 μL,2×HotstartTaq PCR Master Mix13μL,补ddH2O 9 μL至25 μL。PCR反应条件: 95 ℃预变性5 min,95 ℃变性60 s、54 ℃退火55 s、72 ℃延伸60 s,扩增30个循环,最后72 ℃再延伸5 min。取PCR产物8 μL,加内切酶AvaⅡ/HinfⅠ0.9 μL,Buffer2 μL, ddH2O补足20 μL,混匀,瞬时离心,置37 ℃恒温水浴箱水浴12 h后进行2%琼脂糖凝胶电泳。EB染色,在凝胶成像系统下观察并记录实验结果。
1.4 统计学分析
胃癌患者基因型的分布应用Hardy-Weinberg(H-W)平衡软件计算并进行统计检验(P>0.05 表明研究人群符合H-W 平衡),胃癌患者基因型和等位基因频率的分布采用χ2检验分析,采用非条件Logistic回归法计算比值比(OR)和95%CI。
2 结果
2.1 两组人群的年龄及性别的分布
胃癌组与对照组的年龄、性别分布比较,差异无统计学意义(χ2=0.468、P=0.055,P>0.05),见表1。

表1 两组被检人群年龄及性别的分布Tab.1 Distribution of gender and age of two groups
2.2 两基因位点PCR产物酶切结果
FgBβHinfⅠA/C基因多态性呈A-C两态,A等位基因含HinfⅠ酶切位点,当A突变为C时,A等位基因缺乏HinfⅠ酶切位点, HinfⅠ位点AA型表现为140 bp和100 bp两个片段,AC型表现为240 bp、140 bp和100 bp片段,CC型表现为240 bp片段,见图1。
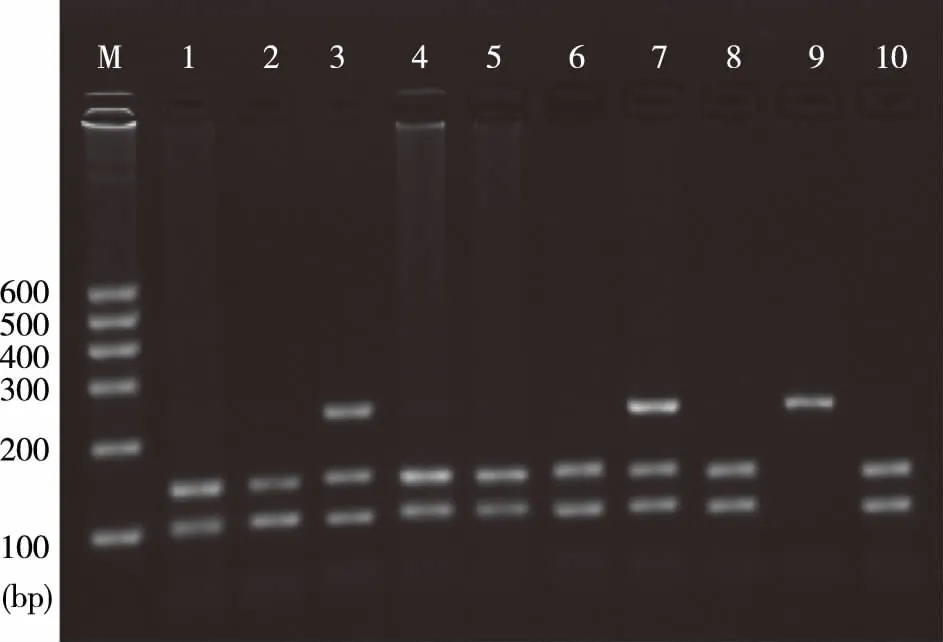
注:M为DNA Marker,1、2、4、5、6、8、10为AA基因型,3、7为AC基因型,9位CC基因型图1 FgBβHinfⅠA/C位点PCR产物酶切后的琼脂糖凝胶电泳结果Fig.1 FgB β Hinf I A/C locus sepharose electrophoretogram
2.3 FgBβHinfⅠA/C基因多态性Hardy-Weinberg平衡度检验
FgBβHinfⅠA/C应用χ2检验对胃癌组及对照组的基因型频率进行Hardy-Weinberg平衡检验,两组受检者FgBβHinfⅠA/C基因多态性分布均符合Hardy-Weinberg平衡(χ2=0.596、0.011,P=0.440、0.918),见表2。
表2 FgBβHinfⅠA/C基因位点的H-W平衡检验Tab.2 FgBβHinfⅠA/C locus H-W balance test
注:P>0.05,符合Hardy-Weinberg平衡
2.4 胃癌组及对照组FgBβHinfⅠA/C基因型分布和等位基因频率
结果显示,FgBβHinfⅠA/C位点的基因型在胃癌组和对照组中的比较分布无统计学意义,等位基因在两组之间的分布差异具有统计学意义 (χ2=6.002,P=O.05;χ2=5.706,P<0.05),见表3。

表3 FgBβHinfⅠA/C基因位点基因型频率及等位基因频率在两组中的分布(n,%)Tab.3 Distribution of FgB β HinfIA/C locus genotypefrequency and allele frequency in both groups
2.5 FgBβHinfⅠA/C基因的多态性与胃癌的临床分期、转移的关系
结果显示,FgBβHinfⅠA/C基因的AA、AC及CC基因分型分布与胃癌的临床分期及转移无关,各期型频率分布比较差异无统计学意义(χ2=5.905、P>0.05;χ2=0.736、P>0.05)。见表4。

表4 FgBβHinfⅠA/C位点的基因多态性与不同分期及淋巴结转移的关系(n,%)Tab.4 Relationship between FgB β HinfIA/C locus polymorphism and different staging and lymph nodes transfer
2.6 FgBβHinfⅠA/C位点不同基因型对胃癌的相对危险度分析
结果显示,FgBβHinfⅠA/C位点的AC型可能与胃癌的发病有关联,且AC基因型在两组人群中的分布差异具有统计学意义(OR=1.888,95%CI为1.105~3.224;χ2=5.488,P 表5 FgBβHinfⅠA/C位点各基因型及等位基因对胃癌的相对危险度Tab.5 Relative risk degree of FgBβHinfⅠA/C locus genotypes and allele gene on gastric cancer Fg作为重要的凝血因子,其功能表达和调控一直是临床研究的重点内容之一。Humphries等[9]最早发现了Fg3条链的多个基因多态性位点,同时探讨了遗传机制在Fg水平调节中所起的作用,发现大约51%的Fg结构功能及水平的异常与基因遗传缺陷相关。有研究也表明FgBβ链的mRNA 合成是调控纤维蛋白原整个分子合成的限速步骤,而其基因学特征是决定纤维蛋白原功能表达的主要因素。FgBβ链转录区8.1 kb的基因长度中,所含有的8个外显子仅占1.9 kb,而7个内含子却为6.2 kb,约占转录区基因总长度的76.5%;同时由于内含子区的基因位点并不直接参与mRNA的转录,正是机体存在内含子,且大部分基因随机变异或突变发生在这种内含子中,而使机体对基因突变或变异的耐受能力明显增强。本研究结果显示,胃癌组和对照组的性别、年龄分布差异均无统计学意义,FgBβHinfⅠA/C基因多态性位点在两组人群等位基因频率分布均符合H -W平衡定律[11], 说明本项研究人群具有代表性。研究结果显示,β-HinfIA/C位点的C等位基因频率在对照组为18.5%,这高于孙川等[12-13]报道的正常人G1689频率,这可能是由于地区、种族,环境的不同所造成。还显示β-HinfIA/C位点的基因型和等位基因分布在胃癌组和对照组之间有统计学差异,提示β-HinfIA/C位点基因多态性可能与胃癌的发生相关。对胃癌患者进行危险度评价,结果显示Fgβ-HinfIA/C位点中以AA型及A等位基因作对照,携带AC基因型及C等位基因的个体患胃癌的风险分别是携带AA基因型及A等位基因的1.888倍和1.737倍(P=0.019和0.017),差异具有统计学意义,携带突变纯合子CC型的个体患胃癌的风险是携带AA型的1.983倍,差异无统计学意义(P>0.05),推测Fgβ-HinfIA/C位点基因改变可能对胃癌的发病起着重要作用,C等位基因可能是胃癌发病的遗传危险因素。进行Fgβ-HinfIA/C基因的多态性与胃癌的临床分期、转移比较发现,Fgβ-HinfIA/C位点的基因多态性在胃癌的临床分期、转移方面比较,差异无统计学意义(P>0.05)。 综上所述,Fgβ-HinfIA/C位点的基因多态性与胃癌的发病存在相关性,Fgβ-HinfIA/C位点的C等位基因可能是胃癌的遗传危险因素。
3 讨论

