高致敏二次肾移植4例报告及文献复习
赵鹏,田军,崔先泉,张鲁伟,冯静静,徐倩倩(山东大学齐鲁医院肾移植科,山东 济南 250012)
随着新型免疫抑制药物的应用、肾移植手术技术进步、围术期处理不断完善,肾移植手术的成功率得到显著提高,移植肾的中、短存活率有了明显提高,但移植肾长期存活率并没有明显改善[1-2]。每年约有10%的受者移植肾功能丧失。移植肾失功后,可选择透析或再次移植,从患者存活率、生活质量等因素进行分析和比较,再次移植为最佳选择[3]。以往报道再次移植的移植肾存活率明显低于首次移植[4-5]。目前随着免疫监测、治疗手段的不断进步,二次移植肾存活率已越来越接近于首次移植[6-8]。但二次移植手术难度及风险较首次明显增加,尤其是高致敏〔群体反应性抗体(panel reactive antibody,PRA)>80%〕患者,手术失败概率非常高,往往被列为手术禁忌。本文回顾性分析近4年来山东大学齐鲁医院进行的高致敏二次肾移植4例成功经验及治疗体会,结合相关文献复习。
1 临床资料
本研究符合医学伦理学标准,得到医院伦理委员会审批(2018238)。
病例1:患者女性,37岁,2006年行亲属肾移植,2011年出现慢性排斥反应,恢复血液透析治疗,失功后有二次移植意愿,PRAⅠ类为 40%,Ⅱ类为 80%,继续服用小剂量免疫抑制剂,方案为他克莫司2 mg +麦考酚钠肠溶片360 mg +泼尼松5 mg/d(表1)。2014年9月有合适肾脏,来源为公民逝世后器官捐献(donation after citizen's death,DCD),人类白细胞抗原(human leukocyte antigen,HLA)配型中3个错配,淋巴细胞毒7%。术前脱敏治疗方案:术前行血浆置换1次,置换量为新鲜血浆3 000 ml;人免疫球蛋白30 g/d(0.5 g/kg),术中及术后连用3 d;术中及术后应用抗胸腺细胞球蛋白(antithymocyte globulin,ATG)50 mg/d进行免疫诱导治疗,连用3 d;术中同时应用利妥昔单抗(rituximab,RTX)500 mg(表2)。患者手术顺利,未发生超急性排斥反应及加速性排斥反应。术后第二天患者血肌酐恢复正常,达到84 μmol/L。术后患者继续应用他克莫司+麦考酚钠肠溶片+泼尼松方案,维持他克莫司谷浓度在10~15 ng/ml,麦考酚钠肠溶片每天1 080 mg。术后1年患者出现血肌酐渐进性增长,完善各项检查,并结合移植肾穿刺活检考虑为BK肾病,免疫抑制剂予以减量,麦考酚钠肠溶片540 mg/d,他克莫司谷浓度为3~5 ng/ml,治疗效果良好。目前随访患者血肌酐维持在200 μmol/L左右,肾小球滤过率(glomerular filtration rate,GFR)为 25 ml/min(表3)。
病例2:患者男性,24岁,2003年行尸体肾移植,2009年移植肾失功恢复血液透析治疗,失功原因为慢性移植物肾病。失功后长期血液透析治疗,并继续服用小剂量免疫抑制剂,环孢素100 mg +吗替麦考酚酯500 mg +泼尼松5 mg/d。PRAⅠ类为 50%,Ⅱ类为 54%(表1)。2015年7月有合适肾源,来源为DCD,HLA配型6个中2个错配,淋巴细胞毒10.5%。术前脱敏方案:血浆置换1次,置换量为新鲜血浆3 000 ml;人免疫球蛋白35 g/d(0.5 g/kg),术中及术后连用5 d;术中及术后应用ATG 50 mg/d进行免疫诱导治疗3 d;术中RTX 500 mg(表2)。手术过程顺利,术后第三天患者血肌酐即降为正常(97 μmol/L)。术后患者应用他克莫司+麦考酚钠肠溶片+泼尼松方案,维持他克莫司谷浓度在10~15 ng/ml,麦考酚钠肠溶片每日1 080 mg。术后1年患者因血糖升高将他克莫司更换为环孢素,目前多次随访患者血肌酐稳定于120 μmol/L左右,GFR为65 ml/min(表3)。
病例3:患者女性,47岁。2005年行尸体肾移植,2015年失功,失功原因为自行停药半年出现排斥反应。失功后长期血液透析治疗,在本院等待肾移植期间开始继续应用免疫抑制剂,他克莫司2 mg +麦考酚钠肠溶片360 mg +泼尼松5 mg/d。PRAⅠ类阴性,Ⅱ类为81%(表1)。2017年4月有合适肾源,来源为DCD,HLA配型中6个有3个错配,淋巴细胞毒8.0%。术前脱敏治疗方案:术前行血浆置换1次,置换量为新鲜血浆2 500 ml;人免疫球蛋白20 g/d(0.5 g/kg),术中及术后连用5 d;术中及术后应用ATG 50 mg/d进行免疫诱导治疗,连用3 d;术中同时应用RTX 200 mg(表2)。术后第二天继续服用免疫抑制剂,他克莫司+麦考酚钠肠溶片+泼尼松方案,维持他克莫司谷浓度为10~15 ng/ml,麦考酚钠肠溶片每天720 mg。术后患者出现移植肾延迟恢复,应用隔天床旁血液滤过治疗维持水电解质平衡,术后第十四天患者出现尿量明显增多,停止血液滤过治疗,术后第十八天患者血肌酐下降到正常,最低86 μmol/L,术后20 d患者出现肺部感染,包裹性胸腔积液,经积极治疗后肺部感染好转,仍有胸腔积液及胸膜炎,完善各项检查并请呼吸科会诊后确诊为结核性胸膜炎,至定点医院行抗结核治疗好转出院。目前多次随访患者肾功能正常,血肌酐稳定在70 μmol/L左右,GFR为85 ml/min(表3)。
病例4:患者男性,35岁,2011年行尸体肾移植,2016年因肺部感染在外院就诊,发现血肌酐升高至800 μmol/L以上,至本院就诊时血肌酐已升高至2 000 μmol/L以上,恢复血液透析治疗。等待肾移植期间继续应用免疫抑制剂,他克莫司2 mg +吗替麦考酚酯500 mg +泼尼松5 mg/d。PRAⅠ类为 75%,Ⅱ类为43%(表1)。2018年1月有合适肾源,来源DCD,HLA配型中6个有3个错配,淋巴细胞毒8.5%。术前脱敏治疗方案:术前行血浆置换1次,置换量为新鲜血浆3 000 ml;人免疫球蛋白35 g/d(0.5 g/kg),术中及术后连用5 d;术中及术后ATG 50 mg/d进行免疫诱导治疗,连用3 d;术中同时应用RTX 200 mg(表2)。手术顺利,术后第五天患者血肌酐即降为正常(119 μmol/L)。术后患者应用他克莫司+吗替麦考酚酯+泼尼松方案,维持他克莫司谷浓度在10~15 ng/ml,麦考酚钠肠溶片每天1 500 mg。目前多次随访患者血肌酐稳定于,GFR为64 ml/min(表3)。
3 讨 论
二次移植比首次移植更加复杂和困难,移植肾失功患者的身体状态和各项临床指标往往比一般尿毒症患者更差。在相同GFR下,移植肾失功患者的尿毒症并发症较一般慢性肾病肾衰竭患者发生更早。与慢性肾病肾衰竭患者比较,慢性移植肾失功患者贫血状况、酸中毒程度、中大分子尿毒症毒素蓄积及心脑血管并发症发生率均显著增加[9]。移植肾失功患者重新接受透析治疗的最初几个月内,并发症发生率和病死率均较高,失功能的移植肾引起的持续存在的慢性炎症反应,和长期免疫抑制药物的应用可能是重要原因[10]。即使经过一段时间的透析治疗,将患者的各项临床指标维持到一定范围内进行二次肾移植,一旦发生移植肾延迟恢复、急性排斥反应等,特别容易并发心、脑血管意外和感染,病死率高[11]。
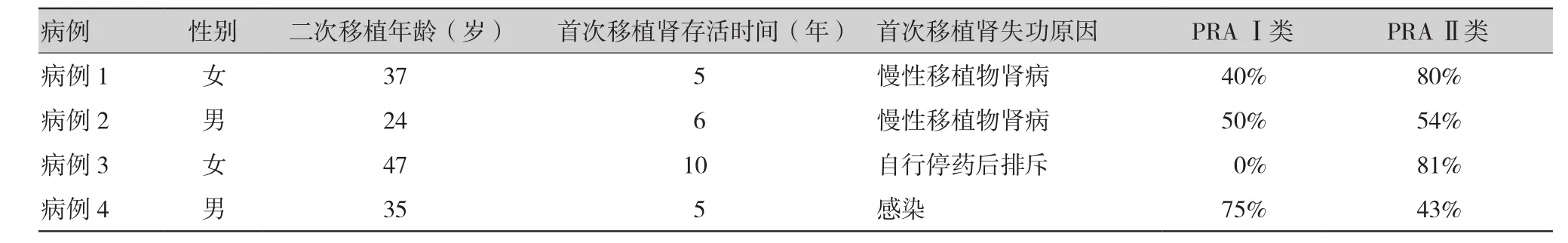
表1 4例二次移植患者术前一般资料

表2 4例二次移植患者手术相关资料

表3 4例二次移植患者预后资料
Ayus等[12]通过研究认为移植肾失功能患者,较普通慢性肾病肾衰竭的患者,有更高的病死率,对移植肾失功恢复长期透析患者,如果能成功实施移植肾切除,有助于提高生存率及生活质量。而移植肾切除并发症率可达4.3%~82.1%[13-14]。出血和感染是最常见的并发症,还有伤口皮下血肿、腹膜损伤、淋巴瘘、尿瘘、髂血管损伤、闭孔神经损伤、肠管损伤、癫痫、抑郁等,部分患者术后可出现心理异常[13-14]。国外统计围术期死亡率高达0.7%~38%[15-18]。理论上切除移植肾可去除外来抗原,有利于防止患者致敏,可以为再次肾移植做好准备。故有人提出对等待再次移植的致敏患者应切除移植肾[19]。但 Khakhar等[20]通过对 91例失功移植肾切除患者PRA半年的动态观察显示,术前PRA正常以及轻度升高(<20%)者术后反而明显升高,PRA为21%~79%者,术后PRA水平无明显下降,而PRA>80%者术后PRA稍有下降,但下降幅度无临床实际意义。Sumrani等[21]发现75%的失功移植肾切除组患者再次移植前PRA>30%,而保留移植肾组仅为33%。再次移植后肾功能延期恢复(delayed graft function,DGF)切除组为63%,保留组为30%,两者有明显统计学差异。Shidban等[22]也发现失功移植肾切除易导致患者致敏,且再次移植后急性排斥反应和DGF的发生率高,移植肾存活率低。对晚期移植肾失功者行移植肾切除,其二次移植肾衰竭风险提高。这提示失功移植肾保留,给二次移植肾存活带来一定益处。所以现在大部分移植中心都倾向于保留失功移植肾,在患者对侧髂窝行二次肾移植手术。
另一方面,移植肾失功患者体内免疫状态较普通尿毒症患者更加复杂,对于再次移植的患者,特别是首次因免疫因素导致移植肾失功的患者,其机体往往处于免疫高敏状态,发生排斥反应的风险也高。Agroudy等[23]报道首次移植致敏率为10%,二次移植致敏率为35%。Reisaeter等[24]报道初次肾移植高敏患者为4%,而再次移植高敏患者可高达24%。对于再次肾移植更应选择配型良好、术前评估良好的供肾。良好的HLA配型可降低高致敏患者肾移植术后急性排斥反应的发生、有利于肾功能的早期恢复和提高移植肾的存活率。Thompson等[25]认为理想的HLA配型,尤其DR位点无错配可使存活率提高10%~30%,对二次移植优先考虑DR位点,其次B位点、A位点,但一定避开对应PRA的HLA位点。因为HLA 抗体可以导致针对移植物的免疫应答而发生超急排和加速性排斥反应 ,使移植失败或降低移植物存活率。
高致敏患者往往携带数量较多的抗HLA抗体,选择全部避开来寻找合适供体几乎不可能[26]。所幸并非所有特异性抗HLA抗体都必须避开,只需避开主要抗体即可,因为其中部分抗体是由交叉反应所致,属于低滴度、低亲和力抗体,可以通过血浆置换、静脉注射人免疫球蛋白(intravenous immunoglobulin,IVIG)等方法清除[27-28]。
血浆置换既可以清除体内多种抗体及免疫复合物来调整体液免疫反应,又能通过清除肿瘤坏死因子、白细胞介素-2等来调节细胞免疫反应,从而达到控制排斥反应的目的[29]。IVIG也具有较强的免疫调节作用,可以通过Fc受体介导的相互作用阻断T细胞的活化和抗体产生、降低抗 HLA 抗体水平、抑制细胞因子编码基因的活化、抑制补体活化等[30-31]。血浆置换非选择性地清除血浆蛋白,可能会减低患者抵抗力,增加感染概率,IVIG不但可以抑制HLA抗体再生,防止HLA抗体水平反跳,又能增强患者的抗感染能力,两者具有互补作用。
在血浆置换和IVIG的基础上,联合RTX或者硼替佐米均有报道,目前本中心倾向于使用RTX,因为RTX在肾移植领域应用实践较多,疗效确切,还可以有效预防HLA错配移植后新生DSA和急性排斥反应的发生。RTX可以靶向性地与B淋巴细胞结合并有效地清除B淋巴细胞,还可以诱导B淋巴细胞凋亡[32-33]。最初应用于自身免疫疾病和非霍奇金淋巴瘤等。Fuchinoue等[34]从2002年起开始将RTX应用于ABO血型不相合的肾移植,取得了意想不到的的良好效果。研究证实,联合应用IVIG和RTX能有效减少高致敏患者的抗HLA抗体,提高移植肾的存活率[31]。对于RTX的应用剂量,Takagi等[35]报道在ABO血型不合移植的脱敏治疗方案中,单剂150 mg/m2的RTX和单剂375 mg/m2的RTX的效果没有差别。Fuchinoue等[34]比较了应用RTX单剂100、200和500 mg的3组患者,发现他们移植肾5年存活率基本一致。目前我中心由原来单剂500 mg减为应用单剂200 mg RTX,发现疗效较好,减轻了受者的经济负担。
多次的血浆置换+ IVIG + RTX脱敏治疗疗效确切,可以增加高致敏患者配型成功的比率,并降低了术中术后的排斥风险,但患者在治疗4~6周后如果仍然未能等到合适的供肾,将被迫中止该方案,并需要给予大剂量IVIG以预防抗体水平反跳[27]。所以多用于可控的亲属肾移植。但大部分移植肾失功患者并没有亲属肾移植的机会。对于高致敏移植肾失功患者,等待供肾时间普遍较长,目前尸体供肾器官来源均为DCD,不确定性较强,遇到可以避开大部分阳性位点的供肾,对于那些弱阳性及目前技术条件还未检测出的抗体,本中心应用术前单次血浆置换+术中术后多次IVIG +单剂RTX脱敏,配合ATG诱导,4例高致敏二次移植均取得了成功,并且等待时间有缩短趋势。但毕竟病例数较少,随访时间不够长,仍需要进一步摸索和学习。

