LPS通过TLR4/MyD88/NF-κB途径促进人肝癌细胞增殖及转移能力
刘亚萍,董蕾,史海涛,李雅睿,麻婧,殷燕,任牡丹,和水祥
原发性肝癌是消化系统常见的恶性肿瘤之一,外科手术仍是其有效的治疗手段,但其恶性程度高、转移能力强,大多数肝癌一旦发现已发生远处转移,失去外科手术机会,而目前临床上肝癌的其他治疗手段有限[1]。因此,近年来针对肝癌生长及转移机制的研究备受关注,已成为目前肝癌研究的热点问题。
肝炎-肝纤维化-肝癌已被公认为肝癌发生的三步骤[2]。在此过程中,肝脏处于慢性炎症长期刺激状态下,逐渐发展为肝纤维化、肝硬化,甚至肝癌,慢性炎症在此过程中发挥重要作用,而内毒素是慢性炎症的主要成分,同时肝脏是人体最大的解毒器官,肝功能长期受损导致肝脏过滤肠道细菌的作用减弱,细菌的代谢产物内毒素可通过门脉进入肝脏[3]。我们课题组前期研究表明,内毒素的主要成分LPS体外作用于肝星状细胞,会加快肝星状细胞的活化,并促进IL-6等炎因子产生,提示LPS可促进肝纤维化进展[4]。那么,长期内毒素的作用会导致肝细胞癌变吗?在内毒素的作用下,肝癌细胞增殖及转移能力会发生什么样的变化?本研究拟通过研究LPS对HepG2增殖、粘附、侵袭及迁移能力的影响,并阐明相关机制,为肝癌治疗提供新靶点。
1 材料与方法
1.1 材料
HepG2 (上海细胞生物研究所); RPMI1640 (美国Hyclone);胎牛血清FBS(杭州四季青生物材料有限公司);Transwell小室、96孔板及24孔板、6孔板(美国Coning);LPS、MTT、DMSO(美国Sigma);Matrigel基质胶(美国BD公司); Western blot用β-Actin、TLR4、MyD88、NF-κB 一抗及二抗体(美国Bioworld Technology);RNA提取试剂盒fastgen200(上海飞捷生物技术有限公司);逆转录试剂盒(美国Fermentas);β-Actin、TLR4、MyD88、NF-κB基因引物设计及合成(北京奥科生物技术有限公司)。
1.2 细胞培养
RPMI1640(含10%FBS)培养HepG2, 37 ℃、5% CO2饱和湿度培养2~3 d, 0.25%胰酶消化并传代。
1.3 细胞增殖实验
调整细胞密度为5×104/mL,96孔板每孔100 μl,每组平行设6个复孔,于37 ℃、5% CO2饱和湿度的孵箱中培养,待细胞贴壁后用不同浓度LPS (10、100、1 000 ng/mL)刺激细胞,于24、48、72 h分别进行MTT法分析,测量各孔的吸光度值(OD490),OD490nm值越大表示细胞增殖能力越强。
1.4 细胞粘附实验
冷RPMI1640培养液(不含血清)稀释Matrigel基质胶,稀释比例为5∶1,稀释后包被96孔板,每孔100 μL,室温干燥过夜,100 ng/mL LPS干预细胞48 h,细胞密度调整至1×105/mL, 每孔加入100 μL加入包被的96孔板,对照组用无血清的RPMI1640培养液,每组平行设6个复孔, 37 ℃孵育4 h,PBS冲洗2遍,MTT法分析。
1.5 细胞侵袭、迁移实验
Matrigel基质胶采用冷RPMI1640培养液稀释,比例为5∶1, 24孔板中放置Transwell小室,于上室中加入100 μL稀释胶,室温干燥过夜。LPS 100 ng/mL干预对数生长期的细胞48 h,细胞密度调整至3×105/mL,取100 μL加入上室,600 μL含20% FBS的RPMI1640作为趋化液加入下室,每组平行设3个小室。37 ℃孵育48 h,结晶紫染色,每个小室取5个视野(上、中、下、左、右)照相并计数。
1.6 细胞迁移实验
Transwell小室不铺胶,余同侵袭实验。
1.7 Western blot检测蛋白表达
对数生长期的细胞用浓度为100 ng/mL LPS干预48 h,裂解液将细胞裂解,提取各组的细胞总蛋白,采用8%聚丙稀酰胺凝胶电泳,将蛋白电转移至硝酸纤维膜上,5%脱脂奶粉封闭,后分别与β-actin(内参)、TLR4、MyD88及NF-κB鼠抗人多克隆抗体结合,再与辣根过氧化物酶山羊抗鼠二抗反应,最后进行化学发光法检测,Gel-pro软件分析各条带的灰度值。
1.8 RT-PCR检测mRNA表达
1.8.1 RNA的提取及cDNA的合成 100 ng/mL的LPS干预细胞48 h,RNA提取试剂盒提取细胞总RNA。按试剂说明进行cDNA合成。
1.8.2 引物设计及合成 以NCBI GenBank中提供的人类基因序列设计并合成引物,β-Actin、TLR4、MyD88及NF-κB基因引物序列见表1。

表1 RT-PCR所用基因引物序列及产物长度
1.8.3 PCR反应体系 前引物1 μL,后引物1 μL,Premix Taq 9.5 μL,模板cDNA 1 μL, ddH2O 12.5 μL,总体积25 μL。反应条件:预变性94 ℃ 5 min、变性94 ℃ 30 s、退火55 ℃ 30 s、延伸72 ℃ 30 s,35个循环,延伸72 ℃ 5 min。
1.8.4 电泳结果及分析 PCR产物于2%琼脂糖凝胶电泳进行检测,凝胶电泳图像系统分析灰度值并进行统计学分析。
以上所有实验均重复至少3次。
1.9 统计学方法
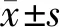
2 结果
2.1 细胞增殖能力
经析因方差分析可知不同浓度LPS干预HepG2,在不同时间点测OD490nm值均明显高于对照组(均有P<0.05),同一时间各浓度组间OD490nm值比较亦有统计学差异(均有P<0.05),且随着浓度和时间增加OD490nm值渐增高,提示LPS促进HepG2增殖能力,且存在浓度和时间依赖,见图1。
2.2 细胞粘附能力
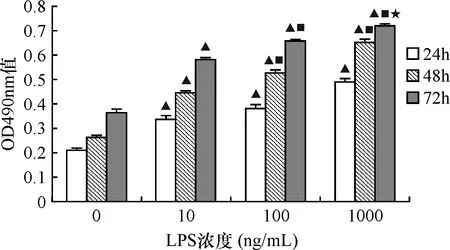
MTT法检测OD490nm值LPS干预组明显高于对照组(0.49±0.15vs. 0.36±0.03),差异有统计学意义(t=7.63,P=0.004),其粘附增加率为(47.08±0.15)%,见图2。
同一时间各浓度组相比,与对照比较,▲P<0.05;与10 ng/mL LPS组相比,■P<0.05;与100 ng/mL LPS组相比,★P<0.05
图1 增殖能力比较
与对照比较,▲P<0.01
2.3 细胞侵袭能力
LPS干预组细胞通过侵袭穿膜数为(342.72±5.03)个/视野,明显多于对照组的(112.67±3.21)个/视野,差异有统计学意义(t=34.59,P=4.17e-006);侵袭增加率为(206.17±4.94)%,见图3。
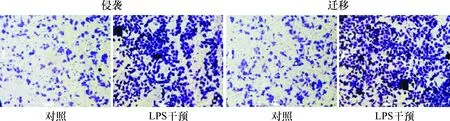
图3 侵袭及迁移能力比较 (结晶紫染色,×100)
2.4 细胞迁移能力
LPS干预组细胞迁移穿膜数量为(485.39±7.16)个/视野,明显多于对照组的(168.38±6.22)个/视野,差异有统计学意义(t=25.79,P=1.34e-005);迁移增加率为(325.05±11.81)%,见图3。
2.5 TLR4、MyD88及NF-κB蛋白表达
LPS作用后,TLR4、MyD88及NF-κB蛋白均有表达;且TLR4、MyD88及NF-κB的蛋白表达明显高于对照组(其中TLR4t=3.47,P=0.03;、MyD88t=11.86,P=0.0003;NF-κBt=7.58,P=0.002),见图4。
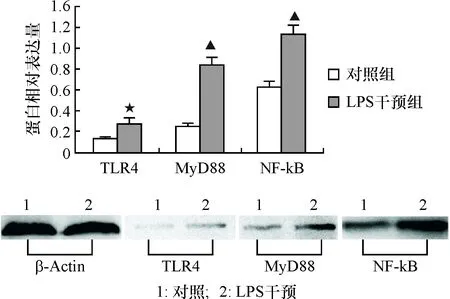
与阴性对照比较,★P<0.05,▲P<0.01
2.6 TLR4、MyD88及NF-κB mRNA表达
LPS干预后,TLR4、MyD88及NF-κB的mRNA均有表达;且TLR4、MyD88及NF-κB的mRNA表达明显高于对照组(其中TLR4t=-2.83,P=0.04;MyD88t=8.81,P=0.0009及NF-κBt=10.76,P=0.0004),见图5。
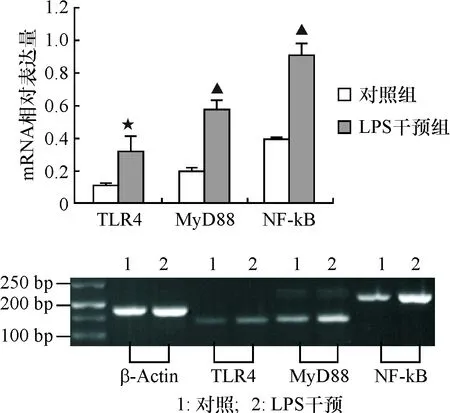
与阴性对照比较,★P<0.05,▲P<0.01
3 讨论
慢性炎症与癌症关系密切,慢性炎症通过多种机制诱导细胞癌变,而癌细胞的生长又不断刺激炎症反应,形成适合癌细胞生长及转移的环境,在整个癌症进展过程中二者呈现“滚雪球”式的发展[5]。内毒素是慢性炎症的重要代谢产物,在癌症进展过程中发挥着重要作用。韩殿冰等[6]研究发现,在诱导肝癌的过程中,普通小鼠比无菌小鼠更容易患肝癌,无菌小鼠注射内毒素后,肝癌的发生率接近于普通小鼠,而普通小鼠注射抗内毒素抗体后,其肝癌发生率明显下降,由此可见,内毒素可促进多种肿瘤发生、发展。作为内毒素的主要成分LPS,在慢性炎症促进癌细胞生长、转移的过程中,可以通过多种途径促进各种癌细胞增殖、转移。Liu等[7]通过LPS对胰腺癌细胞AsPC-1作用表明LPS可通过TLR4/MyD88信号通路增加胰腺癌细胞的转移能力;Zhu等[8]研究表明,LPS通过上调VEGF-3促进结肠癌侵袭、转移。 基于此,本研究通过LPS刺激肝癌细胞HepG2,旨在探讨LPS对肝癌细胞增殖、粘附、侵袭、迁移过程的影响,并进一步检测信号通路TLR4-MyD88-NF-κB中各分子的蛋白及mRNA的表达,从而推测慢性炎症与肝癌的关系。
癌细胞增殖及转移能力预示着肿瘤的预后。随着肿瘤不断生长,肿瘤内促癌细胞粘附因子分泌减少,致使癌细胞间粘附力下降,而分泌癌细胞与细胞外基质粘附因子增加,使得癌细胞更易粘附于细胞外基质,这就导致癌细胞开始迁移,同时在细胞外水解酶降解下,癌细胞穿透血管壁进入血液或淋巴管,到达靶器官后在细胞外水解酶辅助下再次穿出血管,形成微小癌细胞转移灶,引起肿瘤远处转移[9]。由此可见,肿瘤细胞增殖、粘附、侵袭、迁移能力是肿瘤生长及转移的必要条件。本研究采用MTT检测癌细胞增殖能力,细胞外基质以Matrigel基质胶代替,通过基质胶粘附癌细胞的数量反映细胞粘附能力,通过观察细胞穿透小室中Matrigel基质胶的数量分析癌细胞侵袭脉管的能力,通过癌细胞穿过小室数量衡量细胞迁移能力,从而阐明肝癌细胞的增殖及转移能力。
TLR4是一种跨膜蛋白,在机体天然免疫识别中发挥重要作用,LPS是其特异配体。早期研究表明,TLR4 介导的 MyD88 信号通路主要参与机体组织损伤、炎症反应[10]。在肝脏中,TLR4高表达于肝细胞、枯否细胞、肝星状细胞(HSC)等多种细胞表面,当肝细胞受理化因素、病毒感染、乙醇、高脂饮食、药物等多种因素的作用下,激活TLR4-MyD88信号转导,通过上调炎症因子、趋化因子及炎性介质表达,最终促使NF-κB 发生核转移,启动转录基因释放更多的炎症因子,从而导致肝炎的发生、发展。在上述炎症发展过程中,HSC的活化加速细胞外基质沉积,最终导致肝纤维化、肝硬化[11-13]。我们课题组前期研究表明,LPS刺激静止状态的HSC活化,并通过分泌TGF-β 等重要纤维化因子促使活化的HSC分化为肌成纤维细胞并产生大量 ECM 累积在肝组织中,最终形成肝纤维化,而这一过程与TLR4-MyD88-NF-κB信号通路密切相关[4, 14]。Liu 等[15]发现薯蓣皂苷通过抑制 TLR4-MyD88-NF-κB 信号途径可抑制 HSC 的激活并减少 ECM 的堆积,从而降低肝纤维化。近年研究发现,TLR4相关信号通路参胰腺癌[7,16]、结肠癌[17]、宫颈癌[18]、乳腺癌[19]等多种癌症的发生、发展。在肝脏受损过程中,TLR4 信号途径参与了肝炎-肝纤维化-肝癌进展的模式全过程,是连接慢性炎症与癌症的主要途径[20]。本研究中LPS刺激HepG2后,细胞内TLR4、MyD88及细胞核内NF-κB的蛋白及mRNA表达明显升高,由此可推测,LPS促进肝癌细胞增殖、转移过程可能TLR4-MyD88-NF-κB信号通路有关。
本实验结果表明LPS可提高HepG2增殖能力,且存在剂量和时间效应;同时通过LPS作用于HepG2,其粘附、侵袭和迁移能力均显著增强,这种作用可能与上调TLR4、MyD88及NF-κB蛋白及mRNA表达水平有关。以上实验结果提示LPS与肝癌的增殖和转移能力密切相关,TLR4-MyD88-NF-κB信号通路参与这一过程,其可能成为肝癌发病机制和治疗研究中的一个重要靶点。

