冰片对脂多糖诱导的RAW264.7巨噬细胞炎症模型的影响
孙淑萍,杜云艳,锁孝国,王 洋,张家豪,吴晨光,张梦圆
炎症是机体或细胞受到损伤、感染或者暴露于有害物质(如LPS)时所产生的一种复杂的生理防御过程[1-2].其主要表现为局部组织的变性、渗出和增生[2].现代科学研究表明,炎症与心脏病、某些形式的癌症、糖尿病以及骨关节炎等密切相关[3].当机体受到外界因素刺激后,活化的巨噬细胞能够分泌多种细胞因子和趋化因子如NO等,引起机体固有免疫反应.
在炎症反应过程中,巨噬细胞在启动、维护和解决炎症反应方面起着重要的作用[4].脂多糖(LPS)是革兰氏阴性菌细胞壁的主要成分之一,具有强大的免疫刺激能力[5].RAW264.7巨噬细胞作为一种鼠源性免疫细胞,在受到外界因素(如LPS)刺激时会被激活,分泌众多炎症因子(如NO等),产生炎症反应.此外,LPS作用于巨噬细胞可激活下游NF-κB和MAPKs炎性信号通路,产生炎症因子[6].炎症因子的多少可间接地反映出炎症的严重程度,是炎症轻重的量化指标.
冰片(Borneol)是常用中药材,有悠久的药用历史.唐代《新修本草》记载:冰片具有清热止痛、散郁火、生肌的功效.现代药理学研究表明,冰片具有抗细菌、真菌,消炎镇痛等作用[7].笔者通过查阅目前国内外对冰片的研究发现,科研人员对冰片的研究主要集中在其化学成分及其提取工艺的分析和毒性及其机制的探讨[8-9],只见少数文献报道冰片的抗炎作用,如孙晓萍[10]等研究表明,冰片对角叉菜胶致大鼠足肿胀、冰醋酸致小鼠腹腔毛细血管通透性增加均有明显的抑制作用,但体外抗炎活性及其作用机制尚未见报道.
本实验选用LPS诱导的RAW264.7巨噬细胞作为体外炎症模型[11],考察了冰片对炎症因子NO及ROS含量的影响,对抗炎分子机制是否与NF-κB、MAPKs及Nrf2炎性信号通路有关进行讨论,为冰片更合理应用提供了数据支持,现报道如下.
1 实验材料与仪器
1.1 实验细胞
RAW264.7小鼠腹腔巨噬细胞株由皖南医学院生物化学教研室戚之琳教授惠赠.
1.2 主要实验材料
冰片(批号:180311,含量99%,吉安市林科天然冰片厂);醋酸地塞米松片(批号:160929,浙江仙琚制药股份有限公司);LPS冻干粉(Solarbio);一氧化氮(NO)一步法试剂盒(南京建成生物工程研究所);CCK-8法细胞增值检测试剂盒(江苏凯基生物技术股份有限公司);ERK1/2 Rabbit Monoclonal Antibody、Phospho-Erk1/Erk2 Rabbit Monoclonal Antibody、JNK Rabbit Monoclonal Antibody、Phospho-JNK Rabbit Monoclonal Antibody、 p38 RabbitMonoclonalAntibody、DCFH-DA活性氧检测试剂盒(上海碧云天生物技术有限公司);Phospho-NF kappa B p65 Antibody、Phospho-p38 MAPKs Antibody(Affinity);p65 RELA Rabbit Polyclonal Antibody、Nrf2 Rabbit Polyclonal Antibody、β-Tublin Mouse Monoclonal Antibody(Proteintech);Mouse Anti-β-actin、Goat Anti-Mouse IgG、Rabbit Anti-HO-1/HMOX-1、Goat Anti-Rabbit IgG(武汉博士德生物工程有限公司)等.
1.3 主要实验仪器
二氧化碳培养箱(GOLD-SIM);生物安全柜(ESCO);IX-51荧光倒置显微镜(OLYMPUS);垂直电泳仪(北京君意东方电泳设备有限公司);Amersham Imager600超灵敏多功能成像仪(General Electric Company);手提式压力蒸汽灭菌器(上海申安医疗器械厂);高速冷冻离心机(安徽嘉文仪器装备有限公司);全波长酶标分析仪(赛默飞世尔科技有限公司).
2 实验方法
2.1 溶液的配制
2.1.1 冰片的配制
精密称取10mg冰片置于1.5mL EP管内,加入4μL DMSO溶解,移至含有1mL PBS的15mL离心管中,反复吹打,再加入1mL PBS,反复吹打,依次递增,重复上述步骤,最后补足至10mL,配成浓度为1mg/mL母液,用0.22μm无菌滤头过滤,分装,-20℃保存备用.
2.1.2 LPS母液的配制
精密称取1mg LPS冻干粉,加1mL完全培养基溶解,配成浓度为1mg/mL母液,用0.22μm无菌滤头过滤,分装,-20℃保存备用.
2.1.3 Dex母液的配制
将醋酸地塞米松片充分研磨成细粉,过100目药筛.精密称取醋酸地塞米松细粉0.2826g(原料药0.26g),加10mL完全培养基溶解,配成26mg/mL母液,用0.22μm无菌滤头过滤,分装,-20℃保存备用.
2.2 RAW264.7小鼠腹腔巨噬细胞的培养
RAW264.7使用含10%FBS的DMEM培养基,置于37℃、5%CO2培养箱中培养,2d传代1次,传代比例为1∶7,传代次数不超过15代.使用时,将细胞刮下,加入培养基重悬,计数后,加入培养板各孔中.
2.3 CCK-8法检测细胞活力
2.3.1 不同浓度冰片溶液对细胞活力的影响
RAW264.7细胞以1×105个/孔种于96孔板,每孔体积100μL,培养2h,弃去上清液,药物组每孔分别加入0.03μg/mL、0.3μg/mL、3μg/mL、30μg/mL、300μg/mL、600μg/mL冰片溶液各100μL;对照组弃去培养基,加入100μL完全培养基;空白组加入100μL完全培养基后不做处理;每个样平行6份.外周一圈每孔加入100μL PBS缓冲液,继续培养24h.药物组和对照组每孔加入10μL CCK-8溶液,于细胞培养箱中继续培养2h,用酶标仪在450nm波长下(参比波长:600nm)测定OD值,计算各药物浓度下的细胞存活率,统计并定量分析.选择其中安全的药物浓度范围,进一步摸索并确定合适的低、中、高剂量下的药物浓度,进行后续实验.其中,细胞存活率(%)=(药物组OD值-空白组OD值)(/对照组OD值-空白组OD值)×100%.
2.3.2 不同浓度LPS溶液对细胞活力的影响
除每孔加入 0.5μg/mL、1μg/mL、1.5μg/mL、2μg/mL LPS溶液各100μL外,其余和2.3.1项下相同.
2.4 实验分组及给药
实验设立空白(KB)组、模型(MX)组、醋酸地塞米松阳性对照(Dex,YX)组、冰片低、中、高剂量组.取对数生长期的细胞按1∶9的比例稀释接种于6孔板中,各组先加1mL含有细胞的培养液,贴壁生长2h.待细胞贴壁后将药物组、醋酸地塞米松阳性对照组的培养基吸出(空白组、模型组不做处理),分别加入配好的各浓度药液1mL,继续培养30min.30min后空白组加1mL完全培养基;MX组、YX组与药物组各加入2.4μg/mL LPS溶液1mL,使LPS终浓度为1.2μg/mL.
2.5 细胞形态观察
细胞用药24h后,从培养箱中取出6孔板,用OLYMPUS倒置显微镜观察细胞形态并拍摄照片(×200).
2.6 一步法测定细胞培养上清液中炎症因子NO含量
收集细胞培养上清液,4℃,3000rpm,离心10min,按照试剂盒说明书测定NO含量.
2.7 Western blot法检测各组细胞MAPKs通路蛋白的表达变化
取6孔细胞板中处理后的RAW264.7细胞,PBS洗涤后,加入细胞裂解液(RIPA∶PMSF∶广谱磷酸酶抑制剂=100∶1∶1),至4℃冰箱裂解一段时间后取出,将细胞刮下,离心,取上清液加入5×上样缓冲液,再于沸水中煮沸变性,经BCA法检测蛋白浓度后.用聚丙烯酰胺凝胶(SDS-PAGE)电泳后转至NC膜上,丽春红染液染色,根据蛋白分子量与marker剪出所需蛋白的NC膜,TBST洗净.用5%的脱脂牛奶封闭.用TBST洗净,孵育Nrf2、p65、p-p65、ERK、p-ERK、p38、p-p38、JNK、p-JNK、β-actin一抗,4℃孵育过夜,TBST清洗,分别加入相应的二抗:HRP标记的羊抗鼠IgG(1∶6000)和HRP标记的羊抗兔IgG(1∶8000),室温孵育1h,TBST洗净,滴加现配的ECL显影液(A液∶B液=1∶1)曝光显影.用Image J软件对条带进行灰度分析制作柱状图,目的蛋白表达量=目的蛋白的灰度值/内参蛋白的灰度值.
2.8 DCFH-DA荧光探针检测ROS含量变化
实验分组及用药同操作2.4.用无血清培养液按1∶200稀释DCFH-DA,使其终浓度为50μmol/L,去除细胞培养液,按1mL/孔的量加入稀释好的DCFH-DA,培养箱37℃孵育1h.用无血清细胞培养液洗涤细胞,以充分去除未进入细胞内的DCFH-DA.再加入1mL PBS,使用488nm激发波长,525nm发射波长,倒置荧光显微镜下观察荧光强弱,拍照,用Image J软件统计平均光密度值并定量分析.
2.9 统计学分析
用SPSS17.0进行数据处理,结果用±s表示,多个样本均数间的比较采用单因素方差分析,p<0.05表示差异具有显著统计学意义,p<0.01表示差异具有极显著统计学意义.
3 实验结果
3.1 不同浓度冰片对RAW264.7细胞活力的影响
冰片在0.03~600μg/mL浓度范围内时,RAW264.7细胞存活率高,倒置显微镜观察也可见细胞形态完整,表明细胞未受到明显损伤作用.因此,0.03~600μg/mL为安全药物浓度区间,同时笔者进一步优化了药物浓度,最终选择1.5μg/mL、15μg/mL、150μg/mL分别作为低、中、高剂量组的药物浓度进行后续的实验,详情如图1所示.
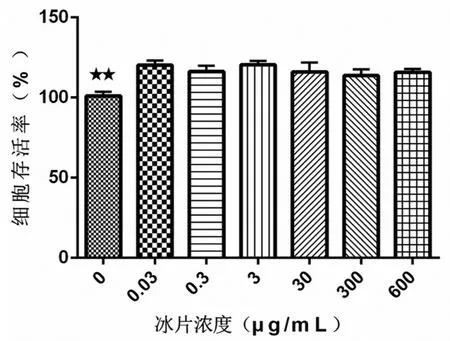
图1 不同浓度冰片对细胞活力的影响
3.2 不同浓度LPS对RAW264.7细胞活力的影响
本研究中,在将不同浓度(0.5μg/mL、1μg/mL、1.5μg/mL、2μg/mL)LPS分别作用细胞 24h后,CCK-8法检测各组细胞活力结果显示如图2,LPS浓度为1.5μg/mL时,细胞存活率明显下降(p<0.05),而LPS浓度为2μg/mL时,细胞存活率极显著性下降(p<0.01).因此,可推断出,LPS浓度<1.5μg/mL为安全浓度区间,后期进一步优化,选择1.2μg/mL作为刺激巨噬细胞的浓度.
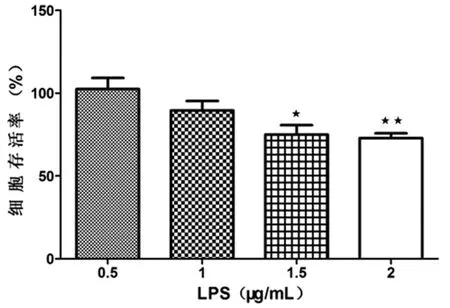
图2 不同浓度LPS对细胞活力的影响
3.2 各组细胞的基本形态
KB组大部分细胞形态正常、似球形,有少数细胞发生变形出现小角;MX组细胞在LPS的刺激下形态发生显著改变,大部分细胞有较长的触角形成且形状不规则,有部分细胞出现空泡现象,说明造模成功;YX组细胞大部分呈圆形,少数有小角出现,细胞形态较MX组有极大改善;1.5μg/mL组细胞形态较MX组有稍微改善,仍有许多细胞出现了变形,但较MX组正常圆形细胞居多且角较小;15μg/mL组细胞形态比MX组和1.5μg/mL组较规则,细胞变形数量与细胞空泡减少;150μg/mL组细胞形态接近于正常情况,有少许的细胞空泡,细胞变形数目大为减少.结果显示,冰片对LPS引起的RAW264.7细胞炎症具有抗炎活性,且成剂量依赖性,抗炎活性大小为:150μg/mL>15μg/mL>1.5μg/mL,见图3.
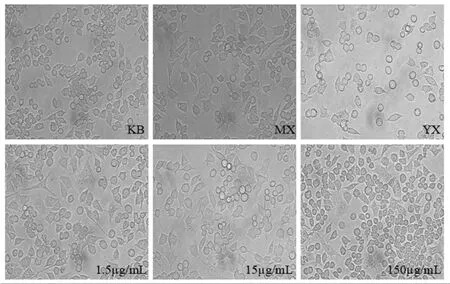
图3 各组细胞形态图(×200)
3.3 细胞培养上清液中炎症因子NO的含量变化
与KB组比较,MX组NO水平极显著性升高(p<0.01),说明LPS刺激RAW264.7细胞造模成功.与MX组比较,YX组、冰片低、中、高剂量组均能极显著性降低上清液中NO水平,说明均有抗炎效果.与1.5μg/mL组比较,15μg/mL、150μg/mL剂量下,NO水平均极显著性降低(p<0.01),且150μg/mL浓度下NO水平降低幅度更大.综上可知,冰片能剂量依赖性地降低细胞培养上清液中NO水平,见表1.
表1 各组NO含量变化(±s,n=6)
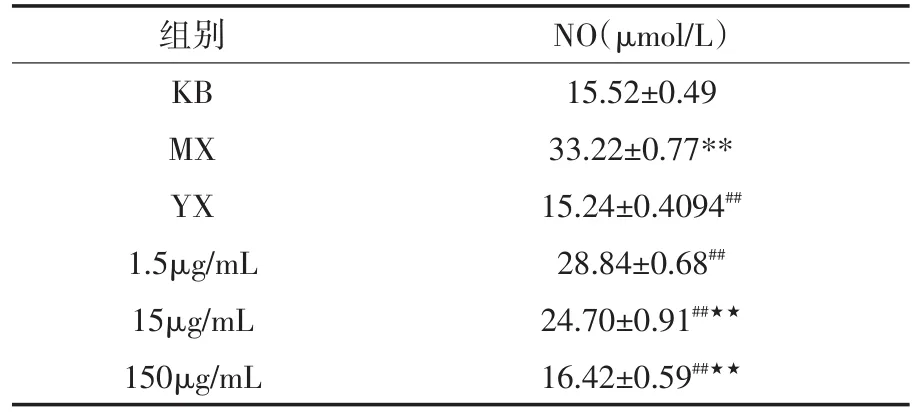
表1 各组NO含量变化(±s,n=6)
注:与KB组比较,*p<0.05,**p<0.01;与MX组比较,#p<0.05,##p<0.01;与1.5μg/mL组比较,★p<0.05,★★p<0.01.
组别NO(μmol/L)KB15.52±0.49 MX33.22±0.77**YX15.24±0.4094##1.5μg/mL28.84±0.68##15μg/mL24.70±0.91##★★150μg/mL16.42±0.59##★★
3.4 MAPKs通路、Nrf2通路及NF-κB通路相关蛋白表达水平
3.4.1 MAPKs通路p-p38/p38、p-ERK/ERK、p-JNK/JNK磷酸化水平变化
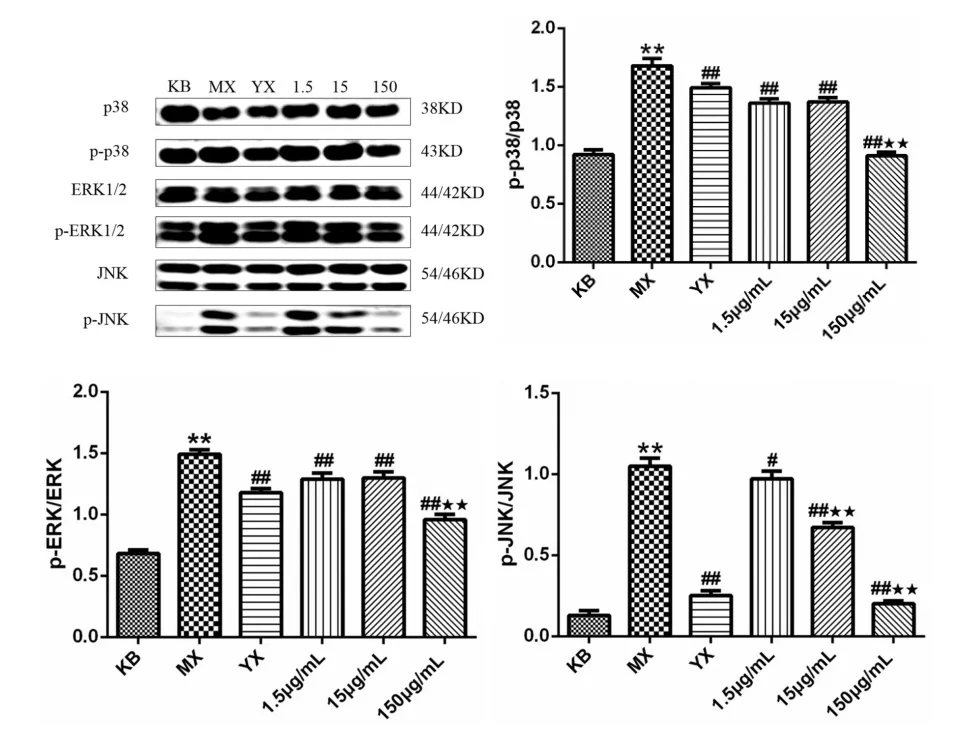
图4 p-p38/p38、p-ERK/ERK、p-JNK/JNK磷酸化水平变化情况
Western blot结果显示(图4),与KB组比较,MX组经LPS刺激后,p-p38、p-ERK和p-JNK磷酸化水平均极显著性升高(p<0.01),表明细胞炎症模型构建成功.而分别使用阳性药Dex和低、中、高浓度的冰片作用炎症细胞后,p-p38、p-ERK和p-JNK磷酸化水平均出现不同程度地下降,表明冰片发挥了抗炎作用.其中,与MX组比较,YX组的p-p38、p-ERK和p-JNK磷酸化水平均显著性下降(p<0.05,p<0.05,p<0.01);而150μg/mL剂量下,p-p38、p-ERK和p-JNK磷酸化水平均极显著性下降(p<0.01);1.5μg/mL和15μg/mL的冰片部分组虽然没有显著性,但仍然可以看出均能抑制p-p38、p-ERK和p-JNK磷酸化水平.综上表明,冰片可有效地抑制MAPKs通路的活化,进而发挥细胞抗炎活性.
3.4.2 Nrf2通路中Nrf2蛋白含量变化
Western blot结果显示(图5),与KB组比较,MX组Nrf2蛋白含量呈现应激性的升高,且具有极显著性差异(p<0.01),而分别使用阳性药Dex和低、中、高浓度的冰片作用细胞后,Nrf2蛋白含量出现不同程度地升高,表明冰片发挥了抗炎作用.与MX组比较,150μg/mL剂量下,Nrf2含量显著性升高(p<0.05),而1.5μg/mL和15μg/mL组的含量升高不明显(p>0.05).综上表明,冰片可剂量依赖性地激活Nrf2通路,进而发挥细胞的抗炎活性.
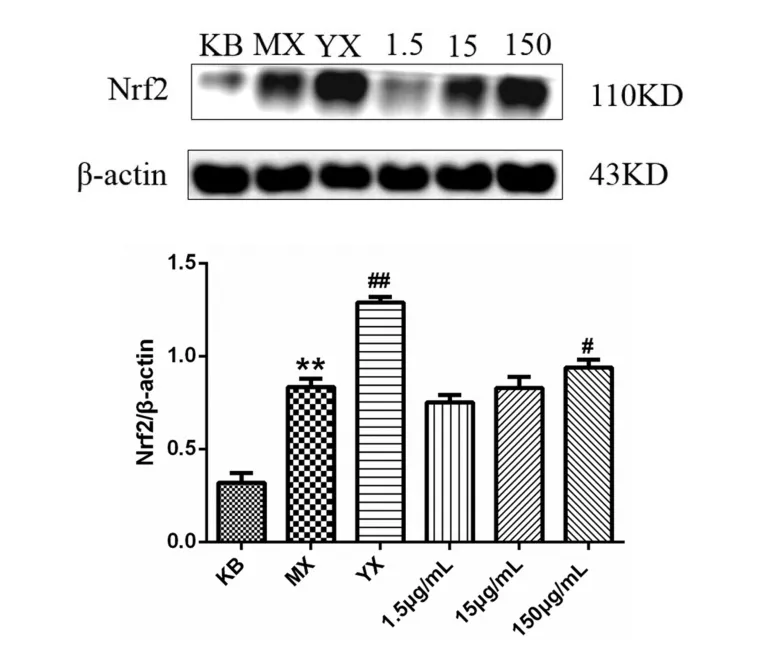
图5 各组Nrf2蛋白变化情况
3.4.3 NF-κB通路p-p65/p65磷酸化水平变化
Western blot结果显示(图6),与KB组比较,MX组经LPS刺激后,p-p65磷酸化水平明显升高(p<0.05),表明细胞炎症模型构建成功.而分别使用阳性药Dex和低、中、高浓度的冰片作用细胞后,p-p65磷酸化水平出现不同程度地下降,表明二者均发挥了抗炎作用.其中,与MX组比较,1.5μg/mL抑制p-p65磷酸化水平效果不明显(p>0.05),15μg/mL和150μg/mL可极显著性抑制p-p65磷酸化水平(p<0.01).综上表明,冰片可剂量依赖性地抑制NF-κB通路的活化,进而发挥细胞的抗炎活性.
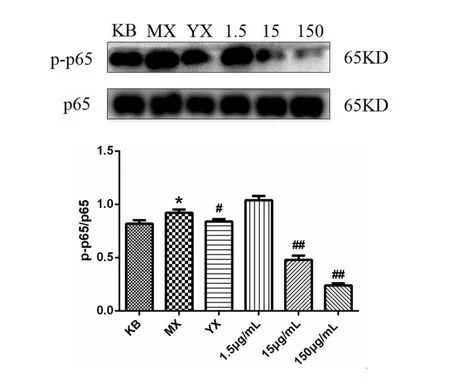
图6 p-p65/p65磷酸化水平变化情况
3.5 各组ROS表达变化情况
ROS增多会导致脂质过氧化,会对细胞或机体造成严重损伤,其含量的增高常被认为是机体损伤的重要指标.如图7所示,在LPS刺激下,MX组ROS表达率明显升高(p<0.01).与MX组相比,药物组ROS的表达均出现不同程度的极显著性下降(p<0.01),表明冰片对ROS有极显著的抑制作用,且 150μg/mL与 15μg/mL效果均比1.5μg/mL效果好.综上所述,冰片可剂量依赖性地抑制ROS的产生.
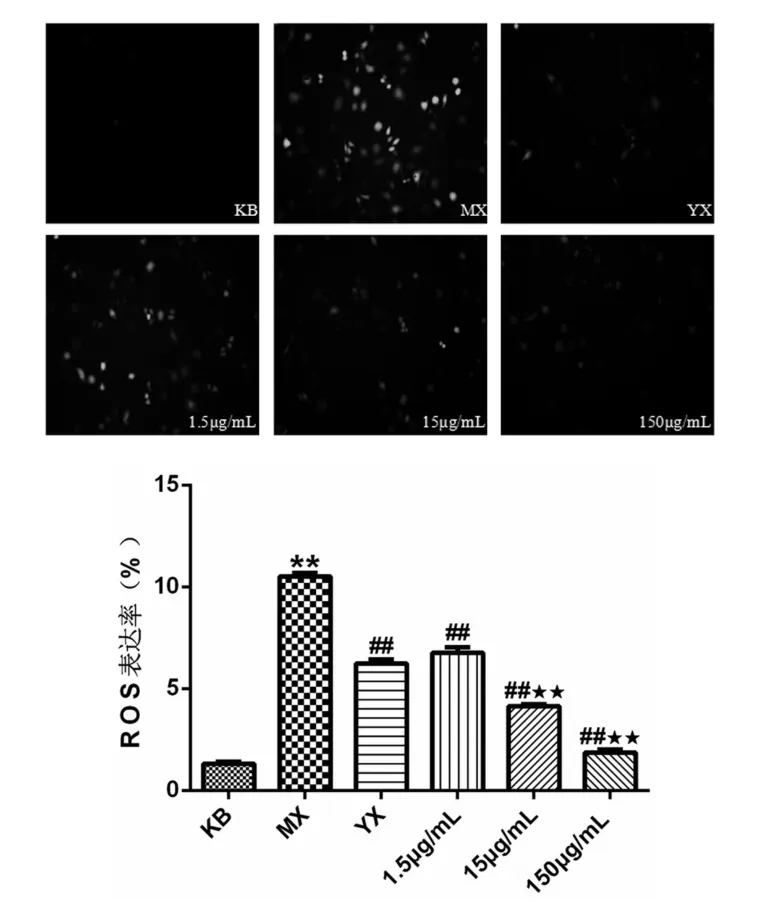
图7 各组ROS表达水平
4 讨论
NO作为炎症反应的重要炎性介质,在炎症、肿瘤等疾病进程中均有重要作用[12-14].iNOS是生成NO的一种关键酶,主要存在于巨噬细胞中,当巨噬细胞遭受炎症介质、LPS等刺激时,诱导型一氧化氮合成酶会显著增加,从而产生大量的NO进行免疫应答.NO具有一定细胞毒性,会进一步对机体造成损伤,从而促进炎症部位渗出和水肿[15],抑制NO生成的程度是检测抗炎活性的直接指标.本实验结果显示,与1.5μg/mL组比较,15μg/mL、150μg/mL剂量下,NO水平均极显著性降低,且150μg/mL浓度下NO水平更低,说明冰片能剂量依赖性地降低细胞培养上清液中NO水平,进而发挥体外抗炎作用.
ROS属于活性较高的自由基,是生物体内产生的超氧阴离子、过氧化氢、羟自由基等活性含氧化合物的总称,是氧化应激的关键介质,可激活单核细胞、巨噬细胞等多种免疫细胞释放大量炎性因子,其含量的多少是判断是否发生氧化应激的重要指标[16].LPS可通过激活RAW264.7巨噬细胞上的toll样受体-4复合物并引发全身性氧化应激,从而致ROS水平显著性增加[17].而氧化应激能够调控和加剧炎症,激活NF-κB和MAPKs炎症通路,促进炎性因子(如NO等)的表达,进而会引起急性炎症、组织损伤和败血症等[18].本实验中药物组ROS的表达均出现不同程度的下降,且150μg/mL组下降更显著,表明冰片具有一定的抗炎作用.
NF-κB是细胞应答损伤、应力及炎症的重要信号通路,参与多种炎性细胞因子的转录,在炎症反应的复杂细胞因子网络中可能是一个中心环节.NF-κB激活主要是由IKK(IκB激酶)激活而产生的.在受到外界刺激(如LPS)时,IκB被磷酸化,释放出有活性的p50/p65二聚体进入细胞核,从而调节特异基因的转录[19].活化的NF-κB能够调节炎性细胞因子NO等的合成以及分泌,进而诱发炎症的发生[20].目前已证实该通路是抗炎药物的重要作用靶点,阻断或抑制NF-κB的转录活性可抑制炎症反应.本实验采用Western blot法检测细胞p65蛋白的表达,结果显示,冰片呈剂量依赖性地抑制RAW264.7细胞p65蛋白的磷酸化,即通过抑制NF-κB通路的激活,从而发挥抗炎作用.
MAPKs通路是能够对各种细胞外刺激物做出应答的经典炎症通路,通过应答机体的各种刺激来激活促炎因子的表达,从而发挥应激反应的中心调节子作用[21].胞外信号调节激酶1/2(ERK1/2)、p38和c-Jun NH2-末端激酶(JNK)3条级联反应构成MAPKs信号通路的主要部分,该通路的激活可促进炎症细胞因子的生成而加剧炎症反应[21].现有研究显示,MAPKs可被LPS激活[22],活化成磷酸化状态调控下游的炎性细胞因子[23],抑制MAPKs通路的活化也是控制过度炎症反应的有效途径[24].本实验结果显示,冰片可剂量依赖性地抑制MAPKs通路的活化,从而发挥细胞外抗炎作用.
另外,Nrf2蛋白在抗氧化反应中起着重要的作用.在生理状态下,Nrf2与Keap1结合,存在于细胞质中.LPS通过一系列的信号分子激活Nrf2[25],氧化应激也能使之激活,促使其核转位,与细胞核中的抗氧化反应元件结合,进而激活抗氧化剂的转录基因[26];Nrf2表达上调会抑制ROS的生成,从而抑制炎症反应[27].因此,调节Nrf2蛋白对于抑制炎症反应和减轻氧化损伤具有重要的意义.本研究结果表明,冰片可剂量依赖性地激活Nrf2蛋白,其中150μg/mL抗炎效果较好.
综上,冰片能剂量依赖性地抑制MAPKs和NF-κB通路的活化,激活Nrf2蛋白,抑制ROS的产生,降低相关炎症因子NO的表达水平,进而发挥细胞抗炎活性.此研究深化了对冰片的认识,为冰片的合理用药提供了理论基础.

