婴儿粪便中益生菌的分离筛选及培养
郑丽君,吴秀英,李洪亮,孙 涛
(内蒙古蒙牛乳业(集团)股份有限公司,内蒙古呼和浩特 011517)
0 引言
益生菌是一类可以对宿主细胞起到有益作用的活性微生物,定植在人体肠道和生殖系统中[1],分为乳酸菌类、双歧杆菌类、革兰氏阳性双歧杆菌。研究显示,人体中微生物种类约30个种属,大多集中在大肠中。人体健康与胃肠道微生物种群的种类与数量,尤其是生长于大肠内的微生物种群有直接关系[2]。
刚出生的婴儿消化系统近似无菌,仅有少量肠杆菌定植。经母乳喂养后就会有大量微生物开始定植,在2 d内粪便里就能检测到肠杆菌、金色葡萄菌等[1],再过3~4 d,双歧杆菌也开始定植于肠道。有研究显示正常母乳喂养的健康婴儿在1月龄时,双歧杆菌为优势菌,同时还有大量的大肠杆菌和乳酸杆菌。随着生长,双歧杆菌数量略有增加,仍为优势菌[3]。此时,乳酸杆菌数量逐渐增加,大肠杆菌在6月龄时明显下降,以后相对平稳,总体变化是从需氧菌和兼性厌氧菌占优势转变到厌氧菌占优势。益生菌种类中双歧杆菌、乳酸杆菌一直都是健康婴儿肠道内的优势菌群。
双歧杆菌和乳酸杆菌的益生作用广受关注,双歧杆菌能否耐受胃酸、肠液和胆汁是影响其益生功能的关键因素,由于来自人体的双歧杆菌较易在人体肠道中定植,所以研究旨在从婴儿粪便中进行分离、培养双歧杆菌和乳酸杆菌并鉴定其生长特性,再从中筛选出具有潜在益生特性的纯菌株,为益生菌产业应用于发酵食品提供更多的菌种资源和参考依据。
1 益生菌种的培养与筛选
1.1 样本
河南省洛阳市母乳喂养婴儿粪便(2个月内),采样期婴儿均无肠胃不适症状,采样前2周内未服用过任何药物。
1.2 分离培养试验方法
1.2.1 乳酸杆菌分离纯化
将婴儿新鲜粪便挑取5~10 g,装入甘油管并转移至放有生物冰袋的冷藏箱中待用。在无菌操作台将已厌氧保存的婴儿粪便样1 g,转移至装有9 mL的无菌生理盐水中并至均匀,依次进行10倍的梯度稀释到 1×10-8,用移液枪吸取 1×10-6,1×10-7,1×10-83个梯度的稀释液各100 μL于固体培养基MRS-CaCO3中,每个稀释度平行3个平板[4]。放入真空培养皿中抽真空,然后充入CO2,反复2次,模拟厌氧环境,此外每一个梯度用1个平板在空气中培养做对照。然后在恒温生化培养箱中倒置平板,于37℃恒温下培养48 h后,挑取表面具备乳酸杆菌特性的菌落,接种到MRS液体培养基中进行扩大培养;重复上述步骤,然后进行革兰氏染色试验镜检,确定为革兰氏阳性菌株为纯菌株后,再活化一代,并进行过氧化氢酶试验。利用这样的方法培养2次,得到在液体培养基中为较纯的乳酸菌菌种。把最后得到的乳酸菌菌种在MRS液体培养基中放入4℃冰箱保存待用[5]。
根据乳酸杆菌基本特征,在液体培养基中找到符合上述特点的5个纯菌株暂时定为乳酸杆菌[6]。
1.2.2 5株乳酸杆菌基本信息
5株乳酸杆菌菌株镜检、菌落特征、菌落形态见表1。
1.2.3 双歧杆菌的分离纯化
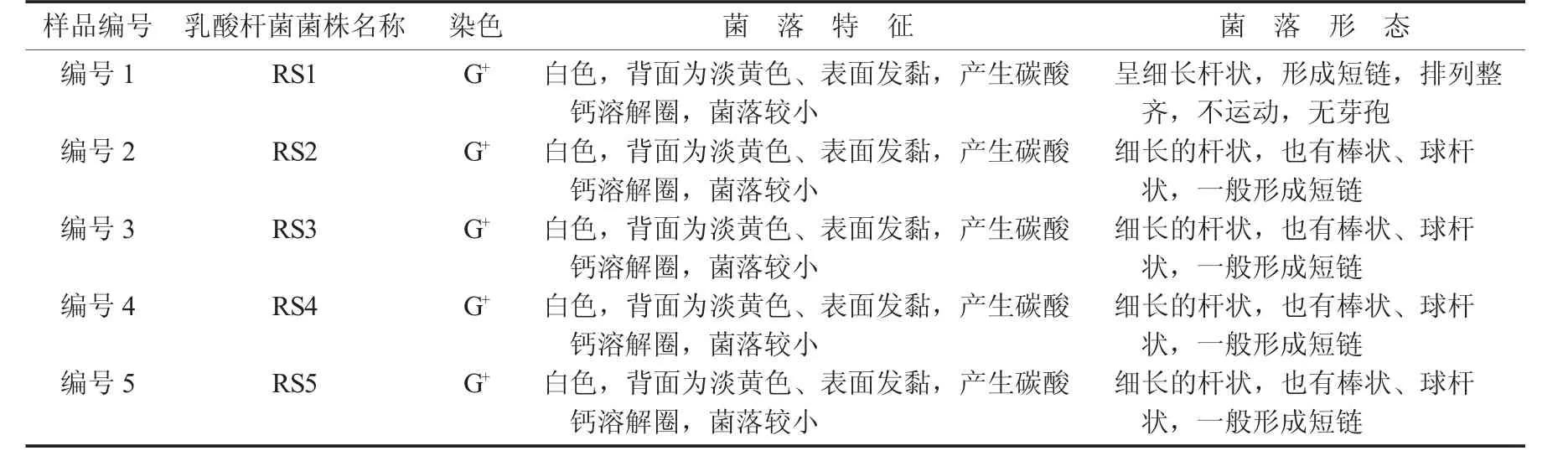
表1 5株乳酸杆菌菌株镜检、菌落特征、菌落形态
样品处理过程同乳酸杆菌,培养基改良MRS培养基。
根据双歧杆菌特征从液体培养基中得到5株符合上述特点的菌株,暂定为双歧杆菌[7]。
1.2.4 5株双歧杆菌基本信息
5株双歧杆菌菌株初步检测基本信息见表2。

表2 5株双歧杆菌菌株初步检测基本信息
2 乳酸杆菌菌株和双歧杆菌菌株鉴定
2.1 5株乳酸杆菌的益生鉴定
根据细菌属水平和种水平的分类鉴定程序,选择镜检中无分叉的G+杆菌,将其传代纯化培养,在pH值4.5的酸度下可适应酸度生长,过氧化氢酶试验、明胶液化试验、吲哚试验、硫化氢试验均为阴性,即鉴定其为乳酸杆菌属,由于乳酸杆菌鉴定结果一样,所以可近似一致。除了属水平试验鉴定,还需有种水平的鉴定才是完整的鉴定过程[8]。
2.1.1 基础试验鉴定(5株乳酸杆菌同步进行)
吲哚鉴定试验中,乙醚和培养物相互作用后未出现红色环状物,可初步确定是阴性,符合基本特征;需氧鉴定试验中,将接种管与空气中接触培养后,培养液有少许浑浊现象,且管底有部分菌体沉淀,可判断菌株为兼性厌氧;明胶鉴定液化试验,将已接种的接种管和未接种的对照试管一起放于冰箱中,待对照管凝固时,对照接种管也同时凝固,可判断为阴性反应,符合基本特征。
2.1.2 耐胆盐鉴定试验
将经过活化的菌株按培养基2%的接种量接种在胆盐质量浓度依次是0,0.3,0.6 g/L的MRS液体培养基中,于37℃恒温生化培养箱中培养24 h,依次测各组菌株菌液的OD600nm值。
5株纯乳酸杆菌菌株在不同胆盐质量浓度含量时培养基中培养24 h的OD600nm值见表3。

表3 5株纯乳酸杆菌菌株在不同胆盐质量浓度含量时培养基中培养24 h的OD600 nm值
经过试验可知,在胆盐质量浓度为0.3,0.6 g/L时,对5株乳酸杆菌生长都有明显的抑制作用,但经过2种培养基恒温培养24 h后,5株菌均能继续生长繁殖,仅RS1生长稍差,由此可知这5株菌均具有一定的耐胆盐能力,基本符合文献和综述。
2.1.3 温度敏感鉴定试验
菌株经过活化培养后,以培养基2%的接种量接种在5个含有MRS液体培养基的试管中。分别设置温度为45,50,55,60℃,处理30 min,其中1管不进行相关温度处理,只作为空白对照组[9],其余试管在37℃恒温培养生化箱中培养16 h,测各试管中菌液的OD600nm值。
5株乳酸杆菌在不同温度处理后的生长情况见表4。
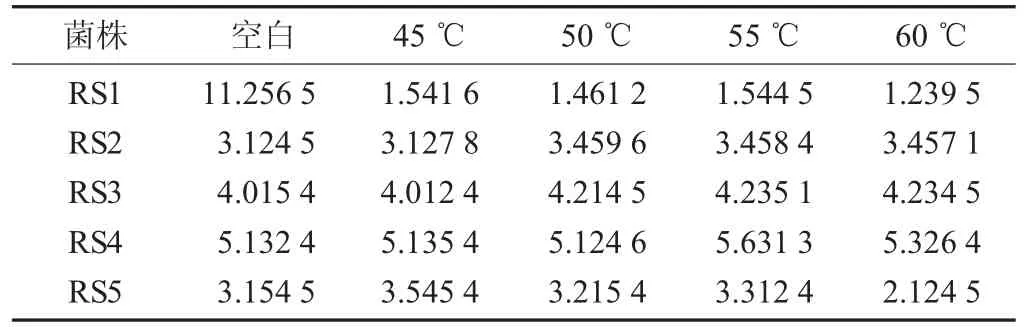
表4 5株乳酸杆菌在不同温度处理后的生长情况
经过试验测定可知,可知对温度试验敏感的菌株有RS1,其他菌株经过不同的温度培养处理后,生长繁殖情况未出现明显变化。RS5除了在60℃处理后生长很缓慢,其他温度下处理后都表现出不影响菌株生长的繁殖状态。
2.1.4 模拟胃肠道耐受试验
把MRS液体培养基的pH值调至3.0,然后经过115℃灭菌30 min后在无菌超净台上操作,添加胃蛋白酶5 mg/mL和5%的NaCl,调配制成模拟人体胃液。把MRS液体培养基pH值调配成8.0,于115℃下灭菌30 min,并放入猪胆盐为培养基含量0.3%的浓度,无菌超净台中操作,添加胰蛋白酶10 mg/mL和0.5%的NaCl,调配制成模拟人体肠液。把试验菌液以培养基含量为10%的接种量分别加到人体模拟胃肠液中,于37℃恒温培养箱模拟培养胃液2 h,肠液3 h[10]。
5株乳酸杆菌对模拟胃肠液的耐受性见表5。

表5 5株乳酸杆菌对模拟胃肠液的耐受性/×108CFU·mL-1
由试验结果可知,5株乳酸杆菌菌株在经过pH值3.0酸度胃液处理2 h后和pH值8.0的肠液处理3 h后,活菌数量均有减少,但是都保持了同步的增长趋势,由此可以说明5株乳酸杆菌菌株对于模拟的胃液、肠液都具有良好的耐受能力,其中RS3表现较强。
2.1.5 抑菌鉴定试验
将已经活化好的乳酸杆菌菌株、大肠杆菌和沙门氏菌菌株分别以培养基含量为2%的接种量同时接种10 mL的MRS液体培养基试管中。于37℃恒温生化培养箱中培养24 h。此次培养运用平板活菌计数的方法,37℃下过夜培养,菌落表现为红色的大菌落是大肠杆菌菌体,白色的菌落为沙门氏菌[11]。通过记录大肠杆菌、沙门氏菌的菌落数量,计算每一个试验菌株对大肠杆菌、沙门氏菌试验的抑菌率。
5株乳酸杆菌菌株分别对大肠杆菌、沙门氏菌的抑菌作用情况见表6。
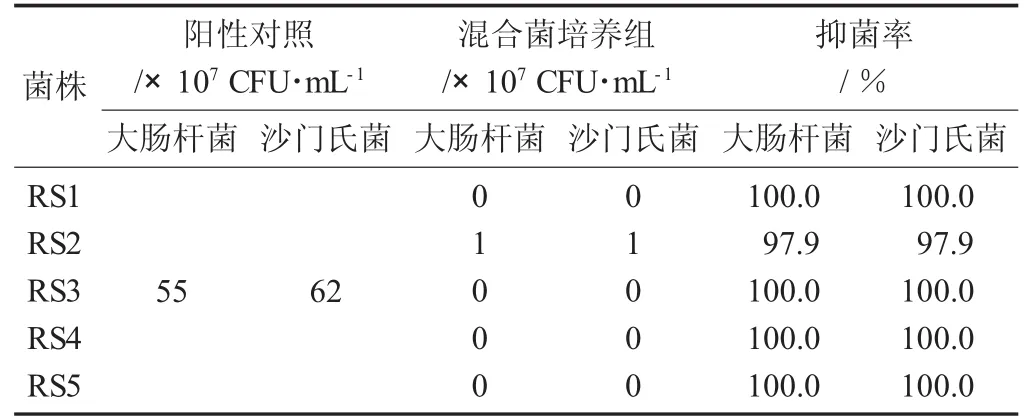
表6 5株乳酸杆菌菌株分别对大肠杆菌、沙门氏菌的抑菌作用情况
由试验数据可知,5株乳酸杆菌菌株与一起培养24 h的大肠杆菌和沙门氏菌的抑菌率均达了到97%~100%,由此可见,这5株乳酸杆菌对生长在同一微生物环境中的生态具有抑制作用。
2.2 5株双歧杆菌益生鉴定
2.2.1 分类鉴定程序
对双歧杆菌属水平的鉴定过程中,一般常用将经过分离培养纯化得到的双歧杆菌菌株先进行属水平的鉴定。选择镜检中无分叉的G+杆菌。这些无分叉的G+杆菌经过传代纯化培养后,在pH值4.5的酸度下可生长,经过属水平的生理生化试验就可以初步认为是乳酸杆菌。由于对照菌种中的双歧杆菌特性和这些鉴定结果一样,可确认为是双歧杆菌。除了属水平试验鉴定,还需进行种水平鉴定,如模拟人体胃肠道等。
2.2.2 基础试验鉴定
KOH鉴定试验:拿起接种环后没有拉丝现象出现,则判断试验菌株双歧杆菌为KOH阴性菌;吲哚鉴定试验:在乙醚与培养物之间未产生红色环状物,则测试菌株为阴性;需氧鉴定试验:经接种管培养后,培养液呈清澈,试管底部出现大量菌体沉淀,由此可判断双歧杆菌为严格厌氧菌;明胶鉴定液化试验;将经过接种培养的接种管和未接种的对照试管一起置于冰箱中,当对照管凝固时接种管也会凝固,由此可判断为阴性反应。
2.2.3 双歧杆菌的生长曲线
在测生长曲线时,将经过活化的5株双歧杆菌菌株以培养基1%的接种量接种在MRS液体培养基,并于37℃恒温生化培养箱培养48 h,每2 h取样测定1次,OD600nm下测定吸光度,绘制生长曲线。
5株双歧杆菌在37℃时的生长曲线见图1。

图1 5株双歧杆菌在37℃时的生长曲线
由图1中5株双歧杆菌的生长曲线可知,属于正常生长曲线,符合文献综述描述。
2.2.4 对双歧杆菌进行耐酸性菌株的初步筛选试验
将活化的双歧杆菌分别接种于改良的MRS液体培养基中,置于37℃恒温生化培养箱中培养24 h,利用改良的MRS培养液连续传代培养2~3次后,取10 mL双歧杆菌培养液,以转速1 000 r/min离心30 min,收集得到菌体悬液,重复进行1次,加入到盛有5 mL灭菌PBS中振匀得到菌体悬液,再用移液枪吸取菌体悬液0.2 mL接种于5 mL,pH值分别是3.0,3.5和4.0的改良MRS液体培养基中,置于37℃恒温培养箱中厌氧培养24 h,观察其生长情况,选择此条件下生长良好的菌株。
培养基中培养24 h的生长情况见表7。
由表7可知,所选的5株双歧杆菌均有一定的耐酸性,SQ1在生长中表现最好,可选为优秀菌种进行更深入研究,贮藏待用。
2.2.5 人工胃液鉴定试验
双歧杆菌菌体液1.0 mL与pH值为3.0的人工胃液9.0 mL混合后,于37℃下水浴培养,分别在0,3 h后,取样用MRS琼脂培养基双层培养法,测定活菌数并计算其存活率,筛选出存活率在98%以上的菌株,进一步做pH值2.5人工胃液耐受性测定,筛选出存活率在85%以上的菌株进行人工消化液的耐受性测定,然后再进行pH值2.0时的生长测定,每个样品做3个平行[12]。
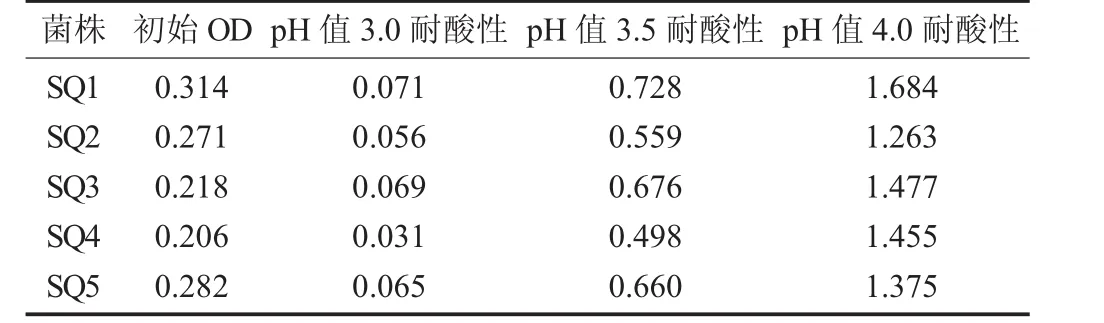
表7 培养基中培养24 h的生长情况
5株双歧杆菌在pH值3.0人工胃液中的生长情况见表8。
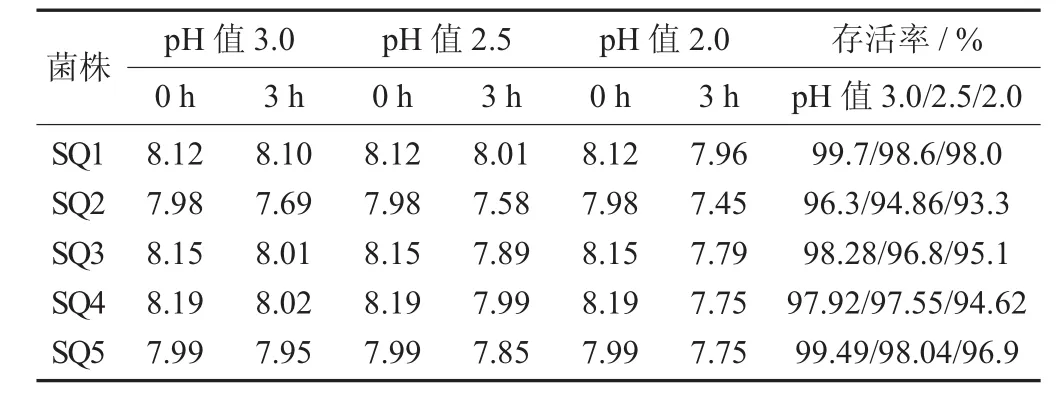
表8 5株双歧杆菌在pH值3.0人工胃液中的生长情况
由表8可知,SQ1生长最好。
2.2.6 耐胆盐基础液的制备方法
MRS液体培养基中添加3.0 g/L牛胆盐和2.0 g/L巯基乙酸钠,将活化后的菌株按2%接种量接种于胆盐质量浓度依次为0.3~2.0 g/L的MRS液体培养基中,于37℃下恒温培养16 h,测出各组菌液的OD600nm。
5株双歧杆菌对不同质量浓度胆盐的耐受性见表9。

表9 5株双歧杆菌对不同质量浓度胆盐的耐受性
由表9可知,在质量浓度为0.3~2.0 g/L的胆盐含量对5株双歧杆菌菌生长均存在抑制,但SQ1表现最好。
2.2.7 模拟胃肠道耐受试验
配制模拟人体胃液和肠液,将试验菌液以培养基10%的接种量分别放入模拟人体胃肠液中,放入恒温生化培养箱中,于37℃条件下,胃液培养2 h,肠液培养3 h[8]。利用平板计数法来统计试验前后培养液中双歧杆菌的活菌数量。
5株双歧杆菌在模拟人体胃液和肠液中2 h消化后的活菌数见表10。
由表10可知,5株双歧杆菌菌株培养液中都出现了比较显著的生长现象。其中,SQ1在人工肠液和人工胃液中的耐受性最高,可作为优良的菌株保藏待用,有更多的益生效果可以开发。
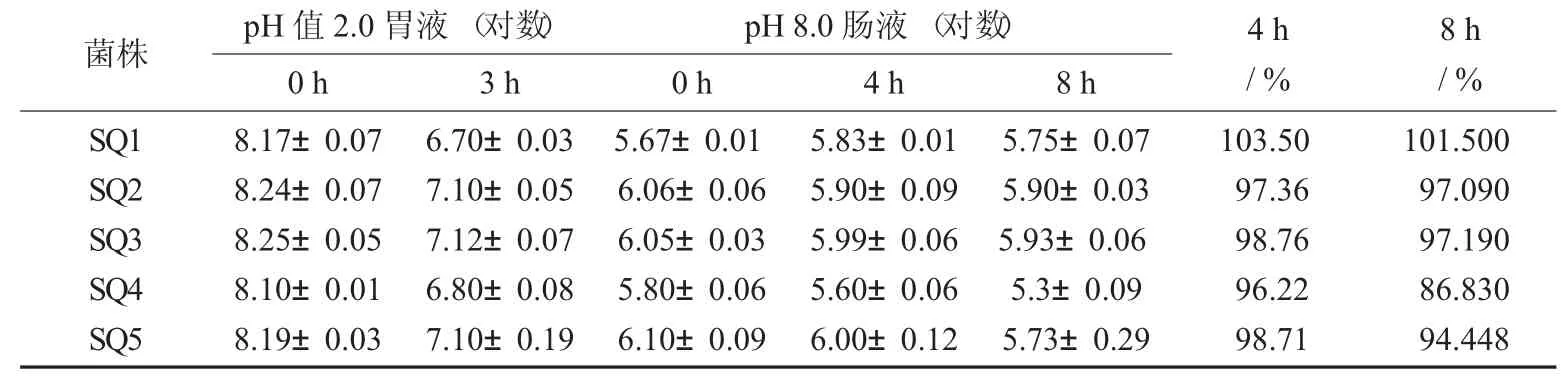
表10 5株双歧杆菌在模拟人体胃液和肠液中2 h消化后的活菌数
3 结论
通过对河南省洛阳市母乳喂养婴儿粪便进行分离培养,得到具有益生特性的乳酸杆菌和双歧杆菌纯菌种。试验经过分离培养初步得到5株双歧杆菌和5株乳酸杆菌。根据进一步的种水平和属水平的试验,最终找出了双歧杆菌和乳酸杆菌各1株具有益生特性的菌种。
对分离的双歧杆菌菌株和乳酸杆菌株进行更多耐酸和耐氧驯化试验,使其成为能够安全食用并应用于生产的优良菌株,为呵护人类健康提供优质的益生菌,将会是未来极具潜力的研究课题。

