苦参查尔酮异构酶的基因克隆与表达分析*
易雨琪,韩荣春,俞年军,顾 晓,苏 蝶,童小慧,许 菲,王丽萍
(安徽中医药大学,安徽省中医药科学院中药资源保护与开发研究所,安徽 合肥 230012)
苦参始载于《神农本草经》[1]:“味极苦,性寒”,为豆科植物苦参(Sophora flavescens Ait.)的干燥根,主产于我国河北河南地区;有清热燥湿、杀虫解毒、利水消肿之功,用于皮肤瘙痒、黄疸、热痢及湿疹等症[2]。苦参主要含有黄酮类、黄酮醇类、生物碱类和三萜类等多种化学成分。其中黄酮类主要包括大豆苷元、柚皮素、苦参酮、异苦参酮等;生物碱类成分主要是喹诺里西啶类,少数为双哌啶类成分,其主要包括苦参碱、氧化苦参碱、羟基苦参碱等[3-5]。现代药理药效学研究表明,苦参具有抗炎、抗病毒、抗肿瘤、抗肝损伤和抑制中枢等药理活性,其药理活性成分主要包括生物碱及黄酮类化合物[6-9]。
查尔酮异构酶(Chalcone isomerase,CHI)是黄酮类物质生物合成过程中的关键酶[10-12]。该酶首先发现于植物中,可将查尔酮环化为黄烷酮类物质。随后在真菌、黏菌和变形菌基因组中均发现了查尔酮的同源基因,该类生物体中因缺乏相关的催化底物,故认为CHI无法发挥作用[13]。目前最新研究报道显示,啤酒花中无催化活性的CHI蛋白对其黄酮类化合物的生物合成起重要的促进作用[14]。查尔酮异构酶的基因克隆及表达分析在草莓果实[15]、杭菊[16]、紫丁香[17]等植物中已有报道。有鉴于CHI在生物界分布的特点及其可不依赖于直接催化作用而影响特定次生代谢产物合成与积累的性质,通过对sfCHI的研究可以为苦参黄酮与花青素类物质生物合成研究提供资料,同时也为系统研究CHI进化与分子机理积累素材。
1 材料与方法
1.1 材料 苦参植物采自安徽中医药大学种质资源圃,经俞年军教授鉴定为豆科植物苦参Sophora flavescens Ait.。选择二年生苦参植株,自来水洗净后以75%乙醇消毒,再用无菌水冲洗3次后,在Kimwiper无尘纸上吸干水分备用。选取苦参新鲜植株,分为根、茎、叶和叶柄4个部位,将新鲜组织及时用液氮在研钵中研磨成细粉后保存在-80℃冰箱,用于提取苦参不同部位的总RNA。
1.2 方法
1.2.1 总RNA提取及cDNA的合成 选用Trizol试剂盒(Life Technologies,美国)提取苦参不同部位冻存粉末中的总RNA后,以ScanDrop 200型核酸分析仪(Jena,德国)对核酸进行检测以保证OD260/280>1.80,OD260/230>1.80。所有样品的总RNA各使用1 000 ng,以 FastQuant RT试剂盒(天根,北京)完成RNA的反转录,得到第一链cDNA。
1.2.2 引物设计及sfCHI序列信息验证 基于本课题组前期研究结果,通过Basic Local Alignment Search Tool(BLAST)程序将苦参转录本Unigenes[18]在NCBI nr蛋白质数据库中进行检索,推送检索得到的序列信息至UniProt数据库[19]以注释sfCHI的同源序列。用Primer-BLAST程序在线设计引物进行特异PCR反应。本实验引物及质粒测序服务均由生工生物工程上海股份有限公司提供,各引物信息见表1。

表1 苦参sfCHI基因克隆与PCR实验所用引物信息
将sfCHI的PCR扩增产物在1.0%琼脂糖凝胶中进行电泳分离后,在紫外光下将条带自凝胶中切出。使用Promega琼脂糖凝胶DNA纯化试剂盒回收DNA后,使用pGM-T Fast克隆试剂盒(天根,北京)将sfCHI与载体连接。使用热休克方法将含有外源基因的质粒转化入大肠杆菌DH5α后,37℃震荡培养过夜。通过Invitrogen质粒提取试剂盒回收质粒后进行测序。
1.2.3 生物信息学分析 选择具有代表性的同源序列与sfCHI进行比较分析,采用MEGA X[20]软件的邻位相连法参数构建其系统进化树。同时针对sfCHI所编码的氨基酸序列进行理化特征分析(http://web.expasy.org/protparam)以及三维结构的预测(http://www.reading.bioinf)。
1.2.4 苦参sfCHI不同组织间表达的半定量PCR分析 作为参照,以苦参的β-actin作为管家基因。使用表1的β-actin_F、β-actin_R、sfCHI_F与sfCHI_R引物对苦参根、茎、叶片、叶柄共4个部位进行PCR扩增。结合前期实验的转录组数据,分别考察β-actin在苦参不同器官及不同采集时间的表达稳定性[18];设置PCR不同循环次数,分析sfCHI的电泳条带亮度和器官间表达差异,优化反应条件。
2 结果与分析
2.1 苦参sfCHI的基因克隆 基于苦参转录组学数据,使用sfCHI引物对扩增茎和叶cDNA,以7 μL扩增产物在1.0%琼脂糖凝胶中进行电泳,电泳结果如图1所示,扩增产物长度与预期一致。经凝胶回收、质粒转化与大肠杆菌培养、质粒提取与测序组装后,使用NCBI BLAST进行同源基因检索,发现sfCHI与豆科狭叶羽扇豆(Lupinus angustifolius)CHI序列一致性为 89.95%,与月季 CHI(Rosa chinensis)相似度为78.47%。sfCHI基因长度为630 bp,编码氨基酸209个。该基因在DDBJ的登录序列号为LC495308。sfCHI基因的cDNA核酸及氨基酸序列见图2。
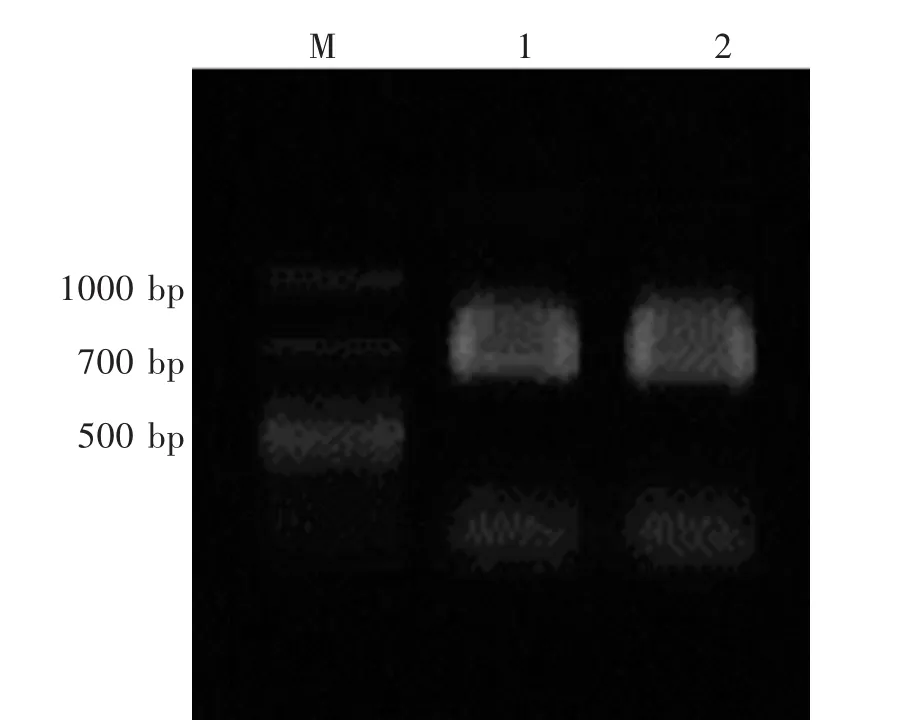
图1 苦参CHI基因PCR扩增结果

图2 苦参CHI基因cDNA及氨基酸序列
2.2 苦参CHI基因所编码蛋白质预测 采用瑞士生物信息研究所ProtParam软件对sfCHI蛋白质的理化性质进行解析预测:其蛋白质分子式为C1062H1661N259O326S2,由20种共209个氨基酸构成;sfCHI的原子总数为3 310,分子量为23 337.53;推算其不稳定系数为34.04,属稳定型蛋白质;其预估半衰期在哺乳动物网状红细胞(体外)内为30 h、酵母菌(体内)超过 20 h、大肠杆菌(体内)超过10h;脂肪质指数为94.69。使用英国雷丁大学的蛋白质结构与功能预测服务器(IntFOLD ver5.0)[21-22]对sfCHI进行三维结构预测,蛋白质模板选择PDB数据库的 4dokA、4doiA和 1eyqA(见图 3);结果显示sfCHI的3D结构预测P值为2.92E-9,提示该结构预测的可信度较强。
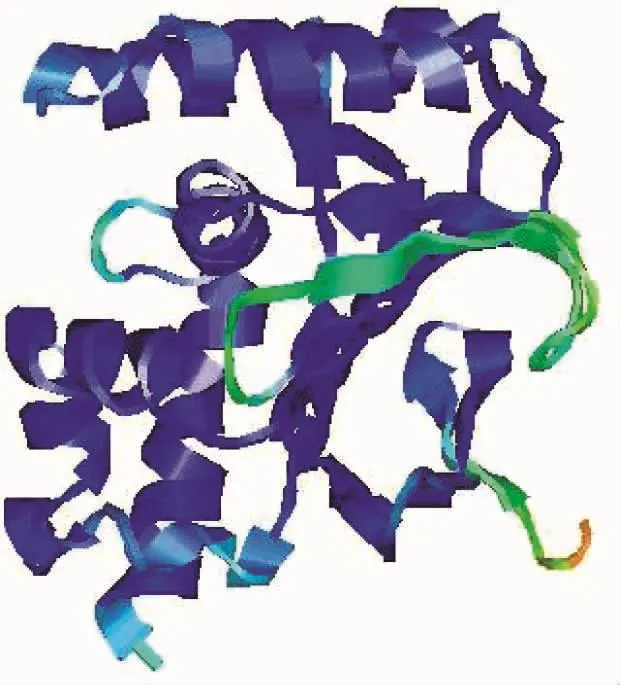
图3 苦参CHI蛋白三维结构预测结果
2.3 苦参CHI基因同源性及进化分析 对包括sfCHI在内的5种植物的CHI氨基酸序列进行同源分析,序列多重比对使用ESPript ver3.0软件。结果提示,该组植物查尔酮异构酶间存在较高的相似性(见图4)。将sfCHI的核酸序列通过NCBI BLASTx进行检索(E值设置为1e-10),在蛋白质数据库中共检索到576条结果;其中与sfCHI序列一致性最低的为可可树(Theobroma cacao,25.95%);最高的为狭叶羽扇豆(Lupinus angustifolius,89.95%)。以包含 sfCHI编码蛋白在内的16种不同植物CHI氨基酸序列为模板,采用MEGA X软件创建CHI系统进化树(见图5),以邻位相连(Neighbor-joining)为统计方法,替代模型使用泊松分布,辅以配对删除法对缺失数据进行处理。结果显示,4种豆科植物的遗传距离较近,而拟南芥、水稻等模式植物的遗传距离相对较远;这与传统分类学结论相一致。
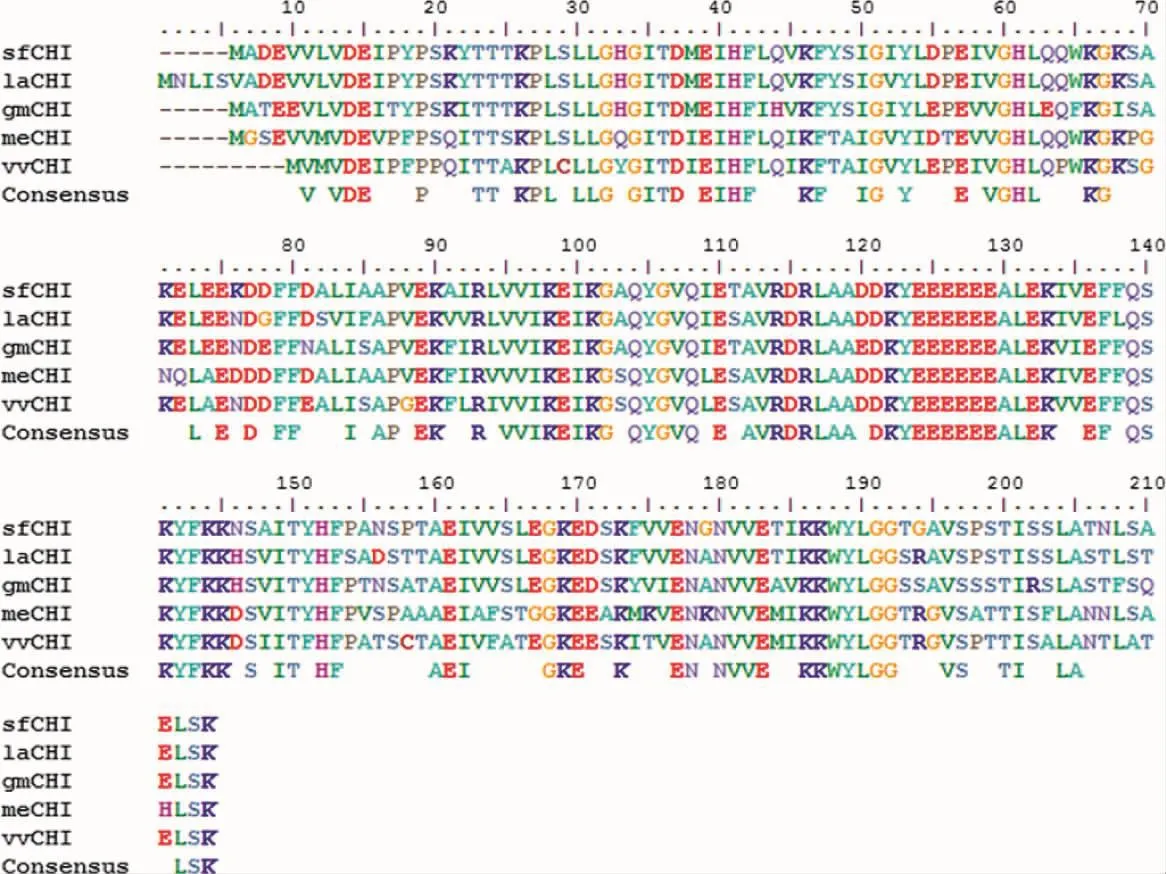
图4 不同植物CHI氨基酸序列多重比对
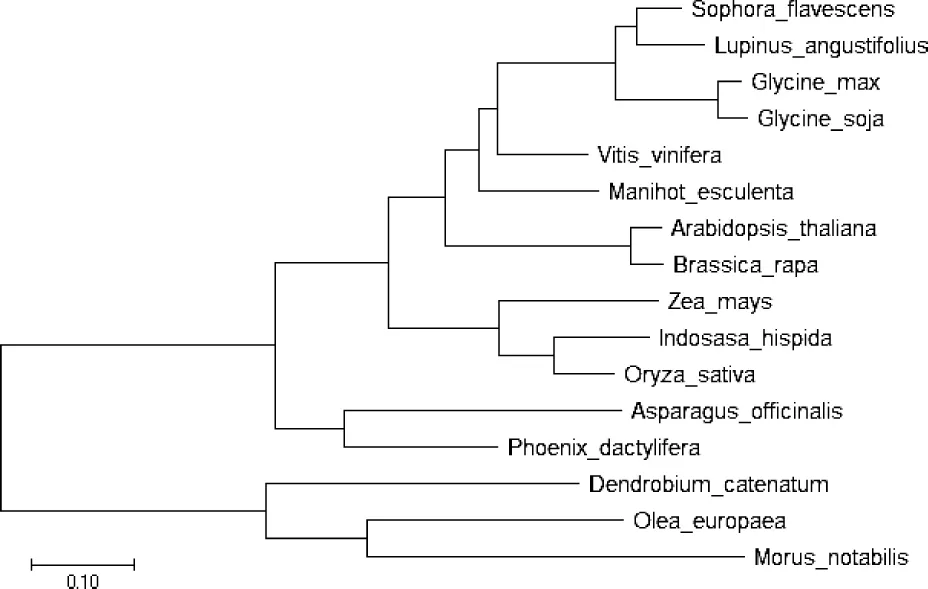
图5 苦参CHI系统进化树
2.4 半定量表达分析 将PCR退火温度设为50℃,每次循环延伸时间为1min;β-actin凝胶电泳图在26循环时可见明显条带且苦参不同采集月份的PCR扩增图谱在4种组织间无明显差异,提示管家基因的表达较稳定。经预实验考察,对sfCHI的半定量扩增循环次数分别定为28、30。见图6。
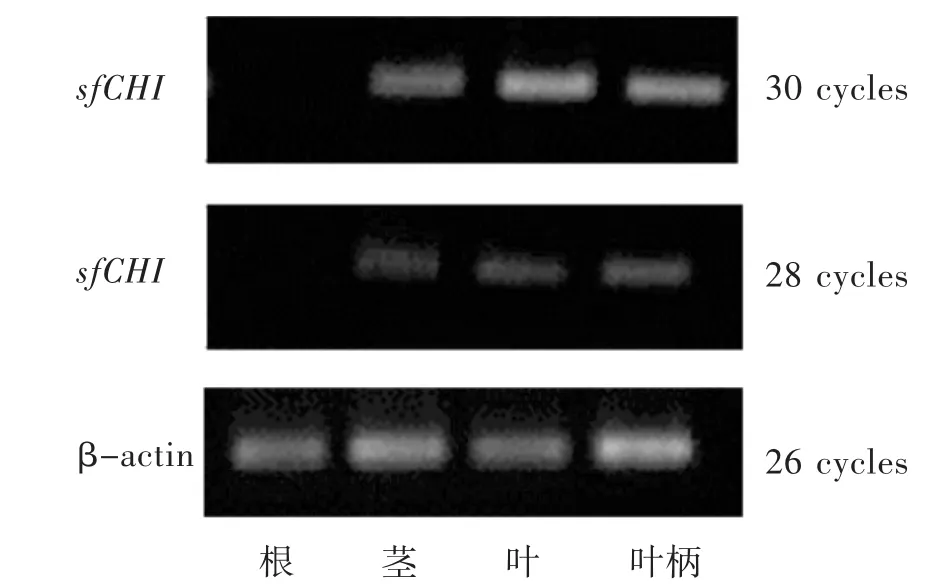
图6 苦参CHI基因在不同组织中的相对表达量
3 讨论
本实验通过分析苦参转录组数据[18],设计特异性引物对sfCHI进行克隆。经凝胶回收、载体连接与转化,在质粒提取后进行测序,确定了sfCHI序列的碱基数为630 bp,编码209个氨基酸。对sfCHI翻译的蛋白质进行测算,发现其理化性质较为稳定,在酵母等模式工程菌体内可存在较长时间,适合进行原核或真核异源表达。将sfCHI在NCBI数据库中检索同源序列,发现其与数种豆科植物的CHI相似性较高,而与水稻等同源性较低。基于前期转录组学数据[18]关于苦参CHI的组织间表达情况,sfCHI的RPKM值在根、茎、叶和叶柄中分别为 2、97.4、130.9 和 112.7;采用半定量PCR法对sfCHI基因表达信息进行分析,发现实测情况与生物信息学数据吻合度较高。通过本研究明确sfCHI序列信息、理化特征与基因表达信息,将对进一步研究苦参黄酮类物质生物合成机制起到积极的推动作用。

