近红外荧光成像技术在肾脏手术中的应用进展
张 瑞,任 珍,杨晓峰,闫旭韬
(1.山西医科大学,山西太原 030001;2.山西医科大学第一医院泌尿外科,山西太原 030001)
近年来,由于超声、计算机断层扫描(computerized tomography,CT)、磁共振成像(magnetic resonance aging,MRI)等检查手段的广泛应用,使得人们能够早期发现微小的肾脏肿瘤,在实现早期诊断的同时也对临床医生提出了挑战,如何在术中准确定位肾脏肿瘤的部位成为一个亟需解决的问题。另外由于腔镜、机器人等机械设备的广泛应用,使得术者在手术过程中对触觉的感知下降,主要依据视觉信息进行临床操作,如何增加组织间的对比,实现精准的术中操作成为另一个亟需解决的问题[1]。近红外荧光成像技术作为一种新的成像方法,在前哨淋巴结显影[2]、肿瘤定位[3]、血管显影[4]等方面已有了广泛的应用。通过静脉或局部注射近红外荧光染料,使之聚集在特定部位后,在波长700~900 nm的激发光的照射下,近红外荧光染料会发射出比入射光波长更长的肉眼不可见的荧光,该荧光可被近红外荧光成像设备捕捉,通过滤镜进入相机后经数据处理将光信号转化为电子信号,最终将信号的强弱用灰度值显示于屏幕上。由于生物组织对于该波段的光量子吸收最弱,因而近红外荧光成像具有一定的组织穿透能力。相比于传统的成像方法,它可以实现术中的实时成像,为术者提供直观的视觉引导,并且由于组织对于这段波长内的光吸收和散射作用均较小,使之具有较强的组织穿透力(1~2 cm),并且无电离辐射等危害[5]。目前,该成像技术已在肾脏相关手术中进行了初步应用,显示出了良好的临床效果,现将当前常用的近红外荧光染料及在肾脏手术中应用作一综述。
1 近红外荧光染料
自吲哚菁绿(indocyanine green,ICG)被批准应用于临床以来,已有多种近红外荧光制剂被研制出来,其中主要包括无机近红外荧光探针和有机近红外荧光染料。近红外荧光探针主要与纳米粒子、光量子点的修饰有关,其中包括的重金属成分(如镉、硒)、涂覆材料存在潜在细胞毒性,这限制了其在临床上的大规模应用。目前,在临床上较为常用的近红外荧光染料包括花菁类染料、酞菁、方酸菁、硼二吡咯甲烷类似物和卟啉衍生物等,通过与特异性靶向抗体、多肽等有机小分子的结合,在一定程度上克服了近红外荧光染料无特异靶向性、水溶性差等缺点。其中,花菁素类和卟啉衍生物的应用最为普遍。下面对临床上在肾脏手术中应用的3种近红外荧光染料进行了总结。
1.1 ICG目前,ICG为近红外荧光成像中最常用的近红外荧光成像染料,其为水溶性物质,具有阴离子特性和两亲性,相对分子质量为776 u[6-7],通过静脉注射入人体后迅速与血浆蛋白结合,其激发光波峰为780 nm,发射光波长为820 nm,此段波长处于组织自体荧光波长之外,从而可以进行近红外荧光成像。最早于1959年被美国食品药品监督管理局(Food and Drug Administration,FDA)批准应用于视网膜血管造影,由于其具高安全性、不良反应发生率低等优点,后被广泛应用于心输出量测定[8]、肝功能测定[9]及视网膜造影[10]等方面。由于近年来近红外成像设备的极大发展,其又被应用于淋巴结显影[11]、血管造影[12]、重建手术[13]、胆管造影[14]和肿瘤显像[15]等方面,并且ICG具有良好的安全性,不良事件发生率为0.34%[16]。不过由于其非靶向性限制了其进一步的临床应用,能够与ICG耦合的靶向载体的发展有望克服这个缺点[17]。
1.2 5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)
5-ALA是原卟啉合成的主要底物,已被FDA批准应用于肿瘤检测和肿瘤治疗(光动力疗法)。其主要通过局部或口服给药,在体内被诱导合成荧光分子原卟啉IX(protoporphyrin IX,PpIX)并聚集于上皮或者肿瘤组织中[18-19],从而实现近红外荧光显像。体内pH值可以影响PpIX的荧光强度,在380~440 nm激发光的激发下,其在碱性环境中的发射峰在620 nm处,在酸性环境中的发射峰在634 nm处。目前5-ALA已应用于恶性胶质瘤[20]、膀胱癌[21]、前列腺癌[22]等肿瘤的近红外荧光成像,不过由于其价格较高、使用的不方便性及术后24 h内皮肤敏化的高风险性(患者不应暴露于阳光或强人造光下),对其使用提出了挑战[23]。
1.3 靶向荧光染料近年来,具有靶向特性的近红外荧光染料被研发出来。叶酸受体通常在肿瘤细胞中被上调,所以基于叶酸受体的共轭靶向染料——叶酸异硫氰酸荧光素(folate fluorescein isothiocyanate,Folate-FITC)其激发光波长为495 nm,发射光波峰在520 nm处[24],叶酸或叶酸类似物可通过受体介导的内吞作用进入细胞,进入细胞后,共轭染料仍可保持完整性,因此依旧具有荧光信号[25]。另一种叶酸类似物—EC17已被用于进行肾脏肿瘤显像[26]。此外还有另一种叶酸类似物--OTL38也已被用于肾脏肿瘤的近红外荧光显像,并在肾部分切除术中进行了初步研究[27]。
2 近红外荧光设备
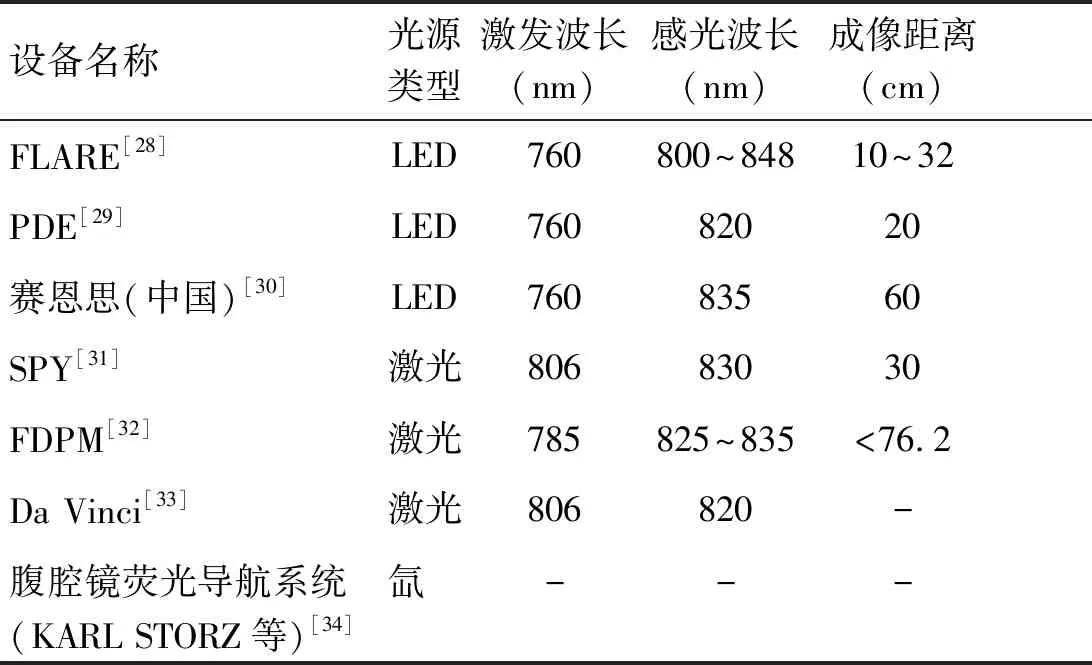
近年来近红外荧成像技术的不断发展对近红外成像设备的发展也提出了要求,目前常用的近红外荧光成像设备主要由激发光源、感光相机及图像处理系统3部分组成。由于不同的成像设备之间使用的激发光源、滤镜及相机的不同,使得不同设备间的激发光、感光波长及成像距离都不尽相同,表1总结了临床上常用的近红外荧光成像设备的特性。
表1 临床常用的近红外荧光成像设备
设备名称光源类型激发波长(nm)感光波长(nm)成像距离(cm)FLARE[28]LED760800~84810~32PDE[29]LED76082020赛恩思(中国)[30]LED76083560SPY[31]激光80683030FDPM[32]激光785825~835<76.2Da Vinci[33]激光806820-腹腔镜荧光导航系统(KARL STORZ等)[34]氙 ---
3 近红外荧光在肾脏手术中的应用
近年来,随着腔镜技术的不断发展,几乎所有的肾脏手术都可以在腔镜下完成。在实现治疗微创化的同时,也对术者在术中如何准确判断肿瘤的部位、大小,肾脏的血管解剖及变异,术后肾脏的血流灌注等情况有了更高的要求。不过腹腔镜技术剥夺了术者对于组织的触觉感知能力,为了实现术中的准确判断,更好地引导术者完成手术,就需要在术中为术者提供更多的视觉信息。在这种情况下,近红外荧光成像技术已逐步应用于肾脏手术中,目前主要应用于以下3个方面。
3.1 肾脏肿瘤定位肾部分切除术现在是治疗肾脏小肿瘤的首选手术方法,因为它可以保证在肿瘤完整切除的情况下尽可能地保留肾单位,并且与传统的肾脏完全切除相比,术后不良反应的发生率低。不过术中的操作主要依据于外科医生对肿瘤边缘的识别能力,如何保证肿瘤周围的阴性切缘而不过度切除正常的实质,以及保持较短的缺血时间,特别是近年来腔镜、机器人技术的发展,在术中术者缺乏触觉的反馈,使得医生更加依靠视觉信息。在这种情况下,近红外荧光成像技术受到越来越多的人的关注。
CORNEJO等[35]评估了在达芬奇机器人手术中应用近红外荧光染料ICG的疗效,实验对象为1例右侧肾肿瘤的女性,患者术中的右肾热缺血时间为22 min,术后病理证实手术切缘为阴性且无并发症发生,近红外荧光成像引导下的机器人辅助肾部分切除术可提高手术的疗效和术后肾脏功能的恢复。由于叶酸受体的含量在正常肾脏组织比在肾脏肿瘤组织高,SHUM等[36]应用具有叶酸受体靶向性的荧光物质OTL38进行了近红外荧光引导下的腹腔镜肾部分切除术,术中可以清晰看到正常肾脏组织为明亮的荧光,而肿瘤组织的荧光很暗,在荧光信号的引导下进行了肾部分切除术,术后病理证明所有肿瘤的切缘均为阴性。近红外荧光染料ICG的使用被认为是安全的,但是WILLIAM等[37]报道了第1例在机器人肾部分切除术中静脉注射ICG导致的过敏性休克的案例。
然而,由于荧光信号的穿透深度是有限的,无法实现较深肿瘤的成像,因此MARLENE等[38]将近红外荧光染料与发射性核素偶联后,再与吉妥昔单抗连接,实现了放射性核素与近红外荧光的同时显像,并具有了肿瘤靶向性,不过这项研究是在离体肾脏肿瘤组织中进行的,仍需要进一步的实验研究。
3.2 肾脏动脉显影CASEY等[39]在2012年第1次报道了在机器人腹腔镜下进行肾动脉选择性阻断的肾部分切除手术,这在最大程度上减小了对肾功能的损害。术中对肾动脉进行可视化显像可以实现肾动脉的选择性或者完全性阻断,这种显像技术的有效性在多项研究中有报道[40]。
CECILIA等[41]在30例行超选择性机器人辅助肾部分切除术的患者中应用近红外荧光成像技术对肾动脉进行了显影,并进行了肾动脉的超选择性阻断和前瞻性配对分析。其中23例患者成功实现了肾动脉的超选择性阻断,5例患者由于肿瘤显示荧光而进行了二次选择性动脉阻断,配对分析结果显示,在手术时间、出血量、肿瘤边缘阳性率及并发症等方面超选择性阻断并无明显优势,但对术后肾功能的恢复有很大的作用。吴震杰等[42]在12例肾肿瘤患者中探讨了区域血流近红外荧光可视化成像技术在肾动脉分支阻断中的应用价值,实验结果表明基于ICG的近红外荧光成像技术可以使得在机器人肾部分切除术中清晰、直观的显示肾动脉,提高肾动脉分支的阻断效果。
3.3 肾脏移植血流重建在肾移植中,评估肾血管重建后的血流灌注情况,尤其是多动脉肾脏移植后的血流灌注情况是很有价值的。目前常用的血流灌注评价的方法为多普勒超声,但是其检测范围有限,术中操作不便[43]。而近红外荧光技术可以实时、多角度的显示整个移植肾脏的灌注情况,并清楚地显示肾血管的吻合情况。
TOKIHIKO等[44]在8例实行肾脏移植的终末期肾病患者中应用了近红外荧光显像技术,通过静脉注射10 mL ICG溶液后,2 min后可以清晰地看到吻合后的肾动脉是否通畅及肾脏的灌注情况,肾脏的荧光信号强度与灌注情况成正相关性,移植的肾脏如果荧光较弱提示灌注不好,需要重新进行血管吻合。同样,BONI 等[45]在腹腔镜下用自体肾移植治疗肾动脉瘤(1例)的手术中,通过静脉注射ICG溶液5 mL,然后根据术中的荧光情况对肾动脉的吻合及肾脏的灌注情况进行了判断,术中可以清晰地观察到肾脏的荧光信号,从而判断其灌注良好。
4 总 结
近年来,随着近红外荧光成像技术的不断发展,其在医学中的应用越来越广泛,整形外科[4]、心胸外科[46]、腺体外科[47]等均有了相关报道。2013年欧盟分子影像协会成立了“近红外荧光成像术中导航研究小组”,有关近红外荧光的临床应用已成为一个新的研究热点[48]。本文主要总结了目前肾脏手术中常用的近红外荧光染料及近红外荧光成像技术在肾脏手术中的应用。相关的实验表明,近红外荧光成像技术可以显著提高手术操作的精准性,具有广阔的应用前景,但仍需大量的临床数据的进一步证明。目前我们应该注意到限制其进一步临床应用的问题为近红外荧光染料多数不具有靶向性、水溶性差、光漂白严重,不能进行长时间的影像检测,且部分价格昂贵、术中分辨率低等。而目前常用的MRI、CT、PET-CT具有较高的图像分辨率和灵敏性,已有相关实验表明将近红外荧光成像技术与传统成像方法结合后,可以实现优异的成像效果。此外目前的近红外成像方法无法实现近红外信号的定量测定,只能进行定性或者半定量的观察,不能实现精确的术中判断。因此进一步发展具有靶向性、低价格、高量子产率的近红外荧光染料,并与其他成像方式相结合,将进一步促进其在临床中的应用。