M2型巨噬细胞在移植肾上皮-间质转化中的作用
杨迷玲,徐宪伟,张 果,曲青山,杨金花*
(郑州人民医院 1.病理科;2.器官移植科,河南郑州 450003)
肾移植是肾功能衰竭患者的有效治疗手段。目前,移植肾的1年存活率已经普遍超过90%,但移植肾的长期存活状况并没有明显改善[1]。慢性移植肾肾损伤(chronic kidney allograft injury,CAI)是肾移植后常见的并发症,主要表现为移植肾功能进行性减退,最终可导致肾功能衰竭。CAI的组织学特征为非特定因素所致的间质纤维化和肾小管萎缩。预防CAI是提高移植肾存活率的主要目标之一,有研究认为炎症性巨噬细胞(M2)与移植肾的间质纤维化相关,而上皮-间质转化(epithelial-interstitial transformation,EMT)是肾间质纤维化的主要因素,但是M2型巨噬细胞与移植肾EMT之间的关系尚不清楚。因此,我们初步用免疫组织化学方法检测移植肾组织中CD163和EMT标记物肿瘤生长因子(Tumor growth fanctor,TGF-β1)、E-cadherin、Vimentin及SMA蛋白的表达情况,进一步分析CD163标记的M2型巨噬细胞与移植肾肾小管上皮-间质转化之间的关系及其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1标本来源 选取郑州人民医院病理科2014-2017年病理诊断为慢性移植肾肾损伤的石蜡标本30例,其中男性18例,女性12例,年龄18~53岁。按Banff 2015移植肾活检诊断标准慢性移植肾肾损伤间质纤维化分3级:Ⅰ级12例,Ⅱ级10例,Ⅲ级8例,用Masson三色染色评估间质纤维化来选取标本。同时收集10例正常肾组织作为对照组。在选取标本时已除外其他已知原因引起的间质纤维化和肾小管萎缩,只选取非特定致病因素引起的间质纤维化和肾小管萎缩,不伴有肾小管炎和动脉内膜炎。
1.1.2主要试剂 鼠抗人单克隆抗体CD163(克隆号10D6)、鼠抗人单克隆抗体SMA(克隆号1A4)、兔抗人多克隆抗体TGF-β1、鼠抗人单克隆抗体E-cadherin(克隆号4A2C7)、鼠抗人单克隆抗体Vimentin(克隆号V9)均购自福州迈新公司。
1.2 方法所有组织标本均经10%福尔马林固定,石蜡包埋,3 μm厚连续切片,然后用免疫组织化学EliVision法染色。免疫组化操作步骤严格按照试剂盒说明书进行。预处理:CD163、Vimentin和E-cadherin采用柠檬酸盐缓冲液(0.01 mol/L,pH 6.0)高温高压修复,TGF-β1采用EDTA高温高压修复;SMA无需修复。经DAB显色,苏木素复染,盐酸乙醇分化,氨水返蓝,脱水,透明,封片。以PBS代替一抗作阴性对照,已知阳性切片作阳性对照。
1.3 结果判定所有结果由有经验的肾脏移植病理医师判定。
用Masson三色染色来评估间质纤维化程度,在400倍镜下,每张切片随机选取25个视野,阳性染色面积占整个区域的比值即为纤维化的程度[2]。按Banff 2015[3]移植肾活检诊断标准分3级,Ⅰ级:轻度间质纤维化,累及范围<25%的肾实质;Ⅱ级:中度间质纤维化,累及范围达到26%~50%的肾实质;Ⅲ级:重度间质纤维化,累及范围50%的肾实质。
免疫组化结果的判读:CD163标记M2型巨噬细胞,胞质棕黄色判读为阳性,在400倍镜下,每张切片至少连续计数9个高倍视野,再取其平均值[4]。TGF-β1表达于肾小管上皮细胞的胞质,呈棕黄色;E-cadherin阳性着色位于肾小管上皮细胞的胞膜,棕黄色,为上皮标记物;Vimentin表达于间质和肾小管上皮细胞的胞质,为间质标记物;SMA标记活化的肌纤维母细胞,胞质棕黄色为阳性。阳性区域计算方法:在200倍镜下,每张切片至少计数6个中倍视野的肾实质,避开肾小球和大血管。将所选视野用蔡司显微镜进行拍照,再将图片输入Imagepro plus 6.0图像处理软件对图片进行定量检测各种蛋白的平均光密度值,即为TGF-β1、E-cadherin、Vimentin和SMA的相对表达量。
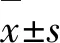
2 结 果
2.1 CD163、TGF-β1、E-cadherin、Vimentin和SMA在移植肾组织和正常肾组织中的表达CD163标记的M2型巨噬细胞、TGF-β1、Vimentin和SMA在移植肾组织中的表达显著高于正常肾组织,并且随着移植肾间质纤维化程度的加重,它们的相对表达量也逐渐增多,差异具有统计学意义(P均<0.05,表1、图1)。
上皮标记物E-cadherin在移植肾肾小管上皮细胞中的表达显著低于正常肾组织,并且随着移植肾间质纤维化级别的升高其表达逐渐减少,差异具有统计学意义(P<0.05,表1、图1)。
2.2 患者血肌酐和血尿素氮水平与移植肾组织间质纤维化程度的关系患者的血肌肝(creatinine, Cr)和血尿素氮(blood urea nitrogen,BUN)平均值随移植肾间质纤维化程度的增加而升高,与正常人的血Cr相比,差异具有统计学意义(P<0.01,表2)。
表1 各级纤维化的移植肾组织中SMA、CD163、E-cadherin、TGF-β1和Vimentin的相对表达
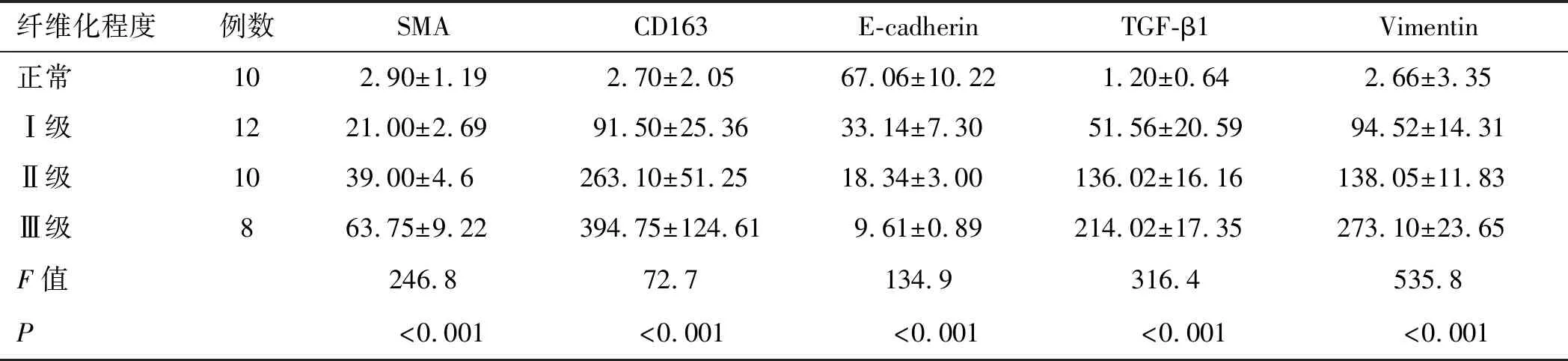
纤维化程度例数SMACD163E-cadherinTGF-β1Vimentin正常102.90±1.192.70±2.0567.06±10.221.20±0.64 2.66±3.35Ⅰ级1221.00±2.6991.50±25.3633.14±7.3051.56±20.5994.52±14.31Ⅱ级1039.00±4.6263.10±51.2518.34±3.00136.02±16.16138.05±11.83Ⅲ级863.75±9.22394.75±124.619.61±0.89214.02±17.35273.10±23.65F值246.872.7134.9316.4535.8P<0.001<0.001<0.001<0.001<0.001
图1 移植肾组织间质纤维化程度及CD163、TGF-β1、SMA、E-cadherin和Vimentin在移植肾组织中的表达情况
A :三色染色显示移植肾组织间质纤维化 (Masson,×200);B:移植肾组织中M2型巨噬细胞在间质中的聚集(EliVision,×200);C:移植肾组织肾小管上皮细胞胞质TGF-β1阳性表达(EliVision,×200);D:移植肾组织间质标记物SMA阳性表达(EliVision,×200);E:移植肾组织肾小管上皮细胞E-cadherin表达情况,部分肾小管上皮细胞E-cadherin表达缺失(EliVision,×200);F:移植肾组织肾小管上皮细胞间质标记物Vimentin阳性表达(EliVision,×200)。
表2 患者血肌酐、BUN与移植肾纤维化程度的关系

纤维化程度nCr(μmol/L)BUN(mmol/L)正常1065.8±3.994.87±0.84Ⅰ级12172.75±24.5516.78±2.19Ⅱ级10266.20±27.9928.10±3.07Ⅲ级8447.88±48.5242.88±4.52F值277.4297.9P<0.001<0.001
Cr:肌酐;BUN:血尿素氮
2.3 移植肾组织中M2型巨噬细胞数量与TGF-β1、E-cadherin、Vimentin和SMA表达及血Cr的相关性随着移植肾间质纤维化级别的升高,M2型巨噬细胞的数量逐渐增多,肾小管上皮细胞中TGF-β1和Vimentin及间质SMA相对表达量也逐渐增多,而肾小管上皮细胞中的E-cadherin则逐渐减少。M2巨噬细胞的数量与血Cr水平呈正相关(r=0.937,P<0.01,图2)。

图2 移植肾组织中CD163阳性的M2巨噬细胞的数量与上皮间质转化各指标及患者患者血清Cr水平的相关性
A:与间质SMA相对表达量的相关性;B:与肾小管上皮细胞Vimentin相对表达量的相关性;C:与肾小管上皮细胞E-cadherin相对表达量的相关性;D:与肾小管上皮细胞TGF-β1相对表达量的相关性;E:与患者血清Cr水平的相关性。
3 讨 论
由于免疫抑制剂的合理应用和手术水平的提高,肾移植已成为挽救肾功能衰竭患者生命的的重要手段。目前,肾移植近期效果已得到显著的改善,但远期效果仍有待提高。CAI的发病机制还不清楚。巨噬细胞在多种肾疾病中聚集是一种普遍现象,包括炎症性、非炎症性肾疾病和移植肾损伤。研究表明巨噬细胞可以被极化成两种不同的表型,即M1和M2。M1型巨噬细胞具有促炎表型,其特征主要表现为产生多种促炎症细胞因子,抵抗病原入侵,同时也会造成机体损伤,常见的M1型巨噬细胞标志物有iNOS、CD86、CD16/32、白细胞介素-1受体(interleukin-1 receptor,IL-1R)等;而M2型巨噬细胞则是替代途径活化的巨噬细胞,被认为是抗炎表型,常与组织修复有关,常见M2型巨噬细胞标志物有CD163、CD206、CD301等。随着巨噬细胞吞噬凋亡细胞,M1型可转化为M2型,后者可以产生IL-10和TGF-β,诱导肌纤维母细胞的增殖,促进纤维化的发生。调节从M1到M2转换的关键巨噬细胞受体是CD163,它是血红蛋白清道夫受体[5-8]。
研究表明CD163阳性的M2型巨噬细胞与多种肾脏疾病的慢性损伤有关,比如在糖尿病肾病(diabetic nephropathy,DN)中,肾间质浸润的M2型巨噬细胞与肾间质纤维化、肾小管萎缩、DN分级和肾功能损伤有关[9]。有人用小鼠单侧输尿管梗阻模型研究发现肾损伤后募集的巨噬细胞极化为M2型,M2型巨噬细胞可以促进肾纤维化。消除M2型巨噬细胞可特异性地抑制肾纤维化,而消除M1型巨噬细胞则无此作用[2]。最近有一项关于巨噬细胞极化在移植肾抗体介导的排斥反应的研究,实验分两组,M1型巨噬细胞极化组和M2型巨噬细胞极化组,结果发现M2型巨噬细胞极化组慢性移植性肾小球病变评分和血肌酐明显升高,而肾小球率过滤明显降低,与M1极化组比较,差异有显著性意义[10]。本研究结果显示CD163标记的M2型巨噬细胞在移植肾组织中的数量显著高于正常肾组织,并且随着移植肾间质纤维化程度的加重,M2巨噬细胞的数量也逐渐增多,与前述研究结果一致,说明M2型巨噬细胞在移植肾间质纤维化的发展中也起着一定的作用。
M2型巨噬细胞是如何促进移植肾间质纤维化发生发展的呢?众所周知,EMT在肾间质纤维化中起着重要作用。在EMT过程中,肾小管上皮细胞失去上皮细胞特性,上皮标记物E-cadherin表达减少,获得间质表型,迁移能力增强,这些转化的细胞从肾小管的微环境转移至间质内,促进肾纤维化的发生发展,同时成纤维细胞转化为肌成纤维细胞,这些细胞表达间质标记物SMA。有人将纤维母细胞与顺铂处理过的肾小管上皮细胞共培养发现,顺铂只能诱导肾小管上皮细胞发生不完全的EMT,而加入含有M2型巨噬细胞的培养基可以使顺铂诱导肾小管上皮细胞发生完全的EMT,进一步引起肾小管间质纤维化[11]。有两个TGF-β超家族成员是肾小管上皮细胞可塑性的关键调节者:TGF-β1和BMP7,TGF-β1是EMT的潜在诱导者[12]。吴莲凤等[13]研究发现M1型巨噬细胞可通过诱导TNF-α高表达促进肾组织早期炎症损伤,M2型巨噬细胞通过提高TGF-β1水平促进后期纤维增生性修复。另有研究表明,在输尿管梗阻早期肾脏中募集的巨噬细胞主要是M1型,然而,这些细胞很快极化为M2型巨噬细胞,后者释放大量的TGF-β1来提高EMT诱导的肾纤维化[14]。本研究结果显示:移植肾组织肾小管上皮细胞中TGF-β1和间质标记物SMA的表达显著高于正常肾组织,并且随着移植肾间质纤维化级别的升高而增多,而上皮细胞标记物E-cadherin的表达则逐渐减少,同时发现间质标记物Vimentin表达于CAI患者的肾小管上皮细胞中,并且随着损伤程度加重其表达逐渐增多。这说明在移植肾间质纤维化的发生发展过程中肾小管上皮细胞发生了EMT,TGF-β1与移植肾肾小管EMT有关。相关性分析显示移植肾组织中M2型巨噬细胞与TGF-β1、Vimentin和SMA的表达呈正相关,与患者血清Cr的平均值呈正相关,而与E-cadherin呈负相关,结合前人研究我们推测M2型巨噬细胞可能通过提高TGF-β1的表达水平来促进移植肾发生EMT,进一步促进移植肾间质纤维化,引起患者肾功能不全。
以往关于M2型巨噬细胞在肾脏EMT中的作用多集中在原发肾疾病或移植肾动物模型上,本研究初步探讨了M2型巨噬细胞在慢性移植肾肾损伤EMT中的作用,结果显示M2型巨噬细胞可以促进移植肾EMT的发生,引起肾纤维化和患者的肾功能不全,并且这一作用我们结合前人研究推测可能是通过提高TGF-β1的表达水平来诱导的。因此,我们认为在临床肾移植工作中可以定期检测移植肾组织中M2型巨噬细胞的聚集情况来预测肾移植患者间质纤维化发生的可能性,对临床防止慢性移植肾肾损伤有着重要意义。