腹腔镜子宫腺肌病灶切除术术后复发危险因素分析
彭燕蓁,段华,郭银树,成九梅,臧春逸,叶红
子宫腺肌病是育龄期女性常见疾病,临床症状主要表现为继发性痛经、月经增多和不孕症,严重影响患者的身心健康和生活质量。全子宫切除术是根治性的传统治疗方式。近年来随着发病年龄的年轻化趋势及保留器官生理功能的现代妇产科医学发展,子宫腺肌病保守性手术在临床上得到越来越广泛的应用[1-2]。其中,腹腔镜子宫腺肌病灶切除术已成为临床上最常用的手术方式[3-4]。但由于子宫腺肌病灶与周围正常子宫肌层组织无明显界限,术中很难被彻底切除,因此导致术后有较高的复发风险[1]。目前尚缺乏有关子宫腺肌病灶切除术术后复发危险因素的长期随访数据。本研究对在首都医科大学附属北京妇产医院(我院)妇科微创中心接受子宫腺肌病灶切除术的109例患者临床资料进行前瞻性随访分析,旨在探讨子宫腺肌病灶切除术术后复发相关临床危险因素,为术前评估治疗预后及制定个体化、精准治疗方案提供理论依据。
1 对象与方法
1.1 研究对象选择2010年1月—2015年1月在我院妇科微创中心行腹腔镜子宫腺肌病灶切除术的患者109例。其中合并子宫内膜异位症者36例,术中依据1985年美国生育医学会提出的“修正子宫内膜异位症分期法”对疾病进行分期;术中同时行子宫动脉阻断患者68例;术后给予促性腺激素释放激素激动剂(GnRHa)的患者36例。随访时间为1~5年,平均(3.25±1.98)年。患者年龄为 27~44岁,平均年龄(39.78±4.17)岁。术前病程 3~23个月,平均(7.11±4.32)个月。纳入标准:年龄小于<45岁;术后病理证实为子宫腺肌病;随访资料完整。排除标准:术前痛经视觉模拟评分法(visual analog scale,VAS)评分<4分;既往有子宫腺肌病手术治疗史;合并子宫内膜病变。
1.2 手术方法
1.2.1 腹腔镜子宫腺肌病灶切除术 在气管插管全身麻醉下进行,常规置入腹腔镜后探查盆腹腔情况,了解腺肌瘤部位、大小。先于瘤体与子宫交界处向正常子宫组织注射稀释的缩宫素10 U。根据瘤体大小选择切口形状及大小,于突出浆膜面的腺肌瘤病灶边缘作切口,用单极电钩尽量切净病灶,根据组织的外观、质地综合判断病变组织是否切净。镜下判断组织切净的标准为创面组织弹性好,色泽正常,质地柔软,血运好。切除病灶后用1号可吸收线连续或间断缝合子宫创面。
1.2.2 腹腔镜子宫动脉阻断术 于子宫峡部宫骶韧带上方2 cm处打开阔韧带后叶,避开输尿管,游离出一侧子宫动脉,双极电凝或1号薇乔线缝扎子宫动脉。同法处理对侧。
1.3 疗效判断标准
1.3.1 痛经程度判断 采用VAS进行疼痛评分,0分代表无痛,1分代表最轻微的疼痛,10分代表最严重的疼痛,记录患者术前及治疗后不同时点疼痛在标尺上的位置。
1.3.2 复发判断[5]痛经缓解6个月以上,再次出现痛经,VAS评分≥4分者。
1.4 随访术后1、6个月定期门诊复查,6个月以后每半年随访1次,通过门诊、电话随访,并填写问卷表。问卷表内容包括月经周期、月经经期、经量、痛经评分、盆腔B型超声(B超)等。
1.5 统计学方法采用SPSS 17.0统计软件进行统计分析。定性资料用例数(百分比)表示,组间比较采用卡方检验。术后累积复发率采用Kaplan-Meier法计算得出。术后复发危险因素采用单因素Log-rank检验及多因素Cox回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 术后累积复发率Kaplan-Meier法显示术后12个月累积复发率为14.9%,术后18个月累积复发率为18.0%,术后24个月累积复发率为22.7%,术后36个月累积复发率为25.7%。见图1。
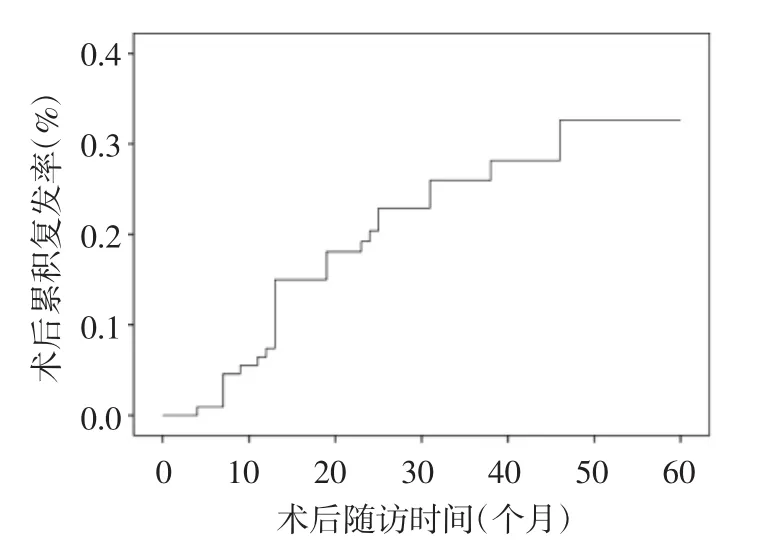
图1 子宫腺肌病灶切除术术后累积复发率
2.2 术后累积复发率的单因素分析
2.2.1 子宫腺肌病患者临床特征对复发率的影响 采用Log-rank检验,以术后复发为因变量,分别对患者年龄、产次、术前VAS评分、术前子宫体积、最大子宫腺肌瘤位置、最大子宫腺肌瘤直径、合并子宫内膜异位症情况(无、Ⅰ、Ⅱ期及Ⅲ、Ⅳ期)进行单因素分析,结果显示不同年龄及术前子宫体积患者术后复发率比较差异有统计学意义(P<0.05),而其余因素对术后复发率均无显著影响(均P>0.05)。见表1。
2.2.2 术前药物治疗对术后复发的影响 Log-rank检验结果显示,术前应用GnRHa治疗组术后12个月、24个月、36个月的累积复发率分别为10.4%、21.4%和24.8%,与术前未用药组比较差异无统计学意义(P>0.05)。见表 1。
2.2.3 子宫动脉阻断对术后复发的影响 术中同时行子宫动脉阻断患者术后12个月、24个月、36个月的累积复发率分别为15.0%、22.8%和26.2%,未行子宫动脉阻断患者术后复发率为分别14.3%、22.1%和22.1%,差异无统计学意义(P>0.05)。见表1。
2.2.4 术后药物治疗对术后复发的影响 Log-rank检验结果显示,术后GnRHa治疗患者术后12个月、24个月、36个月的累积复发率分别为10.8%、16.8%和20.5%,较术后未用药组明显降低,差异有统计学意义(P<0.05)。见表 1。

表1 术后复发相关危险因素的单因素分析
2.3 术后累积复发率的多因素分析术后复发危险因素Cox回归分析结果显示,患者的产次、术前VAS评分、最大子宫腺肌瘤直径、最大子宫腺肌瘤位置、术前GnRHa治疗、是否联合子宫动脉阻断、合并子宫内膜异位症等均不是增加术后复发率的危险因素(P>0.05);患者年龄小、术前子宫体积增大及术后未用药治疗是术后复发率增加的危险因素(P<0.05),见表2。年龄每增加1岁,术后复发风险就降低10%。
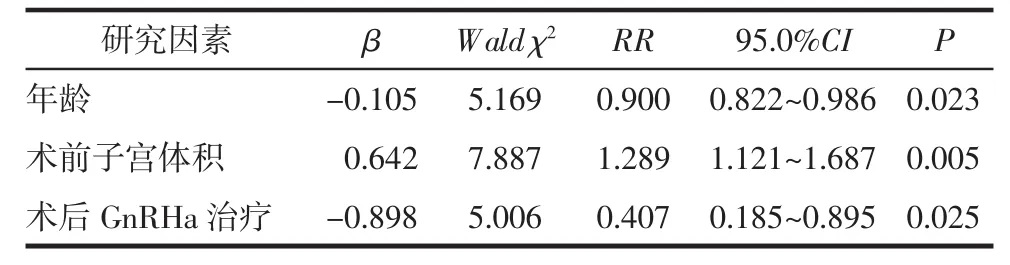
表2 术后累积复发率相关危险因素的Cox回归分析
3 讨论
3.1 子宫腺肌病的治疗保留器官功能及微创治疗是现代妇产科医学发展的两大趋势。子宫腺肌病是育龄女性常见的良性疾病,目前临床上常用的子宫腺肌病保留器官功能的治疗方法包括药物治疗、手术治疗、介入治疗及高强度聚焦超声(high intensity focused ultrasound,HIFU)治疗等[6-7]。药物治疗包括假绝经及假孕疗法,但由于药物的不良反应难以长期使用,因此常用于保守性手术前后的辅助治疗[8]。子宫动脉栓塞术(uterine arterial embolization,UAE)作为子宫腺肌病介入性保守治疗方法之一,临床有效率可达80.5%~91%,但其不能同时治疗合并存在的盆腔子宫内膜异位症,对卵巢功能及生殖预后也存在不利影响[9]。HIFU是近年来新兴的治疗良恶性肿瘤的无创性技术[6],通过利用超声波的物理学特点致使靶区腺肌病组织发生不可逆的凝固性坏死,从而达到消除病灶的目的。目前多项临床研究已证实其安全性及有效性,但此种治疗同样存在不能同时处理盆腔子宫内膜异位症致痛经缓解不满意的弊端,病灶部位、血流丰富及弥漫性的子宫腺肌病灶均可成为影响治疗效果的不利因素。
随着腹腔镜技术的普及和器械设备的发展完善,腹腔镜子宫腺肌病灶切除术是临床应用最为广泛的保守性治疗方法。但由于子宫腺肌病的疾病特点,术后存在复发风险,成为困扰医生及患者的重要问题。关于腹腔镜子宫腺肌病灶切除术的术后复发率,文献报道不一,波动于 10.2%~41.7%[3,10-11],可能与纳入的病例数、应用的统计方法、随访时间不同等因素有关。本研究结果显示,术后1年累积复发率为14.9%,术后2年累积复发率为22.7%,术后3年累积复发率为25.7%,提示腹腔镜子宫腺肌病灶切除术有较高的术后复发率,高于腹腔镜子宫肌瘤剔除术的术后复发率,分析其原因可能是子宫腺肌病灶边界不清,手术更难以切除干净以及术后致病因素仍然存在等。
3.2 子宫腺肌病的复发相关危险因素有关腹腔镜子宫腺肌病灶切除术术后复发危险因素的研究国内外相关报道少见。Yu等[12]研究发现患者术前血清CA125水平、合并子宫内膜异位症、术后未使用GnRHa治疗是术后复发的危险因素,而年龄、孕次、体质量指数、剖宫产史、术前子宫体积、合并子宫肌瘤对术后复发无显著影响。本研究结果与之不同的是,年龄、术前子宫体积是子宫腺肌病灶切除术后复发的独立危险因素,而术前VAS评分、术前GnRHa治疗、子宫动脉阻断、子宫腺肌瘤位置及合并子宫内膜异位症对术后复发率无明显影响。
子宫腺肌病是雌激素依赖性疾病,雌激素水平随年龄增加明显降低,子宫腺肌病发生率也下降,由此可解释本研究中年龄对于子宫腺肌病术后复发的影响。但近年来子宫腺肌病分子病因机制研究发现子宫局部雌激素的异常升高才是疾病发生的始动因素,而与机体血液中的雌激素水平无明显关系[13]。Yu等[12]的研究也显示年龄不影响术后复发。因此,年龄对术后复发的确切影响还需要进一步的大样本研究。
术前子宫体积常与疾病的严重程度呈正相关。子宫体积越大提示子宫腺肌病的程度及范围越大,手术彻底切除的可能性进一步降低,由此导致术后复发率增高。因此,术前子宫腺肌病程度越重,术后复发率可能越高。
GnRHa是临床常用的治疗子宫腺肌病的药物,其作用于下丘脑-垂体-性腺轴,通过竞争与垂体GnRH受体结合,抑制垂体分泌促性腺激素,导致体内持续低雌激素状态,从而使子宫腺肌病灶萎缩甚至消失。由于长期使用会导致低雌激素的相关不良反应,常作为术前术后的辅助用药。多项研究均显示,术后应用GnRHa能够减少复发率,延长复发时间[12,14],与本研究结果一致。因此,应重视子宫腺肌病患者的术后长期管理及合理应用GnRHa治疗。
综上所述,患者年龄小、术前子宫体积大是腹腔镜子宫腺肌病灶切除术术后复发的危险因素,术后给予GnRHa可以有效降低术后复发率,对于年轻、病变重的患者应重视术后辅助药物治疗,加强随访。

