miR-205 调控HMGB1 减轻LPS 诱导的小鼠 急性肾损伤
欧阳晓琴,刘承玄,任德伟
(重庆市中医院肾内科,重庆400021)
脓毒症是由感染引起的机体反应失调而导致的器官功能障碍综合,具有高死亡率的特点,是临床上重症医学科常见的棘手疾病[1]。急性肾损伤(acute kidney injury, AKI)是脓毒症患者最常见合并症之一,既往研究表明严重败血症患者AKI 发生率可高达60%,并且治疗效果欠佳,患者预后较差[2]。脓毒症并发AKI 的发生发展的具体机制目前直接尚不明确。微小RNA(microRNA,miRNA)是一类长度大约22nt 的非编码小分子RNA,通过在转录后水平调控靶基因的表达影响机制各种疾病的发生进展[3]。研究证实miRNA 在脓毒症和AKI 早期诊断、预后评估及发生进展中发挥着重要的作用[4]。MiR-205 是近年来发现的miRNA 家族重要成员之一,其定位于人染色体1q32.2,以往miR-205 的研究主要集中在其与恶性肿瘤关系方面[5]。近期研究显示miR-205在脓毒症并发AKI 患者血清中表达水平明显降低,是脓毒症并发AKI 患者预后的独立影响因素[6],但其作用机制尚不清楚。本研究我们通过LPS 刺激建立脓毒症小鼠AKI 动物模型,观察miR-205 在脓毒症小鼠AKI 肾组织中表达变化,并且进一步探讨其可能的作用机制。
材料与方法
1 主要试剂
LPS 购自美国Sigma 公司; Scr 和BUN 检测试剂盒购自南京建成生物公司;BCA 蛋白测定试剂盒购自江苏碧云天公司;TNF-a、IL-1β、IL-6 检测试剂盒(ELISA)购自武汉博士德公司;TRIzol 试剂、LipofectamineTM2000 购自美国Invitrogen 公司;逆转录试剂盒、qRT-PCR 试剂盒购自大连宝生物公司;所有qRT-PCR 引物购自广州锐博生物技术公司;抗高迁移率族蛋白 B1(HMGB1)一抗、抗内参蛋白GAPDH一抗及HPR标记的二抗购自美国Santa Cruz公司。miR-205 mimics 及阴性对照miR-scramble、野生型和突变型HMGB1 荧光素酶报告基因质粒HMGB1-WT 和HMGB1-MUT 购自上海吉玛制药公司;HEK-293 细胞购自美国ATCC 公司;荧光素酶检测试剂盒购自美国Promega 公司。
2 实验动物分组及AKI 动物模型建立
健康雄性SPF 级C57BL/6 小鼠40 只,鼠龄8周,体质量21~25g,购自重庆医科大学动物实验中心,所有小鼠饲养于60%~70%的相对湿度室温环境常规饲养。本研究经医院伦理委员会批准。所有小鼠随机分为空白对照组、模型组(LPS)、阴性对照组(LPS+miR-scramble)、干预组(LPS+miR-205 mimics),每组10 只,模型组、阴性对照组和干预组采用腹腔注射LPS(10mg/kg)的方法建立脓毒症AKI 模型[7],对照组仅腹腔注射等体积的生理盐水。造模后,干预组和阴性对照组连续4d 分别尾静脉注射miR-205 mimics 或miR-scramble 与LipofectamineTM2000(体积比1:1),对照组和模型组仅尾静脉注射等体积的生理盐水,造模后5d 麻醉后处死小鼠分离肾组织,一侧肾组织保存至-80℃冰箱保存,另一侧肾组织置于10%中性甲醛固定,经石蜡包埋制作5μm 厚连续切片。
3 血肌酐和尿素氮测定
造模后24h 取小鼠全血,4℃ 12000r/min 离心5 min 取血清,全自动生化仪检测血肌酐(serum creatinine, SCr)和尿素氮(urea nitrogen, BUN)水平。
4 肾组织病理学HE 染色观察
取石蜡切片二甲苯脱蜡1h,苏木素染色15min,PBS 冲洗3 遍,伊红复染色2min,切片乙醇脱水后二甲苯透明,中性树胶封片,高倍显微镜下观察。参考文献[8,9]对肾脏病理损伤进行评分:肾组织正常无损伤为0 分;受损面积<25%为1 分;25%≤受损面积<50%为2 分;50%≤受损面积<75%为3分;受损面积≥75%为4 分。
5 qRT-PCR 定量测定肾组织miR-205 水平
采用qRT-PCR检测。使用Trizol试剂提取肾脏组织总RNA,取获得的总RNA,按逆转录试剂说明书操作获得cDNA。取cDNA,按照qRT-PCR 试剂盒说明书配置反应体系及反应参数,反应条件:95℃ 10 min;95℃ 15 s、60℃ 1min,共40 个循环。miR-205引物序列:正向:5’- AATCCTTCATTCCACCGG -3’,反向:5’- GTGCAGGGTCCGAGGT -3’。内参U6 引物序列:正向5’-CTCGCTTCGGCAGCACA-3’,反向5-GCGAGCACAGAATTAATACGAC-3’。miR-205 水平以2-△△Ct法计算获得。
6 Western blot 检测肾组织HMGB1 蛋白表达
取肾组织研磨匀浆,加入RIPA 裂解提取组织总蛋白,BCA 法检测提取蛋白的浓度。取各组总蛋白30μg 进行上样,10 % SDS-PAGE 分离蛋白,半干转膜法将蛋白转至PVDF 膜,脱脂奶粉封闭液4℃封膜4h,TBS 缓冲液漂洗后,加入HMGB1 和GAPDH一抗,4℃孵育过夜,TBS 缓冲液漂洗,加入二抗孵育,化学发光液(ECL)显影,用Image J 软件对条带光密度进行半定量分析。
7 肾组织IL-1β、TNF-α、IL-6 水平ELISA 测定
取肾组织加入蛋白裂解液匀浆,4℃ 12000 r/min离心15 min,收集上清液。IL-1β、TNF-α、IL-6 水平测定按照ELISA 试剂盒说明书操作。
8 双荧光素酶报告基因检测miR-205 与HMGB1 的靶向关系
应用LipofectamineTM2000 脂质体转染试剂,将野生型质粒载体HMGB1-WT 和突变型质粒载体HMGB1-MUT 分别转染至HEK-293 细胞,同时将miR-205 mimics 和miR-scramble 单独转染至HEK-293 细胞,转染24h 后收集细胞并裂解细胞,应用荧光素酶试剂盒检测相对荧光素酶活性,分析靶基因的转录活性。
9 统计学分析
SPSS 21.0 软件进行统计分析,计量数据以(±s)表示,比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
结 果
1 miR-205 抑制LPS 对血清肌酐和尿素氮水平的升高
对血清肌酐和尿素氮进行全自动生化仪显示,小鼠腹腔注射LPS 使血清SCr 和BUN 水平均明显升高;与LPS 处理和LPS+miR-scramble 处理小鼠比较,LPS+miR-205 mimic 处理小鼠血清SCr 和BUN 水平均明显降低;LPS 处理与LPS+miR-scramble 处理小鼠比较,血清SCr 和BUN 水平无明显差异(表1)。
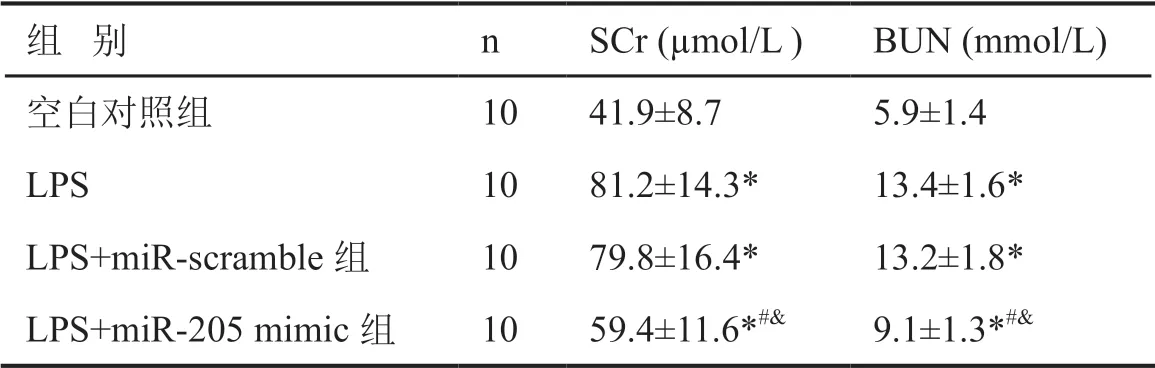
表1 MiR-205 对LPS 升高小鼠血清肌酐和尿素氮水平的影响Tab. 1 Effect of miR-205 on the increase of serum levels of creatinine and urea nitrogen in mice treated by LPS
2 miR-205 抑制LPS 对肾脏组织的病理损伤
小鼠腹腔注射LPS 使小鼠肾小管水肿、变性,肾小球毛细血管扩张充血,间质有大量炎性细胞浸润,肾脏组织病理损伤评分明显升高;与LPS 处理和LPS+miR-scramble 处理小鼠比较,LPS+miR-205 mimic 处理小鼠损伤表现明显减轻,肾脏组织病理损伤评分明显降低;LPS 处理与LPS+miR-scramble处理小鼠比较,肾脏组织病理损伤评分无明显差异(图1)。
3 miR-205 mimics抑制LPS所致的肾组织miR-205表达降低
对肾组织miR-205 进行qRT-PCR 检测显示,小鼠腹腔注射LPS 使肾组织miR-205 表达水平明显降低;与LPS 处理和LPS+miR-scramble 处理小鼠比较,LPS+miR-205 mimic 处理小鼠肾组织miR-205 表达水平明显升高;LPS 处理与LPS+miR-scramble 处理小鼠比较,肾组织miR-205 表达水平无明显差异(图2)。
4 miR-205 抑制LPS 对肾组织HMGB1 水平的升高
对肾组织HMGB1 蛋白进行Western blot 检测显示,小鼠腹腔注射LPS 使肾组织HMGB1 水平明显升高;与LPS 处理和LPS+miR-scramble 处理小鼠比较,LPS+miR-205 mimic 处理小鼠肾组织HMGB1 水平明显降低;LPS 处理与LPS+miR-scramble 处理小鼠比较,肾组织HMGB1 水平无明显差异(图3)。

图1. miR-205 对LPS 升高肾脏组织病理损伤的影响。A,HE 染色组织病理学检测,比例尺,50μm;B,病理损伤评分的统计学分析;**,P<0.01Fig.1 Effect of miR-205 on the increase of renal histopathological damage score in mice by LPS. A. HE staining examination for histopathology, scale bar, 50μm; B, statistical analysis for histopathological damage score; **, P<0.01

图2. miR-205 mimic 抑制LPS 所致的肾组织miR-205 表达降低。**,P<0.01Fig.2 Effect of miR-205 mimics on the decrease of the expression of miR-205 in kidney tissue. **, P<0.01
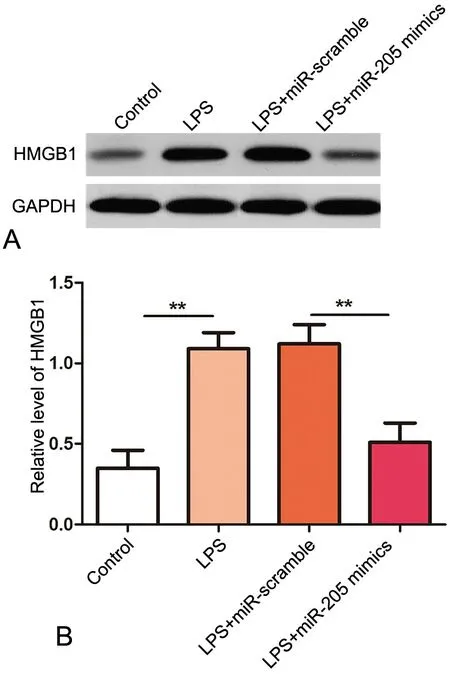
图3 miR-205 对不同实验组肾组织HMGB1 水平的影响。A,miR-205 对LPS 升高肾组织HMGB1 水平影响的代表性Western blot 检测结果;B,miR-205 对LPS 升高肾组织HMGB1 水平影响的统计学分析;**,P<0.01Fig.3 Effect of miR-205 on the increase of the expression of HMGB1 protein in kidney tissue. A, representative results of effect of miR-205 on the increase of HMGB1 level in kidney tissue; B, statistical analysis for effect of miR-205 on the increase of HMGB1 level in kidney tissue; **, P<0.01
5 miR-205 抑制LPS 对肾组织IL-1β、TNF-α、IL-6 水平的升高
对肾组织IL-1β、TNF-α、IL-6进行ELISA检测显示,小鼠腹腔注射LPS 使肾组织IL-1β、TNF-α、IL-6 水平明显升高;与LPS 处理和LPS+miR-scramble处理小鼠比较,LPS+miR-205 mimic 处理小鼠肾组织IL-1β、TNF-α、IL-6 水平明显降低;LPS 处理与LPS+miR-scramble 处理小鼠比较,肾组织HMGB1蛋白表达水平无明显差异(表2)。

表2 miR-205 对LPS 升高小鼠肾组织IL-1β、TNF-α、IL-6 水平的影响Tab.2 Effect of miR-205 on the increase of IL-1β, TNF-α, IL-6 in kidney tissue in mice treated by LPS
6 HMGB1 是miR-205 靶基因
生物学信息网站TargetScan (http://www.targetscan.org) 预测miR-205 的可能靶基因为HMGB1(图4A)。双荧光素酶活性实验显示,miR-205 mimics可明显抑制野生型HMGB1 质粒的荧光素酶活性,即抑制HMGB1转录活性,对突变型HMGB1 质粒的荧光素酶活性无明显抑制作用(图4B),由此证明miR-205 能和HMGB1 的3’UTR 区结合,HMGB1 是miR-205 的作用靶基因。

图4 miR-205 作用于HMGB1 3’UTR 的荧光素酶活性分析。 A, miR-205 与HMGB1 的3’UTR 区存在结合位点TargetScan 分析;B,转染miR-205 mimic 对HMGB1 3’UTR 的荧光素酶活性的影响Fig.4 Luciferase activity analysis of miR-205 acting on HMGB1 3’UTR. A, target scan analysis for the binding site between miR-205 and1 HMGB1 3’UTR; B, effect of miR-205 mimics on luciferase activity of HMGB1 3’UTR
讨 论
脓毒症相关性AKI 是一种由脓毒症引发的肾脏急性损伤,与缺血性AKI 不同,脓毒症相关性AKI在发病机制、病死率等方面存在显著差异,脓毒症相关性AKI 患者病死率较高[10]。目前研究认为炎性反应失衡是脓毒症相关性AKI 发生进展的重要机制之一,AKI 并非由于细菌或其他感染性微生物本身直接引发,而是由于感染造成的体内非特异性炎症反应失衡、炎症因子表达紊乱,进而造成包括肾脏在内的机体多脏器的损伤[11]。
miRNAs 是一种短链非编码RNAs,研究表明miRNA 在脓毒症相关性AKI 的发生、进展方面起着重要的调控作用,是其早期诊断和预后判断的敏感生物学标志物[12,13]。霍锐等[14]在研究中发现miR-29a 和miR-10a-5p 在脓毒症相关性AKI 28d 后死亡的患者血清中表达明显升高,并且具有良好的预测价值。Shen 等[15]报道miR-106a 在脓毒症相关性AKI患者和小鼠模型中明显升高,并且调控thbs2 参与其发生进展。Qin 等[16]发现mir-191-5p 通过抑制oxsr1对脓毒症相关性AKI 大鼠肾组织起到保护作用。近期Lin 等[6]发现miR-205 在脓毒症相关性AKI 患者血清中表达水平明显降低,并且是脓毒症并发AKI患者预后的独立影响因素,但具体作用机制并未进行具体研究。本研究中我们通过LPS 注射方式建立小鼠脓毒症AKI 模型,研究发现LPS 处理组小鼠血清SCr 和BUN 水平均升高,肾脏组织病理损伤评分升高,提示脓毒症AKI 模型建模成功。进一步我们也发现了小鼠肾组织中miR-205 表达升高,HMGB1蛋白表达降低,IL-1β 、TNF-α、IL-6 水平均明显降低,提示miR-205 可能参与了脓毒症AKI 的发生,并且与HMGB1 信号通路对炎症的调控有关。为了进一步验证,我们通过miR-205 模拟物上调了脓毒症AKI 小鼠肾组织中的miR-205 水平,研究显示伴随着小鼠肾组织miR-205 的表达上调,干预组小鼠血清SCr 和BUN 水平均明显降低,肾脏组织病理损伤评分下降,HMGB1 蛋白表达降低,IL-1β 、TNFα、IL-6 水平也明显降低,证实miR-205 对脓毒症AKI 小鼠肾脏有明显的保护作用,这种作用可能与调控HMGB1 信号通路对炎症的影响有关。
HMGB1 是高迁移率族蛋白家族成员,是一种真核细胞核内DNA 结合蛋白,其定位于人染色体13q12,在胞内其主要作用是稳定染色体结构并协助其功能,在胞外其主要作为炎症介质,通过识别RAGE、TLRs 等受体传递相关细胞信号,通过正反馈调节,引起机体IL-1β 、TNF-α、IL-6 等炎性细胞因子的释放和氧化应激反应[17]。近年来HMGB1 作为促炎因子参与炎症反应的进展已有大量的研究证实[18]。脓毒症AKI 患者血浆中HMGB1 水平明显升高,并且与患者预后有密切关系[19]。随着脓毒症严重程度的增加,肾细胞中HMGB1 水平增加,从而增强HMGB1 的促炎信号通路[20]。为了探索miR-205调控脓毒症相关性AKI 的具体作用机制,我们通过生物学信息网站TargetScan发现miR-205与HMGB1的3'UTR 区理论上存在结合位点。近期Wang等[21]也发现miR-205 能够通过靶向HMGB1 调控三阴乳腺癌细胞的侵袭和EMT。我们通过双荧光素酶活性实验发现miR-205 模拟物可明显抑制野生型HMGB1 质粒的荧光素酶活性,而对突变型HMGB1质粒的荧光素酶活性无明显抑制作用,证实HMGB1是miR-205 的直接作用靶基因,miR-205 对脓毒症相关性AKI 的保护作用可能是通过抑制HMGB1 介导的炎性反应通路实现的。HMGB1 在脓毒症发生发展以及转归预后方面起着关键作用[22,23],HMGB1介导的炎性通路也是脓毒症相关性AKI 发生发展的主要机制[24,25]。Hu 等[26]在研究中发现抑制脓毒症AKI 小鼠模型HMGB1 的表达,能够明显减轻肾脏的损伤,减低肾脏组织的炎症反应和氧化应激,从而改善脓毒症所致的AKI。
综述所述,miR-205 在脓毒症AKI 小鼠肾脏中呈现异常低表达,miR-205 通过调控HMGB1 改善LPS 诱导的急性肾损伤,为脓毒症性AKI 的治疗提供了新的方向。

