蛇床子素减轻HIV gp120诱发的周围神经病理痛
易智华,周聪发,雷琼琼,胡夏菊,李玲艳,梁尚栋
(南昌大学 1. 护理学院、2. 基础医学院,江西 南昌 330006)
人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染并发外周神经病理损伤时,表现为肢体远端感觉神经病变[1-2],主要症状为周围神经病理性疼痛,影响约60% HIV感染患者,随着病程延长,极度疼痛频现,严重者可丧失行走功能[3]。其发病率高、机制复杂、治疗困难,常规镇痛药副作用大[4]。因此,寻求安全高效药物,阐明其作用靶点,减轻HIV感染患者神经病理痛迫在眉睫。
HIV感染导致周围神经病变时,背根神经节(dorsal root ganglia, DRG)神经元和传入神经纤维均受损。DRG可将外周神经末梢感受的伤害性刺激信号传递到中枢神经系统[4]。HIV病毒包膜糖蛋白gp120可诱发周围神经的机械痛敏和热痛敏,研究表明,嘌呤2X受体可辅助gp120进入巨噬细胞,gp120与巨噬细胞的相互作用,最终导致神经病理痛的发生[5]。作者前期研究发现[6],表达在DRG神经元的嘌呤2X3受体(P2X3R)通过激活ERK信号通路,介导HIV gp120诱发的周围神经病理痛,应用P2X3R拮抗剂可明显减轻模型大鼠痛行为。中药单体蛇床子素(osthole,Ost)是传统中药蛇床子的主要有效成分之一,具有抗炎、抗病原微生物、神经保护等多种药理活性[7-8]。本研究通过建立gp120浸浴坐骨神经大鼠模型,观察Ost处理后,模型大鼠痛行为及大鼠DRG中P2X3R表达变化及作用机制,为治疗HIV gp120诱发周围神经病理痛,寻求毒副作用小、适合长期用药的天然药物提供实验基础。
1 材料与方法
1.1 材料
1.1.1实验动物与细胞 健康成年SD大鼠,♂,体质量(210±20)g,由南昌大学医学部实验动物科学部提供,动物使用许可证号:SYXK(赣)2015-0001。HEK293细胞购自中国科学院上海细胞库。
1.1.2试剂 Ost(美国Selleck Chemicals公司);ATP、gp120(美国Sigma Aldrich);P2X3R引物(上海生工生物);抗β-actin抗体、P2X3R抗体(以色列Alomone Lab);ERK、p-ERK抗体(美国CST);肿瘤坏死因子α受体(tumor necrosis factor α receptor, TNF-αR)抗体(美国Abcam);人pcDNA3.0-EGFP-P2X3R质粒由上海诺百生物公司构建,EGFP与P2X3R融合。
1.1.3仪器 BME-403 Von Frey机械刺激仪、BME-410C型热痛刺激仪(中科院生物医学工程研究所);全细胞膜片钳系统(美国Axon200B);7500型qPCR仪(ABI公司);倒置荧光显微镜(日本Olympus)。
1.2 方法
1.2.1神经病理痛大鼠模型的构建 大鼠适应性饲养1周,随机分4组(每组8只):假手术组(sham)、假手术加Ost处理组(sham+Ost)、gp120坐骨神经浸浴处理模型组(gp120)、gp120模型并给予Ost作用组(gp120+Ost)。gp120神经病理痛大鼠建模:100 g·L-1水合氯醛麻醉(3 mL·kg-1,腹腔注射)大鼠,无菌条件下,取大鼠左大腿后外侧切口,钝性分离坐骨神经,用250 μL HIV gp120(用含大鼠血清白蛋白浓度为1 mL·L-1的生理盐水溶解200 ng gp120)浸透的外科可吸收性无菌明胶海绵(祥恩,2 mm× 6 mm),疏松包裹在坐骨神经的三支分叉近端,缝合肌肉与皮肤。Sham组大鼠所用明胶海绵浸泡液不含gp120,其余同模型组。Sham+Ost组及gp120+Ost组大鼠于术前7 d及整个建模期灌胃给予Ost (40 mg·kg-1·d-1)。术后d 14将4组大鼠迅速断头,取左侧L4~L6 DRG备用。
1.2.2大鼠痛行为检测 建模术前(0 d)及术后d 1、3、5、7、9、11、14测定各组大鼠机械痛缩足反射阈值(paw withdrawal threshold, PWT)与热痛缩足反射潜伏期(paw withdrawal latency, PWL)。每次测量的时间和其它条件均保持一致。
1.2.2.1PWT检测 BME-404电子机械刺激仪,测试针尖端接触面直径0.6 mm,测痛范围0~50 g,分辨率0.05 g。大鼠置于铁丝网架上的透明有机玻璃盒中(20 cm×10 cm×30 cm)适应0.5 h,用测试针刺激大鼠左足底,从小力度开始,直到某个力度刺激大鼠引起缩足反应,电脑软件自动记录此次压力值,为有效阈值,相邻两次测量的间隔时间至少为3 min,刺激引起的反应(如舔足、甩腿等)完全消失后才进行下次测量。一共记录3次,3次的平均值即为PWT。
1.2.2.2PWL检测 采用BME-410C型全自动热痛刺激仪。将与上述相同的玻璃盒与大鼠放在3 mm厚的玻璃板上,热辐射灯照射大鼠左足底,记录从照射到出现抬腿的时间,一共测量3次,取3次均值作为PWL。每次切断时间为30 s,且间隔3 min以上,以防组织损伤。
1.2.3实时荧光定量PCR (qPCR) 检测 提取大鼠DRG总RNA,逆转录后进行qPCR反应。P2X3R上游引物:5′-CCAACAGAGTCATGGACAGT-3′,下游引物:5′-GGACAGAATCCTTGCATTTGA-3′;β-actin上游引物:5′-TGTCACCAACTGGGACGATA-3′,下游引物:5′-GGGGTGTTGAAGGTCTCAAA-3′。用2-ΔΔCT法计算P2X3受体mRNA相对表达量。
1.2.4蛋白印迹检测 将DRG置于加有200 μL组织裂解液(含PMSF)的1 mL匀浆器中,冰上反复研磨裂解后,置1.5 mL EP管,4 ℃、12 000×g离心10 min,取上清,加入6×loading buffer和DTT,混匀后煮沸5 min,-20 ℃保存备用。制备10%的SDS-PAGE凝胶,蛋白上样、电泳、转膜、封闭、洗膜,一抗4 ℃孵育过夜。次日洗膜后,二抗孵育1 h,ECL发光试剂盒显影,以β-actin为内参,Image-Pro Plus软件分析条带灰度值。
1.2.5免疫组织化学检测 PBS清洗DRG,4%多聚甲醛固定48 h后,梯度乙醇脱水、二甲苯透明、浸蜡、石蜡包埋、切片(厚5 μm),37 ℃烘干2 h后,室温保存备用。实验时,切片60 ℃烘烤30 min脱蜡,Triton X-100作用15 min, H2O2作用5 min,5%山羊血清封闭1 h,P2X3R一抗4 ℃孵育过夜,辣根酶标记链霉卵白素工作液室温孵育30 min,DAB显色2 min,PBS终止显色反应,梯度乙醇脱水,二甲苯透明,中性树胶封片,倒置显微镜下拍片。Image-Pro Plus软件分析每组(n=8)切片中神经元染色光密度值,每张切片选取一个有代表性的视野,统计各组切片中P2X3受体阳性反应差异。
1.2.6HEK293细胞培养与P2X3受体质粒转染 常规复苏HEK293细胞,在37 ℃含有5% CO2的细胞培养箱中培养,传代,均匀接种在35 mm培养皿中,使细胞密度为1×105个/cm2,继续培养至细胞达到80%~90%汇合度,瞬时转染人pcDNA3.0-EGFP-P2X3R质粒(Lipofectamine 2000,Invitrogen),孵育6 h。以Opti-MEM洗涤细胞,并孵育24~48 h。倒置荧光显微镜下观察各皿细胞GFP荧光显色情况,每皿细胞寻找3个具有代表性的视野,观察100个细胞,计算阳性细胞百分比。转染后1~2 d进行全细胞膜片钳记录。
1.2.7全细胞膜片钳记录实验 荧光倒置显微镜下实施全细胞膜片钳技术,记录全细胞电流。两步法拉制微电极,电极液充灌微电极,微电极填充液由(以mmol·L-1计)K葡萄糖酸盐145、EGTA 0.75、HEPES 10、CaCl20.1、MgATP 2、Na3GTP 0.3组成的内部溶液。用含有(以mmol·L-1计)NaCl 126、KCl 2.5、葡萄糖10、MgCl21.2、CaCl22.4、NaHCO318的细胞外溶液连续灌注。操纵微电极尖端接近细胞表面,微电极内施加负压,形成高阻封接(1~10 GΩ),钳制电压于-60 mV,吸破细胞膜。药物浓度为ATP 100 μmol·L-1、Ost 100 μmol·L-1,药物灌流管直径0.2 mm,管口距记录细胞约100 μm。给药时间2 s,洗脱时间4 min。数据以2 Hz低通滤波,以5 kHz数字化,并使用Axopatch 200B膜片钳放大器、Digidata 1440A 接口和pClamp10.3软件(Axon仪器)存储在实验室计算机中。SigmaPlot软件绘制细胞电流变化图。

2 结果
2.1 Ost抑制gp120模型大鼠DRG中P2X3受体的表达上调如Fig 1所示,gp120模型组DRG中P2X3R mRNA及蛋白表达水平较sham组明显增加(P<0.01),gp120+Ost组P2X3R mRNA及蛋白表达水平较gp120模型组降低(P<0.01);sham与sham+Ost组之间无差异(P>0.05)。
**P<0.01vssham group;##P<0.01vsgp120 group
2.2 Ost改善gp120模型大鼠机械痛敏(PWT)与热痛敏(PWL)如Fig 2所示,造模前各组间PWT及PWL的基础值差异无显著性(P>0.05)。术后d 3 开始,gp120模型大鼠PWT及PWL相比sham组日趋降低(P<0.05或P<0.01);gp120+Ost组大鼠PWT及PWL较gp120模型组增加(P<0.05,P<0.01)。

Fig 2 Osthole relieved mechanical(A) and thermal hyperalgesia(B) in gp120 treated rats
*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vsgp120 treated group
2.3 Ost降低gp120模型大鼠DRG中P2X3受体上调的免疫反应性免疫组织化学染色对各组大鼠L4~L6 DRG P2X3受体进行形态学检测,Fig 3结果显示,P2X3受体表达在神经元上,且gp120组P2X3受体表达较sham组升高(P<0.01),gp120+Ost组P2X3受体表达较gp120组降低(P<0.01);sham组与sham+Ost组比较差异无显著性(P>0.05)。
2.4 Ost降低gp120模型大鼠DRG中TNF-αR表达Fig 4的蛋白印迹结果显示,gp120模型组大鼠DRG 中TNF-αR表达水平较假手术组明显增加(P<0.01);gp120+Ost组TNF-αR表达水平较gp120模型组降低(P<0.01);sham组与sham+Ost组TNF-αR表达水平差异无显著性(P>0.05)。

Fig 3 Effects of osthole on expression of P2X3receptor immunoreactivity in L4~L6 DRGs
Arrows indicate P2X3receptor positive neurons.**P<0.01vssham group;##P<0.01vsgp120 treated group.

Fig 4 Osthole decreased expression of TNF-αR protein in DRG of gp120 treated rats n=6)
**P<0.01vssham group;##P<0.01vsgp120 group
2.5 Ost下调gp120模型大鼠DRG中ERK的磷酸化水平如Fig 5所示,各组大鼠DRG中ERK1/2的蛋白表达水平无明显差异;p-ERK1/2的表达水平,gp120模型组较sham组明显增加(P<0.01),gp120+Ost组较gp120模型组降低(P<0.01);sham与sham+Ost组无差异。

Fig 5 Effects of osthole on expression of ERK1/2 and p-ERK1/2 in L4~L6 DRGs n=6)
**P<0.01vssham group;##P<0.01vsgp120 group
2.6 Ost抑制HEK293细胞ATP激动电流Fig 6的全细胞膜片钳记录实验显示,Ost降低转染pcDNA3.0-EGFP-P2X3R质粒的HEK293细胞ATP的激动电流。
3 讨论
已有研究表明,周围神经应用gp120后可产生机械痛觉过敏行为[9],提示gp120可能是HIV感染引发神经病理痛的重要因素[4]。本研究结果显示,用gp120浸浴的海绵作用于坐骨神经后,大鼠的机械痛敏、热痛敏与假手术组比较逐渐增强。同时,gp120模型大鼠DRG蛋白印迹实验、免疫组织化学与qPCR实验发现,P2X3受体蛋白与mRNA表达较假手术组明显升高,说明P2X3受体上调与gp120诱发的痛行为有关。Ost处理后,gp120模型大鼠DRG中P2X3受体蛋白与mRNA表达均较未处理的gp120模型大鼠降低,且Ost处理后大鼠机械痛敏与热痛敏减弱。研究结果提示,Ost可降低P2X3受体表达而影响大鼠机械痛敏与热痛敏行为。

Fig 6 Effects of osthole on ATP-activated current in HEK293 cells transfected with hP2X3 receptor
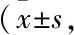
ATP作为受损细胞和感觉神经末梢释放的递质[10],可激活神经元上的P2X3受体[11],增加神经元的异常兴奋,导致神经病理痛。HIV gp120可直接或间接刺激神经系统释放促炎性细胞因子,如TNF-α等[4, 12-13],它们可激活神经元上的TNF-α受体,从而增加神经元的兴奋性,导致炎性反应加重。本研究结果显示,gp120模型大鼠DRG中TNF-α受体表达较假手术组增加,说明gp120处理可诱发神经系统炎症,诱发模型大鼠出现神经病理痛行为。gp120+Ost组大鼠DRG中TNF-α受体表达较gp120模型大鼠降低,提示Ost可能通过其抗炎作用,减轻gp120诱发的机械痛敏与热痛敏。
ATP是神经系统重要递质。HEK293细胞无功能性受体表达,常作为转染相关受体进行功能研究的工具。本研究发现,Ost可降低转染pcDNA3.0-EGFP-P2X3R质粒的HEK293细胞ATP激动电流,提示Ost通过阻断P2X3受体的激活,抑制神经元的异常放电,从而减轻机械痛敏和热痛敏。免疫组织化学实验结果表明,P2X3受体主要表达在DRG神经元上,提示Ost可影响gp120对神经元的病理性作用,从而影响gp120引发的P2X3受体激活。
ERK的磷酸化代表其信号通路的激活,参与初级传入神经受损引起的疼痛信号传递[14]。因此,阻断初级感觉神经元中ERK的活性可减轻机械痛敏和热痛敏。研究表明,P2X3受体激活之后,ERK1/2介导的信号转导通路也被激活,进而发生疼痛[14-15]。本研究结果中,HIV gp120模型大鼠DRG中 p-ERK1/2与ERK1/2蛋白条带光密度比值较假手术组更高,说明DRG中ERK1/2的磷酸化与P2X3受体介导的gp120引发的神经病理痛有关。Ost处理后,模型大鼠DRG中 p-ERK1/2与ERK1/2蛋白表达较gp120模型大鼠明显降低,结果提示Ost下调P2X3受体表达,进而抑制ERK1/2的磷酸化,使机械痛敏与热痛敏减轻。
总之,HIV gp120作用于周围神经可导致DRG中P2X3受体表达升高,gp120处理增加促炎性因子的释放,上调的P2X3受体及促炎因子作用可导致DRG神经元敏化,造成gp120诱发的神经病理痛。Ost通过降低gp120引起的DRG中P2X3受体表达上调,通过减少促炎因子TNF-α的释放而减少TNF-αR的激活,抑制ERK1/2的磷酸化,阻断疼痛信号传递通路,减轻gp120引起的机械痛敏与热痛敏。
(致谢:本研究在江西省高等学校基础医学重点实验室、南昌大学基础医学研究所及南昌大学基础医学院生理学实验室完成,感谢支持!)

