滋肾通络方对胶原性关节炎小鼠Th17/Treg细胞分化及平衡的影响
钱飞亚,杨 培,张明菲,许阿兰,王 祥,周学平,黄 艳,周玲玲
(南京中医药大学药学院,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的慢性全身性自身免疫性疾病[1]。目前,西医治疗RA主要使用非甾体抗炎药、慢作用抗风湿药、生物制剂等,虽有一定疗效,但存在不同程度的不良反应[2]。中医药在治疗难治性疾病方面具有独特优势。滋肾通络方(ZishenTongluo formula, ZTF)是根据国医大师周仲瑛教授临床应用几十年的经验方(清络通痹方)精简而成,前期研究发现,ZTF和原方比较具有相似的治疗效果和良好的安全性,其可明显抑制RA相关的炎性因子释放[3],但具体的作用环节尚不明确。
辅助性T细胞(T helper cell,Th)的活化是RA重要的病理机制之一,其可以分化为多种亚型,如Th1、Th2、Th17、调节性T细胞(regulatory T cell,Treg)等。Th细胞不同亚型可分泌相应的细胞因子,在全身和局部免疫平衡中发挥着重要的调节作用。新近的研究表明,Th17/Treg细胞的分化失衡在RA中起着关键作用[4]。Th17细胞分泌的白细胞介素17(interleukin 17, IL-17)能够促进炎症的发展,而Treg细胞能够分泌IL-10,通过抑制免疫应答,阻止炎症的发展,两者在发育和功能上起着相互拮抗的作用,调控Th17/Treg细胞的分化平衡可成为防治RA的重要策略。因此,在前期研究基础上,本实验拟以Th17/Treg为切入点,通过建立小鼠胶原性关节炎(collagen-induced arthritis,CIA)模型[5],重点观察ZTF对RA中Th17/Treg细胞的分化和平衡的影响,以及对相应细胞因子的干预作用,以期进一步阐明其重建RA免疫平衡的可能机制。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级DBA/1 ♂小鼠,18只,6~8周龄,购自南京大学模式动物所,许可证号:SYXK(苏)2014-0001。
1.1.2药物与试剂 滋肾通络方:青风藤、雷公藤、生地黄、炙僵蚕和三七按15 ∶15 ∶15 ∶10 ∶3比例混合制成水提液,每升含生药量0.84 kg。牛Ⅱ型胶原(type Ⅱ collagen,CⅡ),美国Chondrex公司产品;完全弗氏佐剂(complete Freund’s adjuvant,CFA)、不完全弗氏佐剂(incomplete Freund’s adjuvant,IFA),均为美国Sigma公司产品;IL-10和IL-17 ELISA试剂盒,南京建成生物工程有限公司产品;抗小鼠CD4-FITC(批号7017982)、CD25-APC(批号7235686)、CD127-PE(批号5286644)、IL-17A-PE(批号7180908)、CD4磁珠(批号8211931),均为美国BD公司产品。
1.1.3仪器 BSA224S-CW型电子天平(赛多利斯科学仪器有限公司);5417R型低温离心机(德国Eppendorf公司);FACS Calibur流式细胞仪(美国Becton-Dickinson公司);HH-6型恒温水浴锅(上海精宏实验设备有限公司);SyneRgy 2型多功能酶标仪(美国BioTek公司);荧光显微镜(日本尼康公司);7500型荧光定量PCR仪(美国ABI公司)。
1.2 方法
1.2.1小鼠CIA模型的建立[6]将CⅡ溶于0.01 mol·L-1的冰醋酸中,配制成2 g·L-1的溶液,4 ℃过夜,将溶解的CⅡ与CFA以1 ∶1比例混和,并充分乳化(在冰上操作)。在DBA/1小鼠尾根靠后处,皮内注射100 μL混合乳剂进行初次免疫,当天记为d 1。d 21将CⅡ与IFA等比混匀乳化,尾根部注射100 μL进行加强免疫。
1.2.2分组及给药 DBA/1小鼠18只,12只建立CIA模型,其余6只作为正常对照组。d 21将模型动物随机分为模型组和ZTF组。ZTF组每日灌胃给予水煎液8.4 g生药·kg-1,给药体积为10 mL·kg-1,正常对照组和模型组给予等体积生理盐水,连续给药4周。
1.2.3一般情况观察 每天观察动物一般状况,如饮食、行为活动、体质量等。
1.2.4关节炎症评分[7]小鼠再次免疫后,每4 d观察各组小鼠关节处的病变情况,进行小鼠关节炎指数评分。关节炎指数评分标准:0=正常;1=踝关节出现红斑和轻微肿胀;2=足掌、踝关节出现红斑和轻微肿胀;3=足掌、踝关节出现红斑和中度肿胀;4=足掌、踝关节出现红斑和重度肿胀,伴有关节畸形或僵直。每只小鼠评分最高16分。
1.2.5样本取材 于末次给药后1 h,眼眶后静脉取抗凝血,分离血浆用于细胞因子水平的检测;加入淋巴细胞分离液,分离T淋巴细胞用于Th17/Treg细胞的检测;分离脾脏单核细胞,进行Th17/Treg细胞及细胞因子mRNA表达的检测;取踝关节,进行病理组织学检查。
1.2.6踝关节病理组织检查[7]小鼠踝关节用4%多聚甲醛固定,脱钙液脱钙后,进行石蜡包埋,切片,苏木精伊红染色,光镜下观察关节病理学变化,并分别从滑膜细胞增殖、细胞侵蚀、血管翳形成、骨质侵蚀和炎症程度进行评分。①滑膜细胞增殖评分:0=无增殖;1=轻微增殖;2=中度增殖;3=过度增殖。②细胞侵蚀评分:0=无侵蚀;1=较少局部侵蚀;2=广泛局部侵蚀;3=广泛侵蚀到关节囊。③血管翳评分:0=无改变;1=两个部位出现血管翳;2=四个部位出现血管翳,伴有软骨表面的侵蚀;3=四个以上部位出现血管翳。④炎症评分:0=正常;1=轻度炎症;2=中度炎症;3=重度炎症。
1.2.7血浆IL-17、IL-10水平检测 采用ELISA试剂盒,按照说明书要求,检测血浆中IL-17、IL-10的水平。
1.2.8外周血Th17/Treg细胞的检测 新鲜抗凝血采用淋巴细胞分离液分离得到淋巴细胞,用含10%血清的RPMI 1640培养液重悬计数。调整细胞密度为1×109·L-1,分别进行Th17细胞和Treg细胞的检测。Th17细胞:加入细胞刺激剂刺激4 h,加入抗CD4-FITC抗体1 μL,避光孵育20 min,加PBS清洗2次,加破膜剂,避光孵育20 min,加破膜洗液清洗2次,加入抗IL-17A-PE抗体2 μL,避光孵育30 min,用破膜洗液清洗2次。Treg细胞:加入对应抗CD4-FITC抗体1 μL,抗CD25-PE抗体2 μL,抗CD127-PE抗体2 μL,避光孵育30 min,加PBS清洗2次。上述处理后,均加入500 μL PBS重悬,流式细胞仪检测Th17细胞和Treg细胞比例。
1.2.9流式细胞术检测脾脏Th17/Treg细胞 无菌取小鼠脾脏,分离脾细胞,采用红细胞裂解液去除红细胞,以含10%血清的RPMI 1640培养液重悬细胞,计数。调整细胞密度为1×109·L-1,6孔板中加入1 mL细胞悬液,分别进行Th17细胞和Treg细胞的检测,方法同“1.2.8”。
1.2.10qPCR检测CD4+T细胞中相关mRNA表达 无菌取小鼠脾脏,分离脾细胞,采用红细胞裂解液去除红细胞,将脾细胞重悬于IMagTMBuffer中(2×1011·L-1),与CD4磁珠4 ℃避光孵育30 min,使用磁力架进行磁性分离。TRIzol法提取CD4+T细胞RNA,检测CD4+T细胞中IL-17、IL-10 mRNA表达情况,结果以2-ΔΔCT表示。引物序列见Tab 1。

Tab 1 Primer sequences for qPCR detection

2 结果
2.1 ZTF对CIA小鼠关节形态变化及病理组织学改变的影响如Fig 1A、1B所示,CIA小鼠于d 30,其四肢陆续出现红肿,肿胀程度和关节炎指数随时间延长而升高,与正常对照组比较差异有显著性(P<0.01);ZTF干预组小鼠的踝关节肿胀程度和关节炎指数逐渐下降,与模型组比较差异有显著性(P<0.05)。
如Fig 1C所示,正常对照组小鼠关节组织结构正常;模型组小鼠滑膜细胞大量增生,滑膜组织中出现大量炎性细胞,关节软骨表面被破坏,炎性细胞侵蚀骨组织;ZTF组小鼠滑膜增生减少,滑膜组织中炎性细胞浸润程度减轻,骨破坏减少。病理评分结果显示(Tab 2),与正常对照组比较,模型组小鼠炎症评分明显升高(P<0.01);与模型组比较,ZTF组小鼠滑膜细胞增殖、细胞侵蚀、血管翳形成、骨质侵蚀均明显改善(P<0.05),炎症评分明显降低(P<0.05)。提示ZTF能够减轻CIA小鼠的关节病变程度。
2.2 ZTF对CIA小鼠血浆中IL-17、IL-10水平的影响如Fig 2所示,与正常对照组比较,模型组小鼠外周血IL-17水平明显升高,IL-10水平明显下降(P<0.01);与模型组比较,ZTF组小鼠外周血IL-17水平下降,IL-10水平上升(P<0.05)。提示ZTF能够调节CIA小鼠外周血Th17/Treg细胞相关细胞因子的分泌。

Fig 1 Effect of ZTF on ankle swelling, arthritis index and histopathological changes in CIA n=6)
A:Ankle swelling;B:Arthritis index;C:Histopathological changes(HE×100).*P<0.05,**P<0.01vscontrol;#P<0.05vsmodel.
2.3 ZTF对CIA小鼠外周血Th17/Treg细胞比例的影响如Fig 3所示,与正常对照组比较,模型组小鼠外周血中Th17细胞比例明显升高(P<0.01),Treg细胞比例明显下降(P<0.01);与模型组比较,ZTF组小鼠外周血中Th17细胞比例明显下降(P<0.05),Treg细胞比例明显上升(P<0.05)。提示ZTF能够调节CIA小鼠外周血Th17/Treg细胞的平衡。
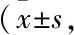
Tab 2 Effect of ZTF on pathological scoring of joint in CIA mice n=6)
**P<0.01vscontrol;#P<0.05vsmodel
**P<0.01vscontrol;#P<0.05vsmodel

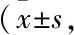
A: Th17; B: Treg; C: Th17 frequency and Treg frequency.**P<0.01vscontrol;#P<0.05vsmodel.

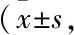
A: Th17; B: Treg; C: Th17 frequency and Treg frequency.*P<0.05vscontrol;#P<0.05vsmodel.

Fig 5 Effect of ZTF on CD4+ T cell-associated cytokine mRNA expression in spleen of CIA mice n=6)
*P<0.05vscontrol;#P<0.05vsmodel
2.4 ZTF对脾脏Th17/Treg细胞比例的影响如Fig 4所示,与正常对照组比较,模型组小鼠脾脏中Th17细胞比例明显升高(P<0.05),Treg细胞比例明显下降(P<0.05);与模型组比较,ZTF组小鼠脾脏Th17细胞比例明显下降(P<0.05),Treg细胞比例明显升高(P<0.05)。提示ZTF能够调节CIA小鼠脾脏Th17/Treg细胞的平衡。
2.5 ZTF对脾脏CD4+T细胞IL-17、IL-10 mRNA的影响如Fig 5所示,CIA小鼠脾脏CD4+T细胞中IL-17 mRNA表达明显升高(P<0.05),IL-10 mRNA表达明显下降(P<0.05);ZTF组小鼠脾脏CD4+T细胞中IL-17 mRNA表达明显下降(P<0.05),IL-10 mRNA表达明显上升(P<0.05)。提示ZTF能够调节CD4+T细胞中IL-17、IL-10 mRNA的表达。
3 讨论
RA病理机制复杂,目前普遍认为RA的发生和发展受到遗传、环境、感染、免疫等因素的影响,导致机体产生免疫紊乱。复方用药和整体调节是中医药的特色之一,通过合理配伍,可恢复机体的免疫平衡,发挥增效减毒的作用。ZTF是由国医大师周仲瑛教授的清络通痹方精简而来,由养阴清热(生地)、活血化瘀(炙僵蚕、三七)、祛风除湿(雷公藤、青风藤)3个功效单元组成。在前期大量临床和实验研究的基础上,本文进一步采用CIA小鼠验证ZTF对关节炎症状的改善作用,发现ZTF对CIA小鼠关节部位肿胀度、炎性因子浸润、滑膜增生、骨破坏症状均有一定的改善作用,这与我们以前在其他RA动物模型中的观察结果一致[8],再次证实了ZTF对RA具有良好的治疗作用。
CD4+T细胞作为机体重要的适应性免疫细胞,其在RA中的分化异常也日益受到关注[4]。临床研究表明,RA患者的CD4+T细胞分化为效应细胞的能力和对自身免疫调节的反应力与健康人相比都存在异常[9]。CD4+T细胞在激活后能够分化成不同的T细胞亚群,分泌不同的细胞因子,产生不同的功能。传统研究认为,调节Th1/Th2细胞之间的动态平衡能够抑制RA的发生与发展,但随着更多不同Th亚群的发现,单一的Th1/Th2细胞之间的关系并不能解释RA的复杂机制,Th17/Treg细胞之间的失衡对RA病情的发展也具有重要影响。Th17细胞主要分泌IL-17,其是一种强致炎因子,在浓度很低的情况下依然具有生物活性,且与受体存在很高的亲和力[10]。IL-17能够促进免疫细胞浸润到关节滑膜,刺激成纤维细胞等产生更多的促炎因子,并与IL-1、IL-6、TNF-α等促炎因子产生协同作用,促进血管翳形成和关节软骨破坏,进一步加重关节炎症[11]。Treg细胞能分泌IL-10,抑制TNF-α、IFN-γ等促炎因子的释放,也能直接发挥组织修复能力,促进机体的免疫耐受并维持免疫稳态[12]。因此,本文观察了ZTF对Th17和Treg细胞分泌细胞因子的影响,结果表明,CIA小鼠促炎性IL-17水平明显升高,抑炎性IL-10水平明显降低;而ZTF能够降低IL-17的水平,升高IL-10的水平。
为了明确这些细胞因子水平的改变是否是由于ZTF调节了Treg细胞和Th17细胞的平衡,本研究检测了CIA小鼠外周血Treg细胞和Th17细胞的比例。实验结果显示,ZTF可以升高CIA小鼠外周血Treg细胞比例,降低Th17细胞比例,逆转Th17和Treg细胞分化的失平衡。由于脾脏是机体最大的免疫器官,是T淋巴细胞储存和接受抗原刺激产生免疫应答的主要场所,也是调控机体细胞免疫和体液免疫的重要器官,本研究也检测了脾脏中Th17细胞和Treg细胞的比例。结果显示,CIA小鼠脾脏Th17细胞和Treg细胞的变化与外周血一致,提示Th17/Treg失平衡在RA外周和免疫器官中同时存在,而ZTF对外周和免疫器官中Th17/Treg的失平衡均有改善作用。本文进一步检测脾脏CD4+T细胞中IL-17、IL-10 mRNA的表达,发现ZTF可以逆转IL-17、IL-10 mRNA的异常表达,提示ZTF可能通过调节Th17/Treg细胞动态平衡,从而调节相应细胞因子的表达和分泌,进而对RA起到一定的防治效应。然而,Th17/Treg细胞的分化平衡具有明显的可塑性,除初始分化外,Th17细胞受环境因素影响,可分化为Th1细胞或转分化成Treg细胞[13-14];Treg细胞在相关信号蛋白和细胞因子作用下,能转分化为Th1、Th2样细胞或Th17细胞[15]。因此,下一步研究除进一步明确ZTF不同功效单元调节Th17/Treg细胞分化的具体靶点和机制外,还应关注再分化的平衡,这将有利于揭示ZTF重建RA免疫平衡的分子生物学基础,为临床合理组方用药提供理论依据。
综上所述,滋肾通络方以养阴清热、活血化瘀、祛风除湿为原则,能够明显延缓RA的发生与发展,其机制与调节RA的Treg/Th17细胞分化及平衡,从而调节相关细胞因子的分泌密切相关。

