稀释液及解冻条件对湖羊冻精质量的影响
吕松洁,张树山,戴建军,孙玲伟,葛 雷,梁 菲,张德福*
(1上海海洋大学水产与生命学院,上海201306;2上海市农业科学院畜牧兽医研究所,上海 201106;3上海市农业遗传育种重点实验室动物遗传工程研究室,上海 201106;4浙江省医学科学院生殖生理研究所,杭州 310013)
21世纪以来,人工授精技术越来越多地应用在畜牧生产上,在集约化、规模化生产中效果突出。冻精便于储存和运输,减少空间和时间对人工授精的制约,可大大提高良种的利用率,对繁育工作有重要意义[1]。家畜精液冷冻技术研究始于1952年,由Polge[2]等首次成功应用并繁育出小牛,之后在猪、牛等家畜上得到广泛应用[3-4]。我国于20世纪70年代开始研究山羊和绵羊精液冷冻技术,解冻后活率约35%[5]。人工授精受胎率低是目前绵羊冻精推广应用面临的主要问题。影响受胎率的因素有很多,一方面绵羊精子易受化学毒性、温度变化、氧化、渗透压和细胞机械等损伤[6],另一方面冻精稀释液、冻精制作和解冻程序等各个环节均影响冻精品质[7]。湖羊是皮、毛、肉兼用的绵羊品种,经济效益高,在我国分布范围广,本研究拟在前期相关工作基础上,通过交叉试验,进一步筛选最佳稀释液配方和最适解冻条件,为提高湖羊的精液冷冻技术提供一定参考。
1 材料与方法
1.1 实验动物
选取上海永辉羊业有限公司的4头健康、2.5岁、性成熟的湖羊种公羊,圈养,每日定时饲喂精饲料和草料。
1.2 稀释液配制
稀释液的配方如表1所示。1、2、3、5、6、7号稀释液配制方法为:称取各成分,定容至100 mL,混匀;取80 mL,加入20 mL卵黄,混匀;取94 mL,加入6 mL甘油,混匀;加入双抗200 IUmL。4号稀释液配制方法为:称取各成分,定容至85 mL,混匀;加入15 mL卵黄,混匀;再取94 mL,加入6 mL甘油,混匀;加入双抗200 IUmL。1—7号稀释液配置后,按每份15 mL进行分装,-20 ℃保存。
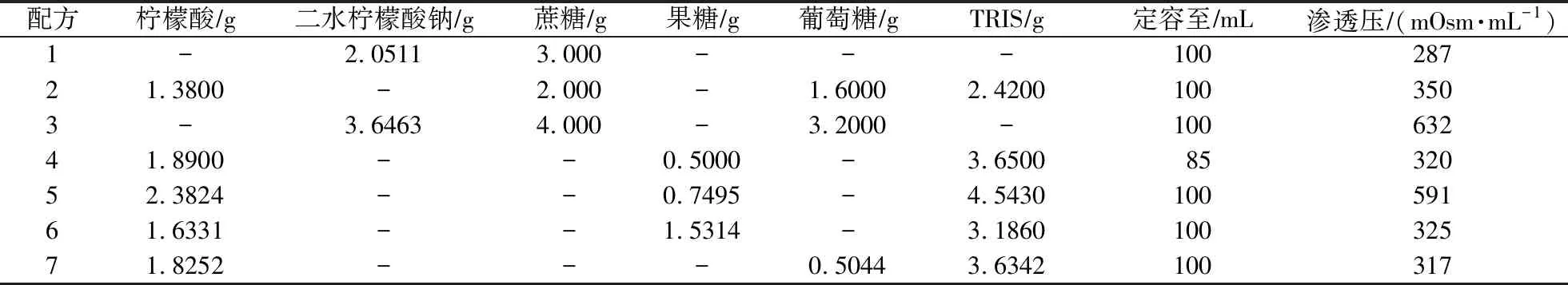
表1 湖羊冻精冷冻稀释液配制
1.3 精液处理
1.3.1 精液采集
采用假阴道法采集4头种公羊精液于试管中,37 ℃水浴恒温保存,现场立即进行常规品质检查[8],活力达到80%以上的精子用于后续试验操作。
1.3.2 精液稀释
将4头种公羊的精液混匀,均分7份,精液与稀释液比例为1∶3,向各组精液中添加相应配方稀释液,轻轻混匀,37 ℃水浴10 min,4 ℃条件缓慢降温,平衡2.5 h。
1.3.3 精液冷冻
在4 ℃条件下抽取0.2 mL各精液样品,置于0.25 mL细管中,封口。迅速将细管置于液氮上方3 cm处,熏蒸15 min,之后迅速将细管投入液氮中冷冻保存。
1.3.4 精液解冻
冻存的细管精液经不同温度及时间解冻,经过预试验后,确定了试验条件范围,分别为70 ℃ 3 s、70 ℃ 5 s、70 ℃ 8 s、42 ℃ 15 s、42 ℃ 17 s、42 ℃ 20 s。擦除细管表面水珠后,剪掉两端,收集精液于对应的1 mL稀释液中,37 ℃孵育30 min。
1.4 精液品质检测
1.4.1 精子活率和活力检测
使用一次性精子计数板(迈朗,SJ-TMDI608)进行精子活率和活力检测。将解冻并孵育30 min的精液轻轻混匀,取15 μL精液滴在37 ℃预热的计数板上,于200倍光学显微镜下随机选择5个视野,精子分析仪(迈朗,SJ-TMDI608)自动识别运动精子、直线运动精子和死亡精子数量,经计算后形成活率和活力数据。活率为运动精子占总精子数的比例,活力为直线运动精子占总精子数的比例。
1.4.2 精子质膜完整率检测
采用低渗肿胀法(HOST)检测精子质膜完整性[9]。取10 μL解冻精液加到100 μL 经37 ℃预热的HOST低渗溶液(0.9 g果糖、0.49 g柠檬酸钠、溶于100 mL双蒸水中)中,37 ℃水浴1 h,于200倍光学显微镜下随机选择5个视野,计算弯尾精子数占总精子数的比例。
1.4.3 精子顶体完整率检测
采用考马斯亮蓝法检查精子顶体完整率。取37 ℃生理盐水0.5 mL,加入100 μL精液,10 000 rmin 离心15 s,弃上清;加入0.5 mL多聚甲醛,静置30 min后用PBS离心洗涤2次,使用50 μL PBS重悬后取10 μL样品滴于载玻片上,制成涂片。晾干后用考马斯亮蓝染液滴染涂片,静置30 min。风干后于油镜下观察顶体完整情况,顶体区为紫蓝色的表示顶体完整,顶体区未染色或淡蓝色为顶体不完整[10]。
1.5 统计分析
试验数据采用SPSS 19.0软件进行单因素方差分析,结果表示为“平均值±标准误”(Mean±SEM),P<0.05表示差异显著。
2 结果与分析
2.1 稀释液的选择
如表2所示,42 ℃解冻17 s时,7号稀释液处理的精子活率(42.97%)最高,5号(39.60%)次之,1号(10.37%)最低,其中7号稀释液处理组与其他各组差异显著。70℃解冻5 s时,7号活率(50.62%)最高,5号(43.47%)次之,1号(17.11%)最低,其中7号稀释液处理组亦为与其他各组差异显著。
42℃解冻17 s处理下,7号稀释液处理组的活力是39.79%,显著高于其他各组;5号和6号次之,二者差异不显著;1号和2号稀释液保存解冻后精子活力最差。70℃解冻5 s处理下,7号稀释液处理组的活力是43.09%,显著高于其他各组;5号(33.47%)次之,1号稀释液处理后精子活力最差(12.06%)。
42 ℃解冻17 s条件下,6号和7号稀释液解冻后精子质膜完整率分别为38.33%和39.39%,显著高于1—5号稀释液。70℃解冻5 s条件下,7号稀释液解冻后精子质膜完整率为40.09%,6号(33.41%)次之,2号(13.07%)最差,其中7号稀释液质膜完整率显著高于其他各组。
在两种解冻条件下,7号稀释液的顶体完整率均最高,分别达53.49%和54.37%,显著高于其他各稀释液组的顶体完整率。1号稀释液的顶体完整率最差,分别为16.33%和15.27%。

表2 不同稀释液处理对精子解冻后性能的影响
注:同列不同字母代表差异显著(P<0.05)
2.2 不同解冻温度-时间的选择
以7号稀释液为冷冻稀释液,比较不同解冻温度和时间对湖羊冻精的影响。如表3所示,不同解冻条件下,70 ℃ 5 s解冻时精子活率和活力分别为50.62%和43.09%,显著高于其他各组。70 ℃ 5 s、42 ℃ 17 s解冻条件下,精子的质膜完整率(分别为40.09%和39.39%)和顶体完整率(分别为54.37%和53.49%)均显著高于其他各组,但两者之间没有显著差异。

表3 不同解冻条件对解冻后精子质量的影响
注:同列不同字母表示差异显著(P<0.05)
3 讨论
本研究中,7号稀释液无论是从解冻后精子活率活力上,还是从质膜和顶体完整率上,其总体效果均优于其他各组。在精液冷冻过程中,精液稀释液的渗透压和精浆一致,可以避免精子质膜因渗透压变化引起的损伤[11]。精液稀释液的最佳渗透液压范围为300—350 mOsmmL。本试验中7号稀释液的渗透压为317 mOsmmL,处于最佳范围内。
目前稀释液配方中多添加葡萄糖、果糖和蔗糖。葡萄糖为醛糖,是最易被细胞吸收而且最稳定的单糖;果糖为酮糖,与葡萄糖是同分异构体。蔗糖为二糖,由葡萄糖和果糖脱水缩合而成,其化学性质不稳定,在热、冷、酸、碱等环境下会发生改变,化学结构易被破坏[12]。本试验中仅添加蔗糖的1号稀释液效果最差,其次是2号和3号稀释液,4号、5号和6号与7号稀释液相比,效果略差,这可能是由于7号稀释液中添加的葡萄糖,一方面可以保持精子所需渗透压[13],另一方面可以快速补充精子所需能量,维持细胞代谢所需,使精子存活时间得到延长,受精能力得以提升[14-15]。另外,柠檬酸作为常规稀释液添加物[16],是pH缓冲物质,本试验中精子解冻后质量明显优于添加二水柠檬酸钠。7号和6号稀释液的冷冻效果优于4号和5号,推测出柠檬酸的最优质量浓度在0.16—0.18gL。
冷冻精子的解冻过程直接影响着冻精的效果,其中解冻时间和解冻温度这两点对于解冻过程来说至关重要[17]。以往日本、法国和英国等国家大部分使用5℃长时间缓慢解冻,澳大利亚、芬兰、比利时、瑞典和新西兰等采用15℃解冻,比利时、匈牙利和前苏联等大部分国家选择37—42℃快速解冻,挪威等少数国家则选择75℃左右高温超快速解冻,包括中国在内的多数国家均采用35—40℃进行精液的解冻[18]。而精液温度在-5—-25 ℃为危险温度带,精液易形成小冰晶,会对精子造成不可逆的物理损伤和化学损伤,而细管快速通过危险温度带能避免损伤[19-20],同时,由于精液中的酶活性不稳定,解冻时精液中的酶容易凝集精子[21],本试验采用70℃高温5s解冻时效果最好。宋新华等[22]在牛精子解冻时采用75℃ 高温4s解冻效果最佳,与本试验相似。然而,高温解冻时间较短,需要准确把握解冻时间。
综上所述,7号稀释液处理的精子各项指标(活力、活率、质膜完整率和顶体完整率)在不同解冻温度下均最高。本研究中使用7号稀释液进行冷冻,解冻时采用70 ℃解冻5 s效率最佳。

