EGFR 19和21外显子突变非小细胞肺癌患者的外周血微量元素含量对比及原因分析
李文洁 李王平 金发光 褚代芳 陈艳丽
全球范围内,肿瘤的发病率和死亡率均呈上升趋势,有数据显示,每年全球肺癌患者新发病例数超过100万[1]。2015年数据显示我国肺癌新发病例超过70万,死亡人数达到 61 万[2],发病率和死亡人数均居于所有肿瘤的首位,其中大部分患者病理类型为非小细胞肺癌(non-small cell lung carcinoma, NSCLC)。不难发现,NSCLC严重影响我国居民的身心健康,也是临床工作的一大挑战。微量元素不仅是人体组织的重要组成成分,而且是许多酶的组成成分或酶作用的辅助因子,过低或过高均会提示身体处于异常状态。大量的研究证实微量元素在多种癌症发生发展中扮演了重要角色[3-4],恶性肿瘤患者出现血清中铜、铜/锌比值升高的现象[5],肺癌组织中部分微量元素的含量均低于癌旁组织和正常肺组织,但部分微量元素含量高于癌旁组织和正常肺组织,甚至有报道发现微量元素含量与肿瘤的病理分级有关。可见微量元素对肿瘤的发生发展均存在着影响,然而是否会影响NSCLC患者的表皮生长因子受体(epidermal growth factor receptor, EGFR)基因状态尚无定论。本文对比分析EGFR 19和21外显子突变NSCLC患者的外周血微量元素含量差异,旨在为肺癌的干预提供新的思路。
资料与方法
一、一般资料
选取于2017年1月至2018年6月在我院进行救治的NSCLC患者作为研究对象。纳入标准:①病理诊断符合NSCLC[6];②未发现远处转移或者其他肿瘤者;③所有患者均在治疗前检测外周血微量元素;④所有患者均进行高通量二代测序(NGS)检测患者EGFR基因突变状态,检测结果是EGFR21号外显子或19号外显子突变;⑤所有患者均签署由我院伦理委员会批准同意的知情同意书。排除标准:①近期有服用微量元素相关补充剂者;②合并其他恶性肿瘤者;③严重的肝肾功能障碍者。符合纳入标准和排除标准的患者共54例,其中男31例,女21例,最小年龄35岁,最大年龄80岁,平均年龄(49.28±6.15)岁。根据患者EGFR基因检测结果进行分组, EGFR19号外显子突变记为A组(n=26),其中男15例,女11例,最小年龄36岁,最大年龄79岁,平均年龄(49.21±7.24)岁;EGFR 21号外显子突变记为B组(n=28),其中男16例,女12例,最小年龄35岁,最大年龄80岁,平均年龄(49.30±6.65)岁。同时选择同期在我院进行健康体检者作为对照(记为C组,n=36),其中男20例,女16例,年龄42~65岁,平均年龄(49.57±4.87)岁。三组基线资料,对比无差异(P>0.05),具有可比性。
二、研究方法
1. 肺癌患者组织病理及EGFR基因检测: 所有入组患者均行组织穿刺活检,穿刺组织使用10%中性缓冲福尔马林固定液进行固定,脱水后进行石蜡包埋,部分切片进行标准的HE染色,明确肺癌病理分型。
2. EGFR突变检测: 采集患者肺癌组织样本,送至我院呼吸内科实验室进行检测,检测采用高通量测序(next-generation sequencing, NGS)方法,测定EGFR基因状态,该检测技术,可用于检测多种EGFR基因变异形式,包括点突变、小片段插入缺失、基因重排和拷贝数变异等。
3. 微量元素检测: 采集所有入组对象的清晨空腹静脉全血3 ml,室温静置30 min,进行离心处理(以离心半径8 cm,3 000 r/min,时间10 min),取上清血清进行铁(Fe)、锌(Zn)、钙(Ca)、镁(Mg)含量检测。所有检测均严格按照相关仪器、试剂盒说明书标准进行操作,同时做好室内质量控制工作,确保检测结果的准确性。其中微量元素正常值参考范围铁(Fe)为8.1~28.3 μmol/L、锌(Zn)为9.8~16.8 μmol/L、钙(Ca)2.02~2.6 mmol/L、镁(Mg)0.5~1.2 mmol/L。
4. 观察指标: 详细记录三组患者血清铁(Fe)、锌(Zn)、钙(Ca)、镁(Mg),对比分析两组微量元素含量的差异。
三、统计学方法
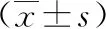
结 果
一、三组血清铁(Fe)、锌(Zn)、钙(Ca)、镁(Mg)含量的比较
A组与B组比较,两组的血清铁、锌、钙、镁含量,差异无统计学意义(P>0.05)。A组与C组比较,两组的血清铁、锌、钙、镁含量,差异有统计学意义(P<0.05)。B组与C组比较,两组的血清铁、锌、铜、钙、镁含量,差异有统计学意义(P<0.05),见表1。

表2三组血清铁、锌、钙、镁含量异常率比较[n(%)]

表1三组血清铁、锌、钙、镁含量的比较
注:a代表A组与C组比较,P<0.05,b代表是B组与C组比较,P<0.05
二、三组血清铁、锌、钙、镁含量异常率比较
A、B两组血清铁、锌、钙、镁含量异常率均显著低于C,且差异具有统计学意义(P<0.05),见表2。
讨 论
微量元素是指含量处于人体总量的万分之一以下,且每日需摄入量低于100 Mn的元素。联合国粮食及农业组织(FAO)/世界卫生组织(WHO)1998年将铜(Cu)、钴(Co)、铬(Cr)、铁(Fe)、氟(F)、碘(I)、锰(Mn)、钼(Mo)、硒(Se) 和锌(Zn)等10种列为维持人体正常生命活动所不可缺少的必需微量元素[7]。本文由于本院检测技术限制,只纳入了铁、锌、钙、镁作为观察指标。结果发现EGFR19号外显子与21号外显子突变的NSCLC中的微量元素血清铁、锌、钙、镁含量均较健康人群显著降低(P<0.05),同时微量元素的异常率均高于健康人群,分析其可能原因有:①锌(Zn)下降的原因: 锌元素是大脑神经物质重要成分,当锌元素缺乏时,降低脑细胞中的色素氧化酶含量,易造成神经系统失调,导致大脑功能障碍,表现出机体活力下降,记忆衰退,反应迟钝,思维紊乱,步态不稳、运动失常等临床症状。锌元素也是体内酶的成分重要部分,对细胞合成及机体免疫系统起到调控作用。有研究发现锌含量下降会影响CD4+/CD8+的比值[8],从而导致机体免疫功能紊乱;②铁(Fe)下降的原因: 肺癌患者可能会发生癌性贫血,其原因可能是其可能的机制是Hepc-25的异常增多引起铁代谢异常,通过体循环和/或内分泌机制[9-10],使铁存储在储铁细胞中。一方面减少网状内皮系统释放铁及减少肠道对铁的吸收等负性调节,平衡机体的铁代谢,进而降低血清铁浓度及转铁蛋白饱和度,由于贫血的发生可能导致乏氧出现[11],乏氧可以改变肿瘤细胞的基因表达,改变基因组,随之使得蛋白质组发生改变,增强肿瘤侵袭性,发生肿瘤进展。乏氧对肿瘤血管形成有促进作用,激活多种促凝因子表达,加速肿瘤细胞的浸润和转移。乏氧增加了肿瘤组织对放化疗及相关治疗的抵抗力,使得治疗效果大打折扣,影响肿瘤患者的预后; ③钙和镁含量下降原因:维生素D可通过其代谢产物1,25(OH)2D3而影响B淋巴细胞增殖分化、T淋巴细胞的增值成熟,进而影响机体免疫功能,其中Th17/Treg 细胞失衡与自身免疫性疾病有关[12]。镁可维持神经细胞的兴奋性及稳定性,通过抑制5-羟色胺再摄取进而达到抑制平滑肌收缩,目前尚不清楚是由于铁、锌、钙、镁等微量元素缺失而导致肺癌EGFR基因突变还是因为EGFR基因突变后导致患者铁、锌、钙、镁等微量元素下降,因此仍需要更多的研究来进一步证实。
综上所述,NSCLC患者 EGFR19号外显子与21号外显子的外周血微量元素铁、锌、钙、镁均较健康人群普遍降低,但在19号外显子和21号外显子之间,微量元素含量不存在明显差异。

