贝类源抗氧化肽研究进展
杨锡洪渠纯纯李 赛李安奇丁 乾李钰金李丽迪张俊逸解万翠
(1. 青岛科技大学海洋科学与生物工程学院,山东 青岛 266042;2. 山东省生物化学工程重点实验室, 山东 青岛 266042;3. 农业部冷冻调理海洋食品食点重点实验室,山东 荣成 264303;4. 荣成泰祥食品股份有限公司,山东 荣成 264303;5. 青岛信和源生物科技有限公司,山东 青岛 266002)
生物体中活性氧(ROS)和活性氮(RNS)作为在体内发挥重要作用的自由基,参与细胞内信息传递过程,并可防御病原体入侵[1]。但过量的自由基会对DNA、蛋白质和膜等各种细胞组分造成氧化损伤。氧化损伤是导致人体衰老和各种疾病如糖尿病、心脏病、中风、动脉硬化和癌症等的重要因素[2]。研究[3]表明,摄入一定量的抗氧化剂能有效延缓衰老,预防或治疗相关疾病。同时,脂质过氧化反应也是造成食品酸败的主要原因,不仅降低了食物的营养价值,还会产生不良气味及一些有害物质[4]。抗氧化剂可通过转移氢原子或电子直接清除自由基,或通过金属离子螯合作用,抑制自由基的形成,有效阻断脂质过氧化的链式反应[5]。合成抗氧化剂如二丁基羟基甲苯(BHT)、叔丁基羟基茴香醚(BHA)和没食子酸丙酯(PG)等,虽能有效清除自由基,但其潜在的副作用会对人体产生危害,且成本较高、易产生污染[6]。而天然抗氧化剂具有来源广泛、成本低且无毒副作用等优点,在越来越多的行业中得到应用。
生物活性肽具备广泛活性,如抗氧化、抗病毒、抗肿瘤、镇痛、神经保护、降高血压和免疫调节等[7]。因此,以生物活性肽作为天然抗氧化剂不仅可阻断有害的氧化反应,还对人体有其他保护作用。
中国贝类产业发展迅猛[8],贝类及其加工副产物蛋白质丰富,脂肪含量低,是获取天然抗氧化肽的重要原料[9]。酶解法制备抗氧化肽是目前较为广泛的方法[10]。随着现代生物工程的发展,利用基因工程及发酵工程制备贝类源抗氧化肽也取得了一定成果[11]。本文综述了国内外贝类及其副产物制备抗氧化肽的研究进展,以期对贝类源新资源的高值化利用提供基础。
1 可控性酶解处理方法及优化
由贝类蛋白制备抗氧化肽通常有化学水解法、微生物发酵法和酶解法等。化学水解法利用酸或碱降解蛋白质获得活性肽,工艺简单、成本低,但水解进程不易控制,而且酸碱易导致氨基酸或肽的结构受损,影响生物活性,同时易造成环境问题使其应用受到限制[12];微生物发酵法指利用一定的微生物进行发酵,以此产生的酶能将蛋白质水解从而获得活性肽,成本较低,但发酵周期长,生成的产物复杂使得提纯过程困难[13];酶解法生产肽类具有成本低、条件温和、产品安全性高等优点,并且水解进程易于控制,广泛应用于制备贝类源抗氧化肽。
蛋白质的酶促降解受诸多因素影响,使得水解产物的氨基酸组成和分子量大小各异,进而影响肽的抗氧化活性[14]。利用可控酶解技术研究蛋白酶品种、底物浓度、酶用量、pH值、酶解时间及酶解温度对酶解液水解度、得肽率和抗氧化活性的影响,以获得最佳酶解工艺条件,能高效制备抗氧化肽[15]。图1所示为可控酶法制备贝类源抗氧化肽的一般过程。
制备贝类源抗氧化肽的酶解方式主要包括单酶酶解、复合酶解和分段酶解。单酶酶解操作简单,酶解条件易于控制,但因蛋白酶水解位点高度专一,很难达到预期效果[17]。复合酶解指采用2种或2种以上蛋白酶按照一定比例同时酶解底物,分段酶解指采用多种蛋白酶依次酶解底物,与单酶酶解相比,这2种方法可有效提高酶解效率,但酶解过程中需要控制的条件较多[18]。目前应用于贝类源抗氧化肽生产的常见酶有:动物源蛋白酶,如胃蛋白酶、胰蛋白酶、糜蛋白酶;植物源蛋白酶,如木瓜蛋白酶、菠萝蛋白酶;微生物源蛋白酶,如枯草杆菌蛋白酶、蜡样芽胞杆菌蛋白酶等。表1列出了利用海洋贝类及其副产物源制备抗氧化肽的主要方法和结果。
由于蛋白酶具有特定的酶切位点,同一底物经不同蛋白酶酶解后,所得产物的抗氧化活性差异较大[27]。因此,在制备贝类源抗氧化肽时要根据原料及试验条件挑选合适的蛋白酶,并研究出最佳酶解条件以获得较多高抗氧化活性的肽。酶解结束后还需对酶解液进行分离、纯化、富集及活性检测,以得到高纯度和高活性的抗氧化肽,利于对发挥抗氧化活性组分的进一步研究。

图1 贝类及其副产品制备抗氧化肽的工艺流程[16]
2 肽的分离纯化
研究[28]发现分子量较小的肽往往表现出更高的抗氧化活性。如表1中所示,经不同贝类获得的抗氧化肽分子量大多处于400~1 500 Da。为获得具高抗氧化活性的肽组分,需采用一定方法对酶解液中的小分子肽进行分离富集,常用的分离技术包括超滤法、色谱法和色谱—质谱联用技术。
超滤法常用于抗氧化肽的初步分离,即通过特定截留分子量规格的多孔膜实现对酶解液的分级,如Li等[24]分别利用3,5,10 kDa的超滤膜对短颈蛤水解液进行分离,得到具有不同分子质量范围的多个肽组分。超滤法操作简单,无需添加其他化学试剂,但超滤过程中易出现浓差极化使得分离不彻底,常采用色谱法对超滤后的组分进一步纯化分离,有时也会同时采用两种方法以提高分离效果[29]。
色谱法包括离子交换色谱法(IEC)、分子排阻色谱法(SEC)以及反相高效液相色谱法(RP-HPLC)等。其中,IEC又分为阴离子交换色谱(AEC)和阳离子交换色谱(CEC),即以离子交换剂为固定相,依据流动相中的组分与离子交换剂的结合力大小差别达到分离目的。SEC是根据蛋白质和多肽的分子量大小不同,其通过填充柱中的凝胶介质速度不同而实现分离浓缩的,常以Sephadex G-15、Sephadex G-25和Sephadex G-50作为固定相。 如Asha等[21]用30%的乙腈和0.1%的三氟乙酸用作为洗脱液,用Sephadex G-25柱分离了分子量为1~5 kDa的牡蛎酶解液组分,在214 nm处检测获得了吸收峰。RP-HPLC分离效率高,通常为纯化抗氧化肽的最后一步。体系由非极性固定相和极性流动相组成,常以C18作为固定相,用乙腈或甲醇作为流动相,将洗脱馏分在特定波长下进行检测,以得到具有最高活性的抗氧化肽组分。Wu 等[25]获得SEC富集的抗氧化肽后,采用半制备Zorbax SB C18柱,以超纯水、0.1%三氟乙酸和甲醇为流动相,在一定洗脱程序下获得了5组纯化的肽,测定各自的抗氧化活性后选择活性最高的组分用于氨基酸序列测定。
色谱—质谱联用技术以其自动化和高效的特点,已被广泛应用于抗氧化肽的分离纯化,如气相色谱—质谱(GC-MS)、液相色谱—串联质谱(LC-MS/MS)、超高效液相色谱—串联质谱(UPLC-MS/MS)等。Umayaparvathi 等[20]利用Sephadex G-25凝胶柱获得牡蛎酶解液中抗氧化活性最高的组分F5后,运用UPLC-MS对其进行分离纯化,洗脱收集到的7个肽组分都能有效清除DPPH自由基,其中清除活性最强的3个组分则经 Q-TOF ESI质谱仪获得了分子量及氨基酸序列(见表1)。Neves等[30]采用UPLC-MS/MS纯化并鉴定了鲑鱼蛋白酶解液中的十六肽stp-c1的氨基酸序列,发现肽序列Tyr-Pro的氧自由基吸收能力(ORAC)最强。将色谱—质谱联用技术运用于分离及鉴定抗氧化肽不仅能达到更好的分离效果,还能有效简化测序过程。
抗氧化肽的分离纯化方法多样,作为结构鉴定前必不可少的一步,研究中应采用适当的分离纯化手段逐步得到高纯度、高活性的抗氧化成分,以利于对其进行更深入的研究。
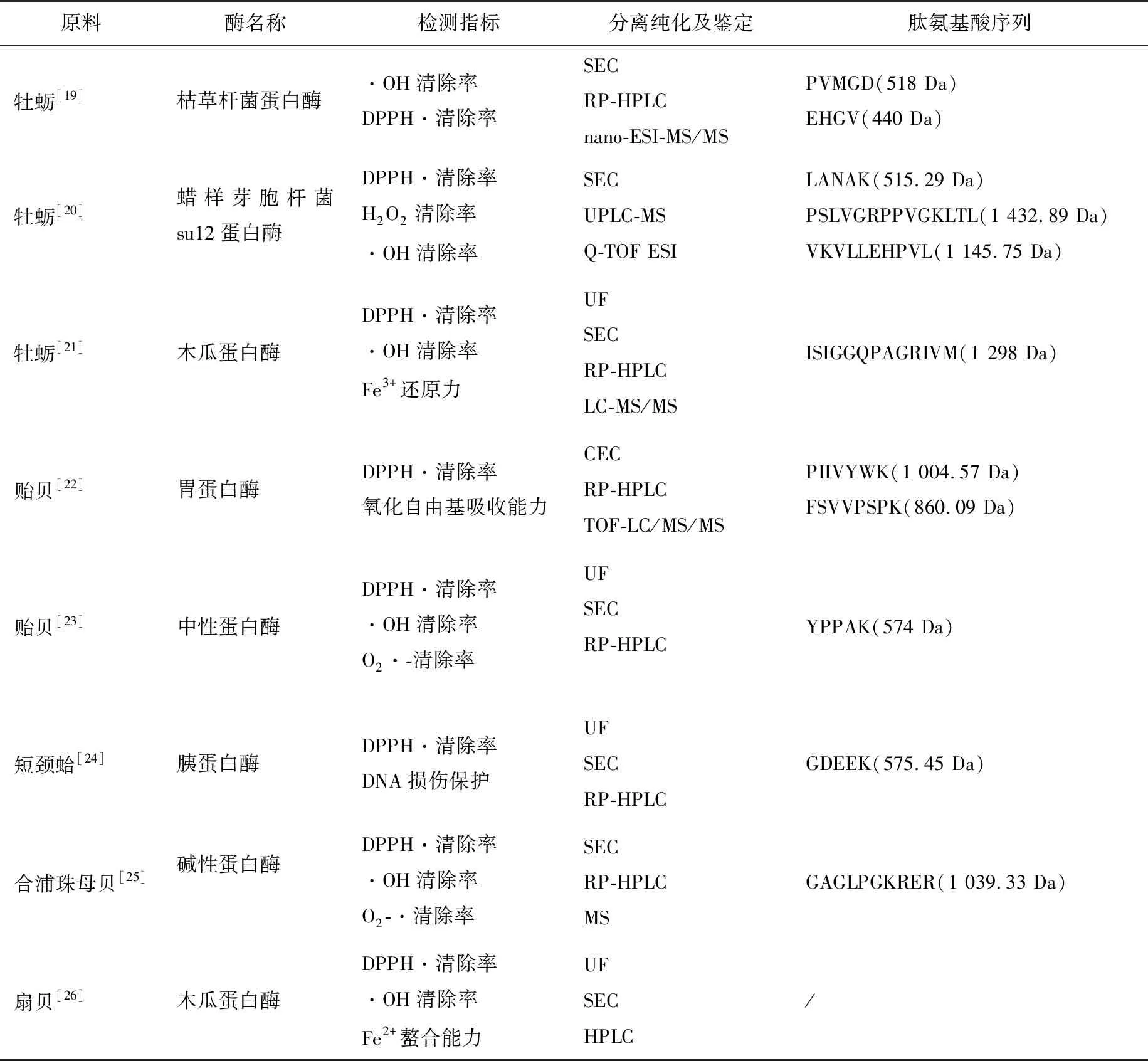
表1 海洋贝类及其副产物源抗氧化肽
3 抗氧化肽活性检测及结构鉴定
3.1 抗氧化肽活性检测方法
3.1.1 化学法检测评价 肽组分在分离纯化前,需检测其抗氧化活性以筛选最佳产物,研究中常测定两种以上指标相互验证以表征肽的体外抗氧化活性[31]。肽对各类自由基如·OH、O2·-及NO·等的清除力,最直接地反映了其抗氧化活性;金属离子螯合能力,即肽与环境中的金属离子螯合,降低或消除金属离子对生物细胞毒性危害的能力[32];还原力指肽提供氢原子或电子的能力,具有较高还原力时供电子能力也越强[33]。此外,抗氧化肽的脂质过氧化抑制力也是检测其氧化活性的一项重要指标。机体内多不饱和脂肪中的碳碳双键(C═C)会降低碳氢键的作用力,使氢原子易受自由基攻击,从而引起脂质过氧化连锁反应,如图2所示。含疏水性氨基酸的抗氧化肽因其具有较高的脂溶性,增强了与脂肪酸反应,有效防止氢原子受到攻击,阻断脂质过氧化链式反应[34]。但生物体内存在着复杂的氧化过程,在体外抗氧化活性较强的肽在生物体内不一定具有同样的效果。因此,在化学方法评价的基础上需进一步结合生物试验进行评价[35]。
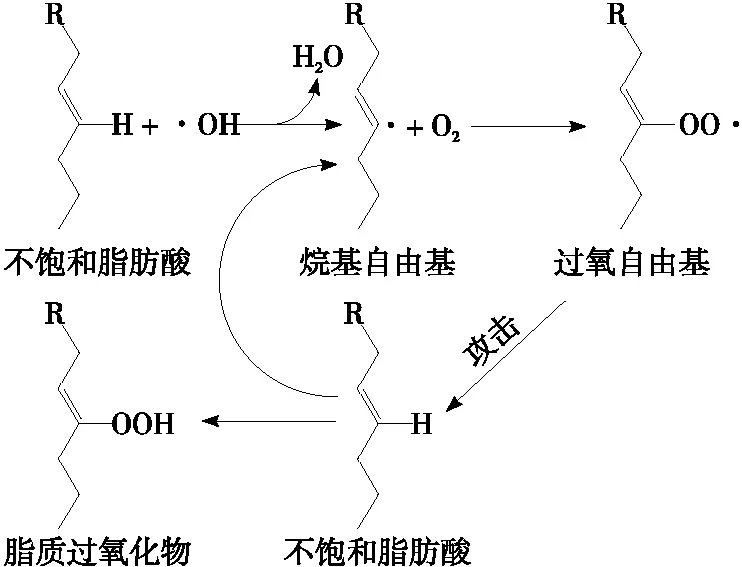
图2 不饱和脂肪酸氧化过程图[34]

3.2 肽的分子量及氨基酸序列测定
肽序列组成以及其氨基酸残基被认为是影响肽抗氧化活性的重要因素[37]。液相色谱—质谱联用技术(LC-MS/MS)是鉴定多肽序列和分子量的常用方法,通常配备电喷雾电离源(ESI)、联用混合四级杆飞行时间质谱仪(Q-TOF mass)或三重四极杆—线性离子阱质谱仪对纯化的抗氧化肽进行精确测序和分子量测定,与蛋白质测序仪的联用可提高测序结果的精准性[21]。此外,埃德曼降解法(Edman degradation)也可用于测定肽的氨基酸序列,从蛋白质或多肽氨基末端进行分析。因为此法是以异硫氰酸苯酯对N-端氨基的修饰为基础,当N-端被其他化学基团所封闭时需要先去除这些基团才能进行测序,且无法得到序列的分子量,有一定的局限性[38]。Chi等[29]对毛蛤分离纯化后所得的抗氧化肽段测序,得其序列为Trp-Pro-Pro;Kleekayai等[39]分别从虾酱水体液得到具有抗氧化作用的肽段,经鉴定的序列为Trp-Pro,如图3所示。Ongonierma等[40]也提出Trp-Pro具有二肽基肽酶(DPP-IV)抑制活性。Herraiz等[41]也发现含有氨基酸色氨酸Trp的小分子肽能够提供电子以达到消除阳离子的作用,特别是ABTS自由基。
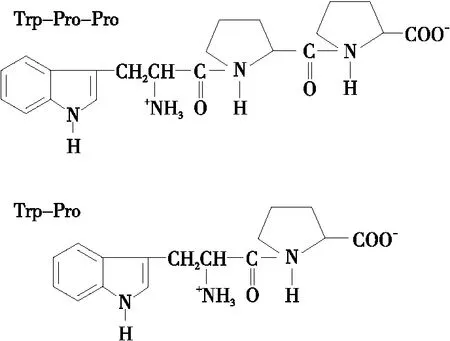
图3 具有抗氧化活性的氨基酸序列
鉴定具有抗氧化活性肽段的分子量和氨基酸序列,不仅对抗氧化肽构效关系的深层研究具有重要意义,同时对于天然抗氧化肽的体外合成有一定的参考价值,借助这一方法也为合成高活性抗氧化肽能指出新的发展方向。
4 抗氧化肽构效研究
多肽一级结构中氨基酸所含基团、亲疏水性、酸碱性及序列,空间构象都会对抗氧化肽活性产生影响。理解结构—活性关系(SAR)有助于预测肽中潜在的抗氧化活性物质,开发新的高活性抗氧化肽[42]。
4.1 一级结构氨基酸组成和序列
氨基酸组成和序列是影响肽抗氧化活性的重要因素[43]。表1给出了近年来部分贝类源抗氧化肽的氨基酸组成与序列,可以看出,这些抗氧化肽的氨基酸序列间同源性甚微,或因其制备原料、水解酶和酶解方式不同造成。研究[44]发现,大部分抗氧化性强的肽除含有Pro、His、Tyr、Trp、Met和Cys等疏水性氨基酸之外,其N端还常含有疏水性残基。抗氧化肽中疏水性氨基酸的脂肪烃侧链使其与自由基更易结合,增强肽与多不饱和脂肪酸的反应,从而延缓脂质的过氧化进程[45]。因此,疏水性氨基酸是影响肽抗氧化活性的重要因素。Giménez等[46]研究了3种具有相同分子量的肽:GPLGLLGFLGP-LGLS、GPOGOOGFOGPOGOS和GPOGOOGFLGPOGOS,发现其中疏水性最强的GPLGLLGFLGPLGLS抗氧化活性也最强,进一步证实了疏水性与肽段的抗氧化活性的关联性较强。含组氨酸的肽可通过供氢、捕获脂质过氧自由基或利用咪唑基团的金属离子螯合作用发挥其抗氧化作用[47];肽中的芳香族氨基酸残基(如酪氨酸、色氨酸和苯丙氨酸)可以向缺电子自由基提供质子从而表现抗氧化性[48]。Wu等[49]从扇贝雌性性腺中分离出2种分子量相似的肽HMSY(536 Da)和PEASY(565 Da),通过对其抗氧化活性的比较证明了该观点。
此外,在对一些具有脂质过氧化性的贝类源结构鉴定时发现,该类肽具有两亲性。两亲性肽能够存在于油—水界面,有效猝灭亚油酸乳液体系的水相和油相中的自由基,从而使肽具有抗氧化活性[46]。肽的亲脂性和亲水性氨基酸残基可共同作用,促进其与疏水性靶标的结合,从而激发肽的总体抗氧化活性[34]。
以Suetsuna等[44]从酪蛋白水解物中分离出的抗氧化肽Tyr-Phe-Tyr-Pro-Glu-Leu为例,如图4所示,N端多为疏水性氨基酸(如Val、Leu等),在细胞膜水油层界面处,疏水氨基酸有利于抗氧化肽直接进入细胞质进行ROS清除反应;C端的Cys含易结合自由基(如ROOR、ROO· 、R· 、HO·等)结合的巯基,从而终止自由基链式反应[43],发挥抗氧化作用。
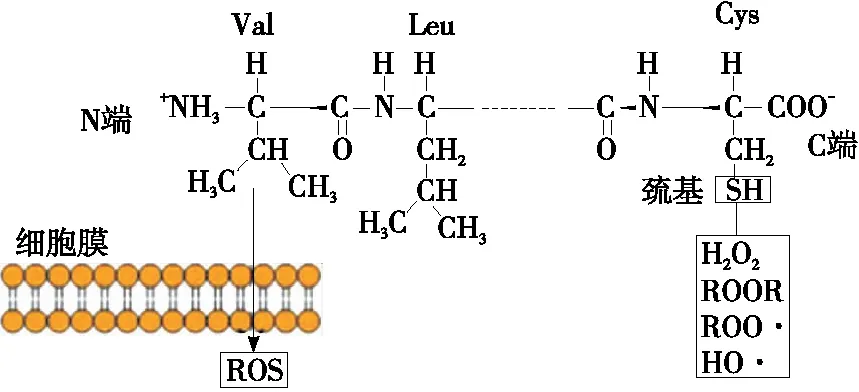
图4 两亲性抗氧化肽作用机理[43]
4.2 空间构象影响
多肽的空间构象(二级结构、二硫键等)也会影响肽的抗氧化活性。Suetsuna等[44]利用虾肌肉蛋白得到可抑制亚油酸过氧化的肽段IKK、FKK和FIKK,但将相同浓度的氨基酸混合却无抗氧化活性,说明肽键及多肽的结构对抗氧化活性起重要作用。Chen等[50]在对合成肽进行研究时发现,含有组氨酸的人工合成短肽在其单独存在时,并不具有抗氧化能力,则在一定程度上说明,肽的抗氧化性是所有短肽在一定空间结构上的协同作用产生的。此外,韦绪芹等[51]认为,通过人工合成贝类抗氧化肽的氨基酸序列,采用插入、替换或剔除的方法对肽空间构象进行修饰也会影响其抗氧化活性。
5 结论与展望
作为一种天然活性物质,贝类源抗氧化肽的安全性高、毒副作用小,在生物学、医学和食品科学领域发挥重要作用,但目前相关研究中仍存在一些问题:酶解法无法制得单一活性肽,且其富集、纯化过程耗时较长;活性结构序列测定繁琐复杂,成本高;抗氧化肽构效关系仍待进一步验证;活性位点的分布及其作用机理、贝类源抗氧化肽与其他抗氧化剂之间是否存在协同或拮抗作用等问题都值得深入研究。
除抗氧化性外,贝类源肽还具有抗菌性、光保护性和抗光老化活性等其他生物活性,因此被认为是开发药用化妆品的更安全的选择。尽管贝类源抗氧化肽在医学、食品、化妆品等行业的应用潜力很大,但目前多数研究仅处于试验阶段,需要进一步研究其商业化发展的安全性。此外,通过开发一些补充剂,进一步提高贝类源抗氧化肽的生物利用率和组织再生功效,增加其应用潜力,也是一个具有前景的研究方向。

