牦牛血低聚肽对缺氧介导的H9c2心肌细胞损伤的保护及其作用机制
肖 岚李 诚程小平杜 昕
(1. 四川农业大学食品学院,四川 雅安 625014;2. 四川旅游学院食品学院,四川 成都 610100; 3. 四川高金实业集团有限公司,四川 遂宁 629000)
牦牛是中国青藏高原的特殊家畜,经过世代的自然选择,牦牛显示出对低氧环境极好的适应性,这可能与牦牛血液的特殊性有一定关系[1-3]。本课题组[4]前期采用枯草芽孢杆菌(SICC1.197)联合碱性蛋白酶制备出牦牛血低聚肽,利用超滤离心得到分子量<1 kDa的牦牛血低聚肽,并对其体外(还原力、ABTS+·清除力、·OH清除能力、DPPH·清除能力、总抗氧化力以及脂质过氧化抑制能力)和小鼠体内(丙二醛、超氧化物歧化酶、谷胱甘肽过氧化物酶、总抗氧化能力)的抗氧化能力进行了检测,发现牦牛血低聚肽具有良好的抗氧化能力。姚星辰等[5]报道牦牛活性蛋白具有显著的延长小鼠抗缺氧时间的作用。牦牛血是否与抗缺氧功能有一定的关联尚未见相关报道。为了解具有抗氧化活性的牦牛血低聚肽是否具有抗缺氧活性,课题组采用高、中、低剂量牦牛血低聚肽对小鼠进行了预试验,常压耐缺氧试验结果显示牦牛血低聚肽对小鼠缺氧耐受力有提高作用并呈剂量依赖性;亚硝酸钠中毒存活试验显示,牦牛血低聚肽能延长缺氧小鼠的生存时间。因此,为了进一步证实牦牛血低聚肽的抗缺氧活性并了解其作用机制,本试验拟体外培养H9c2心肌细胞建立缺氧损伤模型,探讨牦牛血低聚肽对心肌细胞缺氧损伤的抑制作用及机制,旨在为进一步研究牦牛血低聚肽对抗缺氧作用机理提供理论依据。
1 材料与方法
1.1 材料与试剂
牦牛血低聚肽:氨基酸含量85.25 g/100 g,平均分子量<1 kDa,实验室自制;
DMEM培养基、血清:美国Thermo Fisher Scientific公司;
CCK8细胞增殖及细胞毒性检测试剂盒、Caspase 3/9活性检测试剂盒、BCA蛋白浓度测定试剂盒:碧云天生物技术公司;
细胞凋亡检测试剂盒:南京凯基生物科技发展有限公司;
蛋白marker:北京全式金生物技术有限公司;
乳酸脱氢酶(LDH)测试试剂盒、总抗氧化能力(T-AOC,ABTS法)测试试剂盒:南京建成生物工程研究所;
大鼠肿瘤坏死因子α(TNF-α)酶联免疫吸附测定试剂盒:武汉伊莱瑞特生物科技有限公司。
1.2 仪器与设备
三气培养箱:HF-100型,上海力申科学仪器有限公司;
倒置显微镜:IX51型,奥林巴斯(中国)有限公司;
CO2恒温培养箱:MCO-15AC型,三洋电机(中国)有限公司;
全自动酶标仪:Multiskan MK3型,美国Thermo Scientific公司;
流式细胞仪:CytoFLEX型,美国贝克曼库尔特有限公司;
实时荧光定量PCR仪:QuantStudio 6型,美国应用生物系统(ABI)公司。
1.3 细胞株与分组
H9c2心肌细胞株:生工生物工程(上海)股份有限公司。
H9c2细胞(DMEM+10% FBS+1%双抗)复苏与培养融合至80%~90%后,进行细胞毒性试验以及浓度预试验,在此基础上确定牦牛血低聚肽的用量。将H9c2细胞分组:正常对照组、缺氧组、牦牛血低聚肽低剂量组(0.05 mg/mL)、牦牛血低聚肽中剂量组(0.4 mg/mL)、牦牛血低聚肽高剂量组(3.2 mg/mL)。
1.4 试验方法
1.4.1 细胞缺氧模型的建立 取对数生长期的细胞,胰酶消化后,用培养基(含10% FBS+1%双抗)调整细胞密度到5×104个/mL,接入96孔板,每组6个复孔,每孔100 μL细胞悬液,并设置空白孔,在细胞孔周围孔内加入100 μL无菌PBS,37 ℃ 5% CO2饱和湿度条件下培养过夜,待细胞融合至70%~80%后进行分组处理并药物干预。正常对照组常氧条件培养,加药组加药预处理4 h后换为缺氧培养基含(2% FBS)并置于三气培养箱缺氧培养48 h。
1.4.2 指标测定
(1) CCK-8法测定细胞存活率:按照1.4.1处理细胞,每孔加入10 μL CCK8,37 ℃培养4 h,振荡10 min,酶标仪测定各孔吸光值OD450。
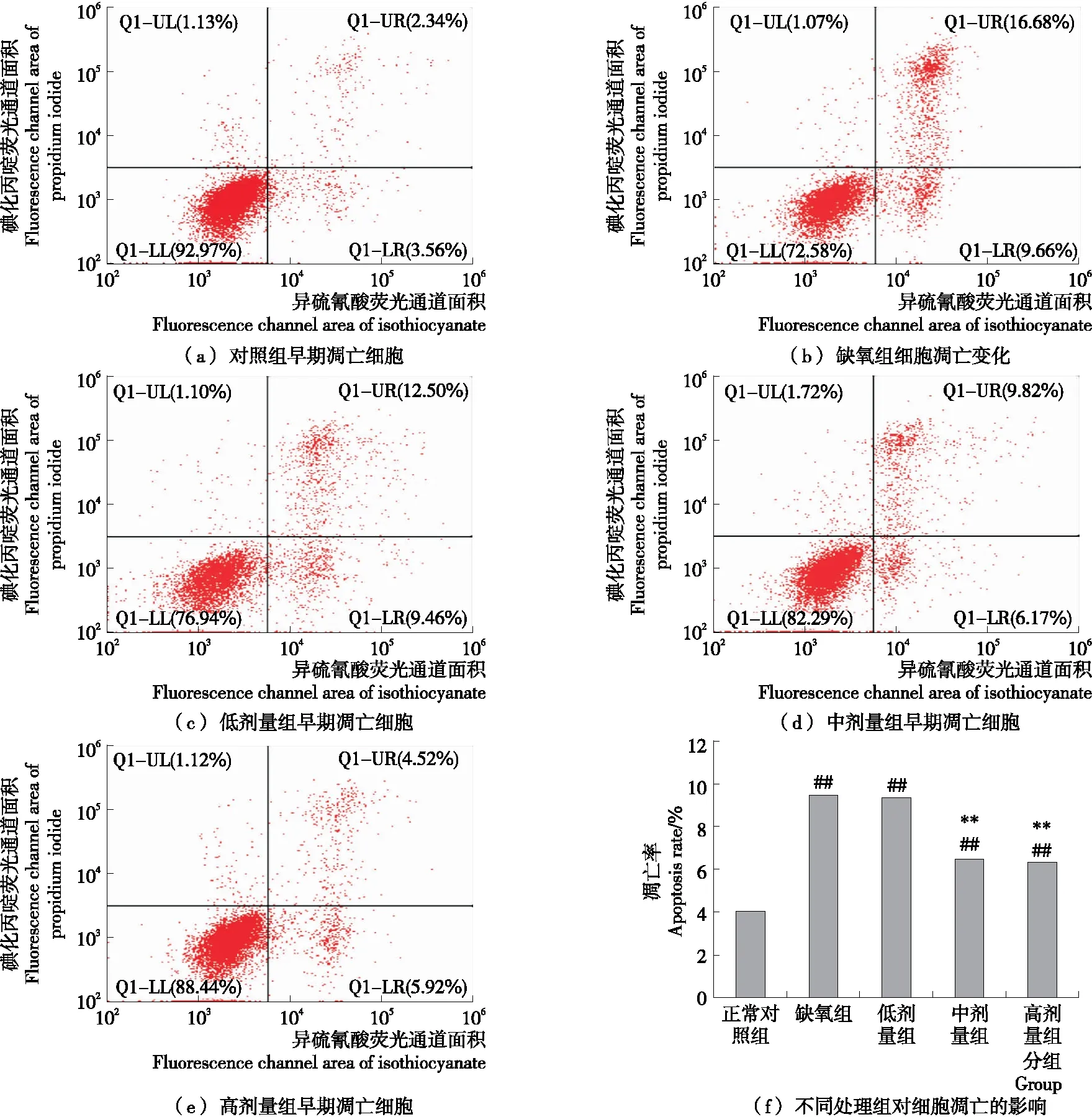
(2) 流式细胞仪检测细胞凋亡:按照1.4.1处理细胞,按照AnnexinV-FITC/PI细胞凋亡检测试剂盒操作说明进行,流式细胞仪上机检测。
(3) 细胞培养上清液中T-AOC含量、TNF-α含量、乳酸脱氢酶(LDH)活性的测定:按照1.4.1处理细胞,按照测试试剂盒说明书的要求检测T-AOC含量、TNF-α含量、LDH活性。
(4) Western Blot检测细胞中p-Akt、Akt、Survivin蛋白表达:按分组要求处理细胞后,提取单层贴壁细胞总蛋白并对蛋白进行定量,蛋白变性,电泳分离并转移至硝酸纤维素(PVDF)膜上,采用ECL显色系统进行免疫印迹显色,冲洗胶片,晾干胶片,扫描胶片,用BandScan分析胶片灰度值。
(5) 细胞中Caspase-3与Caspase-9活性:按照1.4.1处理细胞,按照试剂盒说明书的要求进行检测。
(6) Western Blot法测定线粒体和细胞胞质中细胞色素C的含量:按照1.4.1处理细胞,参考1.4.2(4)采用Western Blot法测定。
(7) QPCR检测细胞中P13K、AKt、Caspase-3、Caspase-9、HIF-1α基因表达:按照1.4.1处理细胞,实时荧光定量PCR检测mRNA。
(8) 细胞线粒体膜电位的检测:按照1.4.1处理细胞后,按照线粒体膜电位检测试剂盒操作说明进行。
1.5 数据处理
试验数据以(均数±标准差)表示,组间比较采用单因素方差分析,P<0.05表示有显著性差异。统计分析使用SPSS 19.0等软件。
2 结果与分析
2.1 牦牛血低聚肽对缺氧H9c2细胞存活率和LDH释放量的影响
如图1(a)所示,与正常组相比,持续缺氧48 h导致H9c2细胞存活率均出现了一定程度的下降,差异极显著(P<0.01),表明H9c2细胞缺氧损伤明显。采用高、中、低剂量的牦牛血低聚肽干预缺氧细胞,能提高缺氧细胞的存活率;与缺氧组比较,高、中剂量组对细胞凋亡的抑制作用极显著(P<0.01)。此结果提示,牦牛血低聚肽具有改善缺氧H9c2细胞存活率的作用,且存在剂量依赖性。
正常情况下,LDH主要分布在心肌细胞胞质中,是不能透过细胞膜进入膜外空间(如细胞培养液上清液)[6],只有当细胞损伤后,LDH才会释放进入细胞上清液中使其活性升高,因此,通过测定细胞上清液中LDH的活性可间接反映细胞的损伤程度。由图1(b)可知,缺氧导致H9c2细胞培养液上清液中LDH的活性极显著升高(P<0.01),而牦牛血低聚肽预处理则可降低培养液上清液中LDH含量且存在剂量依赖性,其中高、中剂量组可极显著降低LDH活性(P<0.01)。此结果提示,牦牛血低聚肽对缺氧心肌细胞的细胞膜显示出良好的保护作用,且存在剂量依赖性。

与正常对照组相比,# P<0.05,## P<0.01;与缺氧组相比,* P<0.05,** P<0.01
2.2 牦牛血低聚肽对缺氧H9c2细胞凋亡的影响
图2(a)显示,正常对照组H9c2细胞凋亡不明显(凋亡率<5%);图2(b)显示,缺氧组H9c2细胞凋亡率极显著升高(P<0.01),凋亡率<10%,表明缺氧可促进心肌细胞凋亡;图2(c)~(e)显示牦牛血低聚肽3个剂量组均能减少缺氧介导的H9c2细胞凋亡,且中、高剂量组具有极显著效果(P<0.01)。这与2.1的试验结果相对应,再次提示牦牛血低聚肽对缺氧导致的心肌细胞损伤具有较好的保护作用。
2.3 牦牛血低聚肽对缺氧H9c2细胞线粒体膜电位的影响
线粒体是细胞呼吸的主要场所,缺氧会诱导线粒体结构和动力学上的改变,包括线粒体膜电位(Mitochondrial membrane potential,MMP)的坍塌、线粒体膜孔道的开放,从而影响膜内信号物质(如细胞色素C)的释放等[7],引起线粒体代谢紊乱,导致线粒体功能损伤,进而诱导线粒体形态结构发生改变,最终导致线粒体膜瓦解,释放Caspase蛋白[8],激活下游的凋亡通路[9],诱导细胞凋亡[10]。因此,线粒体膜电位在凋亡起始过程对防治缺氧相关疾病的发生非常重要。
本试验观察到持续缺氧处理H9c2细胞48 h,其MMP出现极显著下降(P<0.01),而牦牛血低聚肽干预组则可抑制缺氧导致的MMP下降,中剂量组有显著效果(P<0.05),而高剂量组的效果极显著(P<0.01)(图3)。结果提示,牦牛血低聚肽可能通过维持缺氧条件下细胞MMP的稳定进而减少细胞损伤。
2.4 牦牛血低聚肽对缺氧H9c2细胞线粒体内细胞色素C释放的影响
线粒体损伤是诱发细胞调亡的主要原因之一[11]。2.3 的研究结果提示牦牛血低聚肽可显著地提高细胞在缺氧条件下的线粒体膜电位,保护线粒体结构的完整。故本试验采用Western Blot法测定线粒体和细胞胞质中细胞色素C的含量,线粒体细胞色素C含量与细胞胞质中细胞色素C的含量的比值常被用作反映线粒体结构损伤程度的指标[12],结果见图4。缺氧诱导细胞色素C从线粒体中大量的释放,而细胞胞质中细胞色素C含量显著增加,表现为线粒体中细胞色素C含量与细胞胞质中细胞色素C的含量的比值极显著下降(P<0.01),仅为正常对照组的50%;然而,牦牛血低聚肽预处理则可抑制缺氧H9c2细胞线粒体中细胞色素C的释放(P<0.01)且呈剂量依赖性,进一步提示牦牛血低聚肽对缺氧心肌细胞的保护作用与维持细胞线粒体结构完整性、减少其细胞色素C释放有关。
与正常对照组相比,# P<0.05,## P<0.01;与缺氧组相比,* P<0.05,** P<0.01
2.5 牦牛血低聚肽对缺氧H9c2细胞中p-Akt、Akt、Survivin蛋白表达的影响
PI3K-Akt信号通路是一条重要的抗凋亡/促增殖信号途径[13],文献[14]证实激活PI3K-Akt信号通路在抗凋亡过程中起关键作用。激活PI3K-Akt通路促进Akt在Ser473位点磷酸化后形成P-Akt,有利于对多下游多个靶点的调控,比如调控凋亡蛋白Caspase家族促进抗凋亡机制的活化,增加细胞存活[15]。如图5所示,与正常对照组比较,持续缺氧导致H9c2细胞中p-Akt蛋白显著过表达(P<0.01);牦牛血低聚肽进一步促进了缺氧细胞中的p-Akt蛋白过表达且呈剂量依赖性,其中高、中剂量组过表达最明显(P<0.01)。持续缺氧也导致细胞中Akt蛋白过表达,但牦牛血低聚肽对缺氧细胞中AKt蛋白表达水平无显著影响(P>0.05)。计算p-Akt/Akt的比值,与正常组相比,缺氧组p-Akt/Akt的比值为正常对照组的5.55%,明显降低(P<0.01);与缺氧组相比,牦牛血低聚肽各剂量均能增加p-Akt/Akt的水平,分别为正常对照组的7.6%,35.7%,38.6%,高、中剂量组增加最为明显(P<0.01)。结果提示,牦牛血低聚肽对缺氧心肌细胞的保护作用可能与PI3K-Akt信号转导通路有关。
存活素蛋白(Survivin)具有抑制细胞凋亡和调节细胞周期的双重功能[16-17]。与正常对照组比较,缺氧诱导Survivin蛋白表达量显著下降(P<0.01);而牦牛血低聚肽干预缺氧H9c2细胞可剂量依耐性地促进Survivin蛋白表达水平提高,其中高、中剂量组增加最明显(P<0.01)。

与正常对照组相比,# P<0.05,## P<0.01;与缺氧组相比,* P<0.05,** P<0.01
图3 牦牛血低聚肽对缺氧H9c2细胞线粒体膜电位的影响
Figure 3 Effect of yak blood oligopeptide on mitochondrial membrane potential of hypoxia H9c2 cells (n=6)

与正常对照组相比,## P<0.01;与缺氧组相比,** P<0.01
Figure 4 Effect of yak blood oligopeptide on cytochrome C release from mitochondria of hypoxia-induced H9c2 cells (n=6)
2.6 牦牛血低聚肽对缺氧H9c2细胞中Caspase-3与Caspase-9表达的影响
调控细胞凋亡的蛋白分布在线粒体外膜上[12],主要包括抑制细胞凋亡的蛋白[18]和促进细胞凋亡的蛋白,具有维持或破坏线粒体膜完整性的作用[19]。正常情况下,这两类蛋白的表达量处于相对平衡的状态,当缺氧介导细胞时,促凋亡蛋白会过表达而破坏线粒体,进而促进细胞调亡发生[20],而当抑制细胞凋亡蛋白表达量较高时,可抑制细胞调亡。如图6所示,与正常对照组比较,持续缺氧导致H9c2细胞中凋亡蛋白Caspase-3[图6(a)]以及Caspase-9[图6(b)]极显著过表达(P<0.01);而牦牛血低聚肽干预则可剂量依赖性地下调这2个凋亡蛋白的表达,其中高、中剂量组减少最明显(P<0.01)。此结果提示,抑制缺氧条件下凋亡蛋白Caspase-3/-9蛋白的表达有可能是牦牛血低聚肽发挥细胞缺氧损伤保护作用的机制之一。

与正常对照组相比,# P<0.05,## P<0.01;与缺氧组相比,* P<0.05,** P<0.01
图5 牦牛血低聚肽对缺氧条件下H9c2细胞中p-Akt、Akt、Survivin蛋白表达的影响
Figure 5 Effect of yak blood oligopeptide on expression of p-Akt, Akt and Survivin proteins in hypoxia-induced H9c2 cells (n=6)
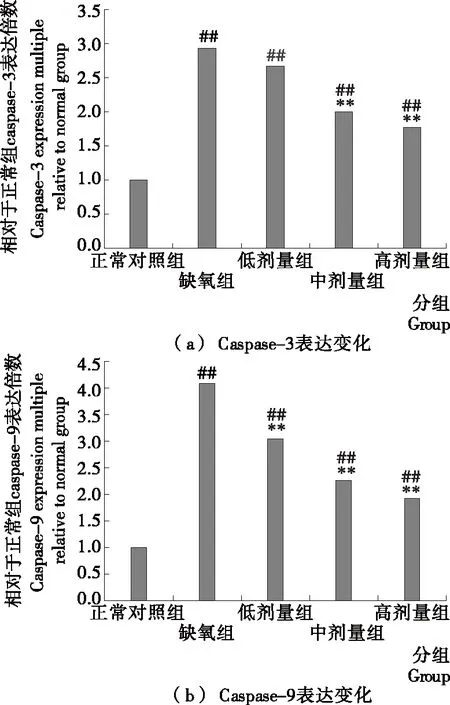
与正常对照组相比,## P<0.01;与缺氧组相比,** P<0.01
Figure 6 Effect of yak blood oligopeptide on expression of Caspase-3 and Caspase-9 proteins in hypoxi-ainduced H9c2 cells (n=6)
2.7 牦牛血低聚肽对缺氧H9c2细胞中P13K、AKt、Caspase-3、Caspase-9、HIF-1α基因表达的影响
本试验检测了5个与缺氧细胞凋亡相关的基因,结果见表1。持续缺氧导致H9c2细胞中的Caspase-3/-9的mRNA表达水平显著升高(P<0.01);而牦牛血低聚肽预处理组则可下调这2个凋亡基因的表达,其中高剂量组减少最明显(P<0.01);Caspase-3/-9的mRNA表达水平的变化趋势与2.5测定的蛋白结果对应。结果提示,牦牛血低聚肽可通过抑制凋亡蛋白及其mRNA的表达从而发挥保护心肌细胞H9c2的作用。
与正常对照组相比,缺氧导致H9c2细胞中P13K的mRNA表达水平升高(P<0.05),而AKt的mRNA表达水平降低,但无显著差异(P>0.05);牦牛血低聚肽各剂量均能促进缺氧细胞P13K的mRNA表达水平的增加,其中高剂量组增加最明显(P<0.01),而对缺氧细胞中AKt的mRNA表达水平无显著影响(P>0.05);PI3K-Akt信号通路的mRNA表达水平的变化趋势与2.5测定的蛋白结果对应。
低氧诱导因子1α(HIF-1α)是机体调控低氧反应基因的核心转录因子[21],HIF-1α的mRNA表达水平升高可启动对多个下游低氧反应基因的调控[22],介导与缺氧有关的各种生理反应[23],有利于细胞适应低氧环境[24]。由表1可知,心肌细胞持续缺氧48 h诱导H9c2细胞中HIF-1α的mRNA表达水平明显升高(P<0.01),原因是缺氧抑制了PHD(脯氨酰羟化酶)活性导致HIF-1α的脯氨酰残基羟化受到抑制,进而抑制HIF-1α与肿瘤抑制蛋白VHL结合,使HIF-1α的mRNA表达呈指数方式增长[25]。本研究结果显示,牦牛血低聚肽干预缺氧细胞能剂量依耐性地增加HIF-1α的mRNA表达水平,其中高、中剂量组增加最明显(P<0.01)。结果提示,牦牛血低聚肽可通过诱导HIF-1α的mRNA表达水平升高进而提高细胞低氧适应性。

表1 牦牛血低聚肽对缺氧条件下H9c2细胞中P13K、AKt、Caspase-3、Caspase-9以及HIF-1α基因表达的影响†
† 与正常对照组相比,#P<0.05,##P<0.01;与缺氧组相比,* P<0.05,** P<0.01。
2.8 牦牛血低聚肽对细胞培养上清液中T-AOC、TNF-α的影响
缺氧诱导心肌细胞能量代谢紊乱、氧自由基增多,进而促进细胞膜脂质过氧化而导致细胞损伤,引起细胞凋亡[26],因此,总抗氧化能力(T-AOC,ABTS法)的强弱直接影响心肌细胞的存活状态,反映心肌细胞受损伤的程度。如表2所示,与对照组比较,缺氧组上清液的T-AOC极显著降低(P<0.01),而牦牛血低聚肽可提高心肌细胞上清液的T-AOC且显现出质量浓度依赖性(P<0.01),提示牦牛血低聚肽可减少细胞氧自由基、减少胞内脂质过氧化物的产生[27],从而保护心肌细胞。
由细胞外信号导致的细胞凋亡称为死亡受体途径[28],又称外源性凋亡途径。TNFR-Ⅰ和TNFR-Ⅱ是肿瘤坏死因子受体(TNFR)家族中的2个受体亚型[29],可介导细胞凋亡[30]。TNFR-Ⅰ经过三聚体化后可激活Caspase途径进而诱导细胞凋亡;TNFR-Ⅱ的激活可抑制NFκB的活性进而减少炎症因子TNF-α的释放,减少细胞凋亡[31]。本试验结果显示,缺氧组H9c2细胞上清液中TNF-α含量极显著增高(P<0.01);牦牛血低聚肽3个剂量组均能剂量依耐性地降低缺氧H9c2细胞上清液中TNF-α含量,其中高剂量组效果最明显(P<0.01)。结果提示,牦牛血低聚肽可通过死亡受体途径减少TNF-α含量而发挥对心肌细胞缺氧损伤的保护作用。>
表2牦牛血低聚肽对细胞培养上清液中T-AOC、TNF-α的影响†
Table2EffectofyakbloodoligopeptideonT-AOCandTNF-alphaincellculturesupernatant

分组TNF-α/(pg·mL-1)T-AOC/(U·mL-1)正常对照组58.242±11.003 0.720±0.031 缺氧组 235.002±17.050##0.150±0.011##低剂量组 191.024±11.855##∗∗0.180±0.008##∗中剂量组 121.189±10.290##∗∗0.504±0.016##∗∗高剂量组 82.958±8.967#∗∗0.571±0.016##∗∗
† 与正常对照组相比,#P<0.05,##P<0.01;与缺氧组相比,* P<0.05,** P<0.01。
3 结论
牦牛血低聚肽能够剂量依赖性地提高缺氧(37 ℃,5% O2)条件下大鼠H9c2心肌细胞的存活率、降低其凋亡率以及LDH的释放,表现出良好的缺氧细胞损伤防护功效。牦牛血低聚肽对缺氧H9c2大鼠心肌细胞的保护作用可能与其清除细胞氧自由基、抗细胞膜脂质过氧化;抑制线粒体膜电位降低、抑制线粒体中细胞色素C的释放、增加细胞中抗凋亡蛋白(Survivin)的表达、抑制凋亡蛋白(Caspase-3、Caspase-9)的表达、介导PI3K-Akt信号通路以及影响编码上述蛋白的mRNA水平有关。在牦牛血低聚肽作用下抗缺氧相关蛋白之间的关联和变化关系有待于在分子水平进一步研究。

