三氟甲磺酸促进联苯基氮丙啶重排芳构化反应合成菲环
李 妍,崔 弘,顾 楠,覃家净,任 静,王 魁,邢思洋
(1.天津师范大学 化学学院,天津 300387;2.天津师范大学无机-有机杂化功能材料化学教育部重点实验室,天津 300387;3.天津师范大学天津市功能分子结构与性能重点实验室,天津 300387)
菲是由互相骈合的3个苯环组成的稠环芳烃,广泛存在于具有生物活性的天然产物和合成化合物中[1-3].菲环化合物具有优良的抗癌[4]、抗菌[5]、抗过敏[6]和抗疟活性[7],代表性化合物有娃儿藤碱[8]和马兜铃内酰胺[9]等,多应用于医药化学领域.菲环化合物也被用做合成生物活性化合物的中间体,研究者已发展了多条基于菲环中间体的吗啡合成路线[10].此外,因菲环衍生物具有独特的光电性质,也引起了材料化学研究者越来越多的关注,如菲环衍生物已被广泛应用于有机发光半导体和光致发光材料的研究中[11-13].虽然已存在许多菲环的合成方法[14-16],但考虑到菲环在医药化学和材料化学应用中的重要性,继续发展通用、高效的菲环合成方法仍具有重大意义.
氮丙啶[17-18]是最小的含氮杂环,分子内部具有较强的环张力.当氮丙啶的氮原子上连有磺酰基时,由于磺酰基强烈的吸电子效应降低了三元环上的电子云密度,使得这类氮丙啶表现出极高的亲核开环活性,能够在温和的反应条件下与多种杂原子亲核试剂[19]、碳原子亲核试剂[20]等发生区域选择性的开环反应.本研究经Suzuki反应、Wittig反应和氮杂环丙烷化反应3步合成了一类联苯取代磺酰基氮丙啶,三氟甲磺酸(TfOH)催化下反应体系中微量的水与氮丙啶发生开环,随后重排和芳构化,最终合成菲环化合物.在此基础上,对该反应的条件进行优化,进一步提出了可能的反应机理并且加以实验验证.
1 材料与方法
1.1 仪器与试剂
仪器:400 MHz核磁共振波谱仪,CDCl3为溶剂,美国Brucker公司;ZAB-HS型高分辨质谱仪,英国VG公司.
试剂:所有溶剂均为分析纯,均由天津化学试剂六厂生产,使用前根据试剂标准纯化过程进行纯化;其他化学药品均购于上海安耐吉化学有限公司和天津希恩思生化科技有限公司,未经纯化直接使用.
1.2 实验步骤
1.2.1 联苯取代氮丙啶5的合成
联苯取代氮丙啶5的合成路线如图1所示.

图1 联苯取代氮丙啶5的合成路线Fig.1 Synthesis route of biphenyl-substituted aziridine 5
联苯取代醛3的合成步骤:氩气保护下,向反应瓶中依次加入邻溴苯甲醛1(10mmol)、苯硼酸2(10mmol)、N,N-二甲基甲酰胺(DMF)(3 mL)、水(1.5 mL)和碳酸钠(10 mmol).室温下搅拌5 min后,加入Pd(OAc)2(0.25 mmol),室温搅拌过夜.反应混合物用乙酸乙酯稀释(200 mL),用水(100 mL)洗涤2次,卤水(100 mL)洗涤1次,无水硫酸钠干燥.水泵减压下旋转蒸发除去溶剂,得到联苯取代醛3,产物未经纯化直接应用于下一步合成.
联苯取代烯烃4的合成步骤:氩气保护下,先向反应瓶中加入四氢呋喃(THF)(50 mL)和三苯基甲基碘化膦(12 mmol),搅拌,分批加入叔丁醇钾(12 mmol),之后室温下反应1 h.将联苯取代醛3(8 mmol)逐滴加入反应体系,室温反应24 h.过滤,水泵减压下旋转蒸发除去溶剂,残余物采用硅胶进行柱层析,淋洗剂为石油醚,得到的纯化产物即为联苯取代烯烃4.制备化合物4的总收率:4a,76%;4d,75%;4e,63%;4f,63%;4g,63%;4h,72%;4i,69%;4j,62%;4k,72%;4l,64%;4m,40%;4n,60%.
联苯取代氮丙啶5的合成步骤:氩气保护条件下,向三口反应瓶中先加入乙腈(30 mL),再加入I2(0.25 mmol)搅拌至碘粒全部溶解,随后依次加入烯烃4(5 mmol)、PhI和NTs的混合物(5 mmol,物质的量之比为1∶1)、KI(0.125 mmol).室温条件下搅拌5 h.反应通过TLC点板检测,最后向反应体系加入乙酸乙酯(200 mL)和卤水(100 mL),分液,有机相用硫酸钠干燥.水泵减压下旋转蒸发除去溶剂,残余物采用硅胶进行柱层析,淋洗剂为石油醚和乙酸乙酯的混合液(体积比为10∶1),纯化后的产物即为联苯取代氮丙啶5.
1.2.2 联苯取代氮丙啶5的表征
使用400 MHz核磁共振波谱仪,以CDCl3为溶剂,测定化合物5的1H NMR和13C NMR谱.
5a:产率86%,无色液体.1HNMR(400MHz,CDCl3)δ 7.74(d,J=8.3 Hz,2H),7.37(dt,J=13.9,6.9 Hz,3H),8.64~6.72(m,14H),7.27~7.16(m,8H),3.72(dd,J=7.2,4.5 Hz,1H),4.87~1.79(m,7H),2.75(d,J=7.3 Hz,1H),2.37(s,3H),2.18(d,J=4.5 Hz,1H);13C NMR(100 MHz,CDCl3)δ 144.60,142.05,139.80,134.79,132.46,129.77,129.68,129.26,128.43,127.96,127.87,127.67,127.50,125.81,39.43,36.82,21.63.C21H19NO2SNa(M+Na)+HRMS(ESI)计算值为372.102 9;实验值为372.103 4.
5b:产率64%,无色液体.1HNMR(400MHz,CDCl3)δ 8.36(d,J=8.7 Hz,2H),8.11(d,J=8.7 Hz,2H),7.50~7.38(m,3H),7.33(dt,J=20.7,7.8 Hz,5H),7.22(d,J=7.5 Hz,1H),3.92(dd,J=7.2,4.7 Hz,1H),2.95(d,J=7.3 Hz,1H),2.38(d,J=4.6 Hz,1H);13CNMR(100MHz,CDCl)3δ150.63,143.82,142.24,139.58,131.59,130.03,129.23,128.57,128.32,127.82,127.71,125.47,124.30,40.29,37.41.C20H16N2O4SNa(M+Na)+HRMS(ESI)计算值为403.0723;实验值为403.072 8.
5c:产率60%,无色液体.1HNMR(400MHz,CDCl3)δ 7.70(d,J=8.6 Hz,2H),7.58(d,J=8.5 Hz,2H),7.44~7.31(m,3H),7.28~7.20(m,4H),7.19~7.13(m,2H),3.74(dd,J=7.2,4.6 Hz,1H),2.77(d,J=7.3 Hz,1H),2.22(d,J=4.6Hz,1H);13CNMR(100MHz,CDCl3)δ 142.16,139.72,137.00,132.41,132.07,129.90,129.41,129.26,128.85,128.50,128.08,127.75,127.60,125.65,39.80,37.03.C20H16BrNO2SNa(M+Na)+HRMS(ESI)计算值为435.997 7;实验值为435.998 3.
5d:产率55%,黄色液体.1HNMR(400MHz,CDCl3)δ 8.16(dd,J=8.4,2.1 Hz,1H),8.08(d,J=2.0 Hz,1H),7.85(d,J=8.1 Hz,2H),7.50(q,J=6.1 Hz,3H),7.43(d,J=8.4 Hz,1H),7.40~7.31(m,4H),3.80(dd,J=7.1,4.4 Hz,1H),2.89(d,J=7.2 Hz,1H),2.46(s,3H),2.30(d,J=4.3 Hz,1H);13C NMR(100 MHz,CDCl)3δ148.30,147.48,145.14,137.71,134.90,134.48,130.97,129.90,128.90,128.80,128.04,122.82,121.47,38.30,37.26,21.68.C21H18N2O4SNa(M+Na)+HRMS(ESI)计算值为417.087 9;实验值为417.088 5.
5e:产率53%,无色液体.1HNMR(400MHz,CDCl3)δ 7.74(d,J=8.3 Hz,2H),7.37(dt,J=13.9,6.9 Hz,3H),8.64~6.72(m,14H),7.27~7.16(m,8H),3.72(dd,J=7.2,4.5 Hz,1H),4.87~1.79(m,7H),2.75(d,J=7.3 Hz,1H),2.37(s,3H),2.18(d,J=4.5 Hz,1H);13C NMR(100 MHz,CDCl3)δ 144.58,139.85,139.32,137.48,134.81,132.15,129.75,129.68,129.36,128.70,128.39,128.04,127.31,126.38,39.37,36.82,21.63,21.12.C22H21NO2SNa(M+Na)+HRMS(ESI)计算值为386.118 5;实验值为386.119 1.
5f:产率42%,无色液体.1HNMR(400MHz,CDCl3)δ 7.77(d,J=8.2 Hz,2H),7.40~7.18(m,7H),7.12(d,J=8.4Hz,1H),6.81(dd,J=8.4,2.7 Hz,1H),6.72(d,J=2.6 Hz,1H),3.78~3.64(m,4H),2.78(d,J=7.3 Hz,1H),2.39(s,3H),2.20(d,J=4.5 Hz,1H);13C NMR(100 MHz,CDCl3)δ 159.12,144.63,139.59,134.81,134.60,133.76,131.01,129.70,129.42,128.40,128.01,127.18,113.83,110.81,55.28,39.59,36.81,21.62.C22H21NO3SNa(M+Na)+HRMS(ESI)计算值为402.113 4;实验值为402.1140.
5g:产率68%,无色液体.1HNMR(400MHz,CDCl3)δ 7.74(d,J=8.3 Hz,2H),7.37(dt,J=13.9,6.9 Hz,3H),8.64~6.72(m,14H),7.27~7.16(m,8H),3.72(dd,J=7.2,4.5 Hz,1H),4.87~1.79(m,7H),2.75(d,J=7.3Hz,1H),2.37(s,3H),2.18(d,J=4.5Hz,1H);13C NMR(100 MHz,CDCl)3δ 163.21,160.74,144.66,144.03,143.96,138.64,134.67,129.68,129.01,128.54,128.36,128.34,127.94,127.90,127.86,116.58,116.37,114.64,114.43,38.83,36.81,21.57.C21H18FNO2SNa(M+Na)+HRMS(ESI)计算值为390.093 4;实验值为390.094 0.
5h:产率50%,无色液体.1HNMR(400MHz,CDCl3)δ 7.77(d,J=8.2 Hz,2H),7.43(td,J=8.8,4.4 Hz,3H),7.31~7.22(m,6H),7.17(d,J=9.0Hz,1H),3.69(dd,J=7.1,4.5Hz,1H),2.79(d,J=7.2Hz,1H),2.42(s,3H),2.20(d,J=4.4 Hz,1H);13C NMR(100 MHz,CDCl)3δ144.76,143.59,138.48,134.71,133.68,131.18,129.74,129.67,129.08,128.62,128.03,127.95,127.76,127.39,38.85,36.87,21.64.C21H18ClNO2SNa(M+Na)+HRMS(ESI)计算值为406.063 9;实验值为406.064 4.
5i:产率30%,无色液体.1HNMR(400MHz,CDCl3)δ 7.78(d,J=8.3 Hz,2H),7.31~7.23(m,7H),7.21~7.18(m,1H),7.11(t,J=8.7 Hz,2H),8.26~2.11(m,24H),3.71(dd,J=7.2,4.5Hz,1H),2.78(d,J=7.2 Hz,1H),2.41(s,3H),2.22(d,J=4.5 Hz,1H);13C NMR(100 MHz,CDCl3)δ 163.52,161.06,144.67,141.03,135.81,134.76,132.54,130.93,130.85,129.82,129.70,127.96,127.86,125.92,115.53,115.32,39.23,36.73,21.63.C21H18FNO2SNa(M+Na)+HRMS(ESI)计算值为390.093 4;实验值为390.094 0.
5j:产率38%,无色液体.1HNMR(400MHz,CDCl3)δ 7.74(d,J=8.3 Hz,2H),7.37(dt,J=13.9,6.9 Hz,3H),8.64~6.72(m,14H),7.27~7.16(m,8H),3.72(dd,J=7.2,4.5 Hz,1H),4.87~1.79(m,7H),2.75(d,J=7.3 Hz,1H),2.37(s,3H),2.18(d,J=4.5 Hz,1H);13C NMR(100 MHz,CDCl3)δ 144.58,139.85,139.32,137.48,134.81,132.15,129.75,129.68,129.36,128.70,128.39,128.04,127.31,126.38,39.37,36.82,21.63,21.12.C22H21NO2SNa(M+Na)+HRMS(ESI)计算值为386.1185;实验值为386.119 1.
5k:产率42%,无色液体.1HNMR(400MHz,CDCl3)δ 7.79(d,J=8.2 Hz,2H),7.31~7.20(m,8H),6.96(d,J=8.7 Hz,2H),3.86(s,3H),3.79(dd,J=7.2,4.5 Hz,1H),2.81(d,J=7.3 Hz,1H),2.41(s,3H),2.23(d,J=4.5 Hz,1H);13C NMR(100 MHz,CDCl3)δ 159.03,144.57,141.75,134.91,132.54,132.14,130.38,129.85,129.68,127.95,127.85,127.35,125.80,113.88,55.31,39.56,36.83,21.62.C22H21NO3SNa(M+Na)+HRMS(ESI)计算值为402.1134;实验值为402.114 0.
5l:产率40%,无色液体.1HNMR(400MHz,CDCl3)δ 7.74(d,J=8.3 Hz,2H),7.37(dt,J=13.9,6.9 Hz,3H),8.64~6.72(m,14H),7.27~7.16(m,8H),3.72(dd,J=7.2,4.5 Hz,1H),4.87~1.79(m,7H),2.75(d,J=7.3 Hz,1H),2.37(s,3H),2.18(d,J=4.5 Hz,1H);13C NMR(100 MHz,CDCl3)δ 159.51,144.59,141.98,141.22,134.81,132.49,129.69,129.65,129.45,127.99,127.85,127.75,125.73,121.74,115.07,112.96,55.29,39.33,36.88,21.63.C22H21NO3SNa(M+Na)+HRMS(ESI)计算值为402.1134;实验值为402.114 0.
5m:产率59%,无色液体.1HNMR(400MHz,CDCl3)δ 7.84~7.69(m,4H),7.42~6.85(m,22H),3.89~3.76(m,1H),3.72~3.59(m,1H),3.00~2.81(m,1H),2.72~2.50(m,1H),2.33(s,6H),1.48(d,J=3.0 Hz,3H),0.83(d,J=2.8 Hz,3H);13C NMR(100 MHz,CDCl3)δ 144.34,143.96,141.86,141.59,140.01,137.70,135.39,133.29,130.12,129.64,129.51,129.45,129.12,128.97,128.35,128.34,128.30,127.74,127.67,127.63,127.51,127.48,127.45,127.32,127.15,125.71,49.43,48.16,45.88,42.37,21.57,13.48,11.89.C22H21NO2SNa(M+Na)+HRMS(ESI)计算值为386.118 5;实验值为386.118 9.
5n:产率63%,无色液体.1HNMR(400MHz,CDCl3)δ 7.98(dd,J=16.2,7.8 Hz,4H),7.77(d,J=8.2 Hz,2H),7.63~7.29(m,23H),7.20(d,J=8.0 Hz,2H),3.47(dd,J=6.8,4.8 Hz,1H),3.37(dd,J=7.0,4.5 Hz,1H),2.62(d,J=7.2 Hz,1H),2.49(d,J=7.3 Hz,1H),2.45(s,3H),2.42(s,3H),2.23(dd,J=9.7,4.4 Hz,2H);13C NMR(100 MHz,CDCl3)δ 144.49,144.37,140.16,139.86,137.23,137.17,134.35,133.81,133.75,133.71,133.52,133.43,132.04,131.77,130.41,130.35,129.55,129.49,128.33,128.27,128.16,128.12,127.97,127.86,127.70,127.65,127.14,127.09,126.47,126.03,126.00,125.83,125.65,125.58,125.38,125.33,125.26,125.10,39.20,39.11,36.41,36.23,21.52.C25H21NO2SNa(M+Na)+HRMS(ESI)计算值为422.118 5;实验值为422.119 1.
1.2.3 三氟甲磺酸催化下联苯取代氮丙啶5重排芳构化合成菲6
联苯取代氮丙啶5重排芳构化合成菲6的化学反应通式如图2所示.
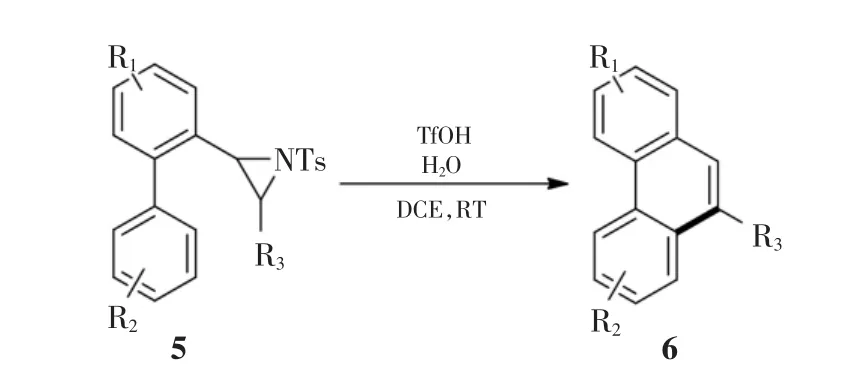
图2 联苯取代氮丙啶5重排芳构化合成菲6的化学反应通式Fig.2 General reaction formula of rearrangement and aromatization from biphenyl-substituted aziridine 5 to phenanthrene 6
氩气保护条件下,先向反应管中加入DCE(10 mL)溶液,再依次加入H2O(0.2 mmol)和联苯取代氮丙啶5(0.2 mmol).混合物在室温下搅拌10 min后,用注射器向反应体系中滴加三氟甲磺酸(0.2 mmol).混合物在室温下进行搅拌,用TLC检测跟踪反应,直至原料消失.加入饱和NaHCO3溶液(10 mL)淬灭反应,并用乙酸乙酯(50 mL×3)萃取,有机相用硫酸钠干燥.水泵减压下旋转蒸发除去溶剂,残余物采用硅胶进行柱层析,淋洗剂为石油醚,得到纯化的产物6.
2 结果与分析
2.1 三氟甲磺酸促进联苯取代氮丙啶重排芳构化反应条件的优化
不同条件下联苯取得的氮丙啶合成的菲环产物的产率如表1所示.

表1 不同条件下联苯取代氮丙啶5a重排芳构化合成菲6a的产率Tab.1 Rield of phenanthrene 6a via rearrangement and aromatization of biphenyl-substituted aziridine 5a under different conditions
由表1可以看出,在DCE中,室温下,催化剂三氟甲磺酸的用量为0.04 mmol时,菲6a的收率仅为12%.提高三氟甲磺酸的用量到0.20 mmol,产物收率提升至38%.添加适量的水对反应收率有显著影响.水的添加量为0.2 mmol时效果最好,菲6a的收率达到60%;水的添加量增加到1.0 mmol时,产物收率降低到25%.当采用0.2 mmol的水且将三氟甲磺酸的用量提升到0.40 mmol时,反应收率也并未获得明显提升(57%).反应温度由室温降低到0℃时,该环化反应无法进行.由此可知,联苯取代氮丙啶合成菲反应的最优条件为:催化剂三氟甲磺酸(0.2 mmol),溶剂DCE(10 mL),H2O(0.2 mmol),氮丙啶5(0.2 mmol),室温条件下反应1 h,产物收率为60%.
2.2 反应底物的适用范围
在2.1中最优反应条件的基础上,对联苯取代氮丙啶重排芳构化反应的底物范围进行拓展,最终合成了13种菲环化合物,结构式以及产率如表2所示.
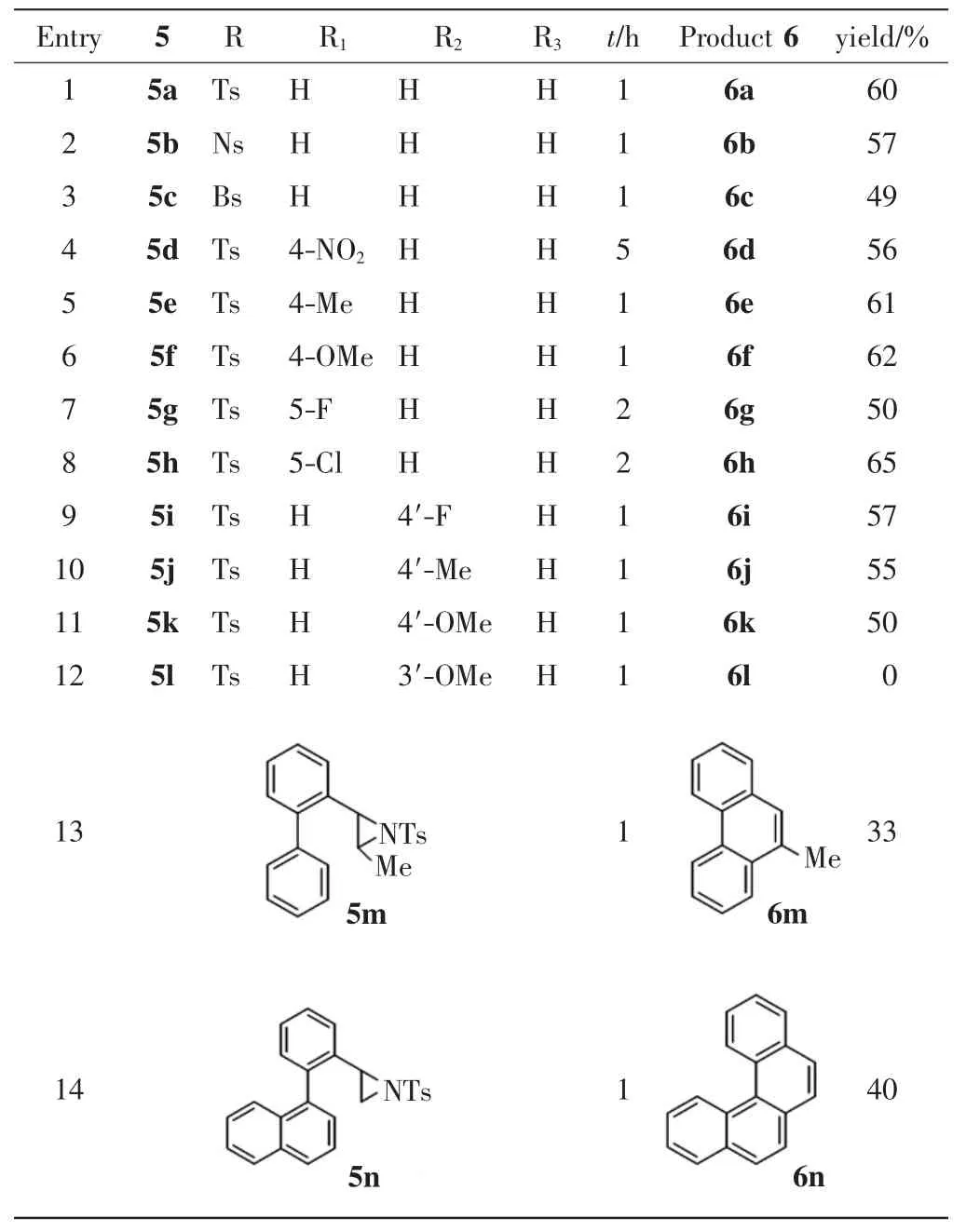
表2 由联苯取代氮丙啶5合成取代菲环化合物6Tab.2 Synthesis of substituted phenanthrene 6 from biphenyl-substituted aziridine 5
2.3 反应可能的机理
利用联苯取代氮丙啶成功合成了一系列取代菲环化合物后,本研究提出了一个可能的环化反应机理,如图3所示.反应体系中的水在三氟甲磺酸催化下对氮丙啶开环,得到开环中间体A.这一中间体中的醇羟基极易被酸质子化脱水,产生碳正离子中间体B.与氮原子相连接的碳原子上的氢进一步发生1,2-迁移,得到中间体C.随后中间体C发生六元环的傅克烷基化反应得到中间体D,D再经过酸催化脱除对甲苯磺酰胺,最终得到环化芳构化产物菲6a.
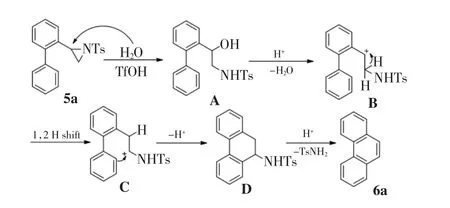
图3 联苯取代氮丙啶5重排芳构化反应的可能机理Fig.3 A suggested mechanism of rearrangement and aromatization of biphenyl-substituted aziridine 5
本研究对这一可能的反应机理进行了实验验证,过程如图4所示.
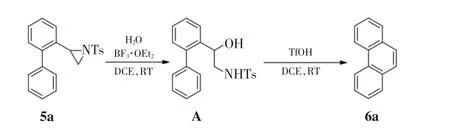
图4 验证反应机理的实验Fig.4 Experiments for investigating the reaction mechanism
在20%(质量分数)三氟化硼乙醚催化下,氮丙啶5a与水在室温下反应,以88%的收率得到开环中间体化合物A.将中间体A溶于1,2-二氯乙烷中,加入1倍体积的对甲苯磺酸,反应1 h后,得到菲环产物6,产率为65%.由此可以看出,环化反应的收率主要受限于中间体A向产物6a的转化.这可能是由于中间体C上的氮原子连接有强吸电子性的磺酰基,降低了中间体C的稳定性,使得中间体B经历1,2-氢迁移形成中间体C的过程效率较低,最终得到中等收率的产物6a.
2.4 菲环化合物6和中间体A的表征
菲6a、6b和6c,白色固体.1HNMR(400MHz,CDCl3)δ 8.72(d,J=8.2 Hz,2H),7.95~7.89(m,2H),7.77(s,2H),7.71~7.58(m,4H);13C NMR(100 MHz,CDCl3)δ 132.02,130.27,128.55,126.90,126.54,122.63.此化合物为已知物,核磁氢谱与文献[21]中的描述吻合.
2-硝基菲6d,黄色固体.1HNMR(400MHz,CDCl3)δ 8.74~8.68(m,2H),8.67~8.61(m,1H),8.36(dd,J=9.1,2.2Hz,1H),7.96~7.90(m,1H),7.84(d,J=8.9 Hz,1H),7.78(d,J=8.9 Hz,1H),7.76~7.68(m,2H);13C NMR(100 MHz,CDCl)3δ 145.74,134.15,133.17,131.33,129.20,128.88,128.53,127.53,126.77,124.19,124.02,123.45,120.08.此化合物为已知物,核磁氢谱与文献[21]中的描述吻合.
2-甲基菲6e和6j,白色固体.1H NMR(400 MHz,CDCl)3δ 8.66(d,J=8.2 Hz,1H),8.58(d,J=8.5 Hz,1H),7.88(d,J=7.7 Hz,1H),7.76~7.54(m,5H),7.49(dd,J=8.4,1.5 Hz,1H),2.57(s,3H);13C NMR(100 MHz,CDCl3)δ 136.30,132.19,131.70,130.34,128.50,128.32,128.12,126.90,126.66,126.46,126.10,122.54,122.43,21.45.此化合物为已知物,核磁氢谱与文献[22]中的描述吻合.
2-甲氧基菲6f和6k,白色固体.1HNMR(400MHz,CDCl)3δ 8.59(d,J=8.7 Hz,2H),7.87(d,J=7.7 Hz,1H),7.73(d,J=8.9 Hz,1H),7.67(d,J=8.9 Hz,1H),7.65~7.60(m,1H),7.54(t,J=7.0 Hz,1H),7.32~7.27(m,2H),3.97(s,3H);13C NMR(100 MHz,CDCl3)δ 158.27,133.43,131.02,130.43,128.54,127.52,126.65,126.44,125.56,124.63,124.25,122.13,117.06,108.57,55.40.此化合物为已知物,核磁氢谱与文献[22]中的描述吻合.
3-氟菲6g,白色固体.1H NMR(400 MHz,CDCl3)δ 8.55(d,J=7.7 Hz,1H),8.29(dd,J=11.1,2.5 Hz,1H),7.93~7.85(m,2H),7.75~7.59(m,4H),7.35(td,J=8.5,2.5Hz,1H);13CNMR(100MHz,CDCl)3δ162.81,160.37,132.21,131.85,131.77,130.59,130.51,129.71,129.67,128.62,127.16,126.61,126.28,126.14,126.11,122.83,115.71,115.48,107.87,107.65.此化合物为已知物,核磁氢谱与文献[23]中的描述吻合.
3-氯菲6h,黄色固体.1H NMR(400 MHz,CDCl3)δ 8.62(d,J=1.3 Hz,1H),8.57(d,J=8.0 Hz,1H),7.90~7.84(m,1H),7.79(d,J=8.5 Hz,1H),7.75~7.58(m,4H),7.53(dd,J=8.5,1.8 Hz,1H);13C NMR(100 MHz,CDCl3)δ 132.54,132.21,131.36,130.26,129.89,129.28,128.60,127.20,127.17,127.04,126.83,126.18,122.67,122.36.此化合物为已知物,核磁氢谱与文献[21]中的描述吻合.
2-氟菲6i,黄色固体.1H NMR(400 MHz,CDCl3)δ 8.66(dd,J=9.1,5.4 Hz,1H),8.62(d,J=8.2 Hz,1H),7.90(d,J=7.8 Hz,1H),7.78(d,J=8.9 Hz,1H),7.67(dd,J=7.9,5.5 Hz,2H),7.60(t,J=7.4 Hz,1H),7.53(dd,J=9.4,2.6 Hz,1H),7.40(td,J=8.7,2.7 Hz,1H);13C NMR(100 MHz,CDCl3)δ 162.51,160.07,133.45,133.36,131.48,130.09,128.69,128.22,126.97,126.90,126.39,126.13,126.10,125.00,124.91,122.42,115.57,115.33,112.64,112.44.此化合物为已知物,核磁氢谱与文献[21]中的描述吻合.
9-甲基菲6m,白色固体.1HNMR(400MHz,CDCl3)δ 8.73(d,J=7.4 Hz,1H),8.66(d,J=7.8 Hz,1H),8.07(d,J=8.4 Hz,1H),7.81(d,J=7.4 Hz,1H),7.61(ddd,J=19.0,10.7,5.0Hz,5H),2.75(s,3H);13CNMR(100 MHz,CDCl3)δ 132.48,132.09,132.02,130.38,129.67,127.82,126.72,126.58,126.51,126.21,125.80,124.66,123.00,122.45,20.03.此化合物为已知物,核磁氢谱与文献[22]中的描述吻合.
苯并-3,4-菲6n,白色固体.1H NMR(400 MHz,CDCl3)δ 9.15(d,J=8.2 Hz,2H),8.03(d,J=7.6 Hz,2H),7.91(d,J=8.2 Hz,2H),7.84(d,J=8.3 Hz,2H),7.67(dd,J=17.4,7.2 Hz,4H);13C NMR(100 MHz,CDCl)3δ133.47,130.97,130.28,128.53,127.89,127.45,126.83,126.11,125.84.此化合物为已知物,核磁氢谱与文献[22]中的描述吻合.
中间体A:无色液体.1H NMR(400 MHz,CDCl3)δ 7.41(dd,J=20.1,7.8 Hz,3H),7.29~7.00(m,10H),4.74(d,J=6.3Hz,2H),3.02~2.91(m,1H),2.82(ddd,J=13.4,8.9,4.7 Hz,1H),2.26(d,J=8.2 Hz,4H);13C NMR(100 MHz,CDCl3)δ 143.38,140.89,140.18,138.01,136.70,130.22,129.67,129.03,128.41,127.93,127.88,127.38,127.00,125.94,68.98,49.44,21.51.C21H21NO3SNa(M+Na)+HRMS(ESI)计算值为390.113 4;实验值为390.113 9.
3 结论
本研究提供了一种合成菲环的通用方法.在三氟甲磺酸促进下,水与联苯取代氮丙啶发生开环反应,开环产物继而发生重排和芳构化,最终得到菲环产物.反应底物联苯取代氮丙啶的合成历经3步:首先,以邻溴苯甲醛、苯硼酸等为原料经Suzuki反应合成联苯取代醛;其次,通过Wittig反应将联苯取代醛转化为联苯取代烯烃;最后,经历氮杂环丙烷化反应得到联苯取代氮丙啶.联苯取代氮丙啶的化学结构经核磁氢谱、碳谱和高分辨质谱证实.获得反应底物后,本研究对反应条件进行筛选,优化三氟甲磺酸的用量、水的用量、反应温度等.获得优化条件后,对反应底物的适用范围进行拓展,成功合成了9种菲环化合物,产率为22%~65%.该实验具有原料易得、操作简单、反应时间短、条件温和、底物范围宽等优点,具有良好的应用发展前景.

