结直肠癌细胞免疫逃逸研究概况
解广东,王本军,白克运,周永坤
肿瘤免疫逃逸机制在结直肠癌的发生发展中起着决定性的作用。当机体免疫功能低下或被抑制时,癌变细胞借助多种机制逃避机体免疫系统的攻击,并在发展过程中改变自身的免疫原性,降低机体的免疫功能,帮助其逃避免疫监视而不断增殖恶变,从而增加结直肠癌的发生率。肿瘤的免疫逃逸受到机体多种免疫细胞的影响,其主要包括调节性T细胞(regulatory T cells,Treg)、自然杀伤(natural killer,NK)细胞、树突状细胞(dendritic cells,DC)、肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)、髓系抑制性细胞(myeloid-derived suppressor cells,MDSCs)等。多种免疫细胞与细胞因子构成一个复杂的网络调控系统,通过不同的机制作用于结直肠癌的免疫途径,最终使肿瘤细胞逃脱机体的免疫监视和免疫杀伤,促进了肿瘤细胞的免疫逃逸。本文就结直肠癌发生发展过程中与肿瘤免疫逃逸相关的细胞及其对免疫逃逸的影响机制的研究进展作一综述。
1 Treg通过直接接触、调节相关抗原及细胞因子水平抑制机体免疫功能
Treg作为T细胞亚群的一种,能抑制T细胞免疫功能,提高机体的免疫耐受。其主要来源于骨髓的造血干细胞,在胸腺发育成熟。研究显示[1],在肿瘤发生发展过程中,Foxp3+Tregs在外周血、淋巴结及肿瘤微环境中随着腺瘤向腺癌的发展而逐渐增多,与肿瘤进展呈显著正相关。Treg可通过与T细胞直接接触,抑制CD4+和CD8+T细胞的增殖,或通过减少IL-2的释放,抑制CD8+T细胞的增殖,或通过上调细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)抑制 T细胞的增殖及其对肿瘤抗原的免疫应答,从而在维持免疫耐受的同时,阻止了机体对肿瘤细胞的杀伤,导致了肿瘤细胞的免疫逃逸。其对宿主免疫功能的抑制作用并具有非抗原特异性、无主要组织相容性复合体(major histocompatibility complex,MHC)限制性的特点。Sundström等[2]研究显示,Treg通过高表达介导ATP水解为AMP的酶CD39,降低单核细胞活化内皮层的能力,减少效应T细胞向肿瘤的跨内皮转移和浸润,增强免疫抑制。Treg还可通过分泌细胞因子,如TGF-b1、IL-10等,抑制NK细胞、抗原呈递细胞(antigen-presenting cells,APC)、巨噬细胞的活性,或下调Smad7蛋白表达,并诱导CD4+CD25+T细胞表面表达Foxp3+,而转化为Treg,促进Treg增殖,形成恶性循环。Nakamura等[3]研究发现,TGF-β1可通过增加小鼠体内Treg数量来抑制机体的抗肿瘤免疫反应促进肿瘤的生长。张爱军等[4]发现,结直肠癌组织中Foxp3与IL-10的表达呈正相关,肿瘤细胞和Treg等细胞分泌免疫抑制性细胞因子IL-10,抑制淋巴细胞等免疫细胞的功能,介导肠道肿瘤的发生以及进展。此外,Treg可通过增加穿孔素/颗粒酶A的释放,杀伤NK细胞和CD8+T细胞。亦有相关研究报道,Treg能增加PGE2的释放,作为肿瘤微环境中的促炎媒介,通过降低体内IL-27的生成,促进肿瘤细胞的转移[5]。Akeus等[6]在其研究中使用白喉毒素,选择性清除荷瘤小鼠体内的Treg,发现T细胞在肿瘤附近的浸润及增殖显著增多,并通过上调趋化因子的表达增加趋化因子受体3阳性的T细胞的数量和IFN-γ mRNA的表达。因此,降低患者体内Treg的数量,不仅能增强体内效应T细胞的功能,亦能增加免疫细胞向肿瘤的浸润,对抗Treg的治疗可作为一种有效的抗肿瘤免疫疗法。
2 肿瘤细胞抑制NK细胞表面活化受体,逃避免疫杀伤
NK细胞作为机体固有免疫细胞,不需特异性抗原的刺激即可识别并杀伤肿瘤细胞,调节获得性免疫应答,是机体抗肿瘤免疫的第一道防线,其功能发挥主要与NK细胞表面活化受体及抑制性受体的表达有关。生理情况下,活化受体识别感染细胞和肿瘤细胞的抗原信号来启动免疫应答。而抑制性受体,通过识别自我抗原而避免对正常细胞的杀伤。由于活化受体信号与抑制性受体信号相当,NK细胞处于静息状态[7]。当细胞发生恶性转化时,MHC I类分子表达缺乏或降低,减少NK细胞抑制性信号传递,NK细胞通过对受体识别,启动活化信号,加快增殖,并促进IFN-γ、TNF-α等细胞因子的分泌及相关免疫细胞的活化及成熟,发挥对肿瘤细胞的免疫杀伤功能[8]。然而,肿瘤细胞仍可通过多种机制逃避NK细胞的免疫识别和杀伤,抑制NK细胞活化,削弱其介导的抗肿瘤作用或影响NK细胞的成熟,最终使肿瘤细胞存活或发生转移[9]。如TGF-b1可通过阻碍NK细胞表面活化受体(NK group 2 member D, NKG2D)的表达及其介导的信号通路,同时抑制NK细胞分泌TNF-α、IFN-γ等细胞因子,IL-10可抑制NK细胞免疫监视功能及细胞毒作用,发挥免疫抑制作用,共同促进肿瘤的免疫逃逸。相关研究证实[10],通过降低机体TGF-β1、IL-10的含量,可增加NKG2D在NK细胞表面表达,加强NK细胞对结直肠肿瘤细胞的杀伤作用。此外,吲哚胺2,3-双加氧酶 (indoleamine 2,3-dioxygenase,IDO) 抑制NK细胞向肿瘤组织聚集,降低其对肿瘤细胞的敏感性,同时下调NKG2D、NK细胞活化性受体之一(NKp30)的表达及IL-2诱导的NK细胞扩增,促进结直肠肿瘤细胞的免疫逃逸[11]。
3 肿瘤微环境抑制DC发育、募集,促进免疫逃逸
DC是机体专职抗原呈递细胞,在受到肿瘤抗原刺激后,可通过多种机制加强机体对肿瘤细胞的杀伤,(1)分泌多种趋化因子、细胞因子刺激T淋巴细胞的活化,诱导特异性T细胞至肿瘤部位;(2)与肿瘤细胞直接接触,抑制其生长;(3)释放囊泡小体,刺激相关CD8+T细胞的增殖;(4)诱导特异性细胞毒T淋巴细胞的免疫杀伤反应。然而,肿瘤细胞在发生发展过程中,亦进化出特定的机制,引起DC数量的减少,并抑制DC介导的免疫功能,如肿瘤免疫抑制微环境通过影响DC的分化,阻碍DC细胞的迁出,抑制了DC表型和功能的成熟进程,同时通过抑制DC向肿瘤组织募集,导致其不能有效地识别肿瘤表达的抗原信号。研究表明[12],在实体瘤局部,DC浸润程度和功能状态与预后显著相关。Treg在肿瘤微环境中能抑制DC的成熟,而未成熟DC又能进一步诱导Treg的产生,从而形成了免疫抑制的恶性循环,并通过CTLA-4下调DC表面受体的表达,不能有效激活T细胞,引起免疫耐受,促进肿瘤细胞的免疫逃逸。相关研究发现, DC细胞表面Toll样受体识别病原的功能低下与DC的免疫耐受密切相关,通过激活Toll样受体-7/8/9信号通路可以逆转DC的免疫耐受状态, 亦可解除Treg的免疫抑制[13],而激活Toll样受体-4则能抑制了结肠癌患者DC的免疫功能,从而促进了肿瘤的免疫逃逸[14]。肿瘤微环境内固有DC还可通过IFN-γ刺激等途径激活其表达IDO的能力,在IDO上调的同时,诱导具有表达IDO能力的DC向肿瘤微环境聚集,共同发挥强大的免疫抑制作用,引起肿瘤细胞的免疫逃逸。
4 肿瘤细胞诱导TAM向 M2型巨噬细胞极化,促进免疫逃逸
TAM多数来源于外周血单核细胞,向肿瘤迁移并分化,在肿瘤微环境中发育成熟。TAM可分为M1型和M2型,在肿瘤的免疫应答过程中,前者可发挥递呈抗原和吞噬肿瘤细胞的作用。Edin等[15]发现,肿瘤微环境的M1巨噬细胞浸润增加与结直肠癌患者较好的预后相关。然而M1型巨噬细胞也具有促炎作用,持续的炎症反应通过产生诱变的活性氧和无氮自由基而有助于肿瘤的进展。研究显示[16],磷脂酶D4的表达可以显著减少M1型巨噬细胞促炎因子的分泌,抑制结直肠癌细胞增殖并促进其凋亡。M2型巨噬细胞对肿瘤杀伤活性低下,并能抑制CD8+T细胞的细胞毒性,诱导局部免疫耐受,促进肿瘤细胞的免疫逃逸。在肿瘤微环境中,肿瘤细胞通过分泌多种细胞因子(巨噬细胞集落刺激因子、PGE-2、TGF-β1、IL-10、IL-6等)将巨噬细胞调节和极化成M2型巨噬细胞,故肿瘤微环境中的TAM倾向于M2免疫抑制表型的表达,Shinohara等[17]研究显示,结直肠癌细胞通过释放含有miR-145胞外囊泡,下调组蛋白脱乙酰化酶11,调节巨噬细胞极化为M2表型,促进结直肠癌的发展。此外,高密度的M2型巨噬细胞可以在侵袭性癌细胞周围形成密集的屏障,同时巨噬细胞与癌细胞的融合,也促进宿主基质和TAM之间的相互作用,使肿瘤细胞获得与宿主相同的免疫表型特征,减少宿主免疫系统的识别及杀伤,促进了肿瘤细胞的免疫逃逸[18]。TAM的促肿瘤效应还与其分泌细胞因子有关,如TAM是细胞因子IL-6的主要分泌来源,IL-6诱导肿瘤细胞中信号转导蛋白及转录激活因子-3介导的IL-10产生,共同促进TGF-β1的生成及上皮间质转化,抑制T细胞增殖及杀伤效应,激活Treg,在结直肠癌的免疫逃逸中起关键作用,与预后不良有关[19-20]。
5 MDSCs通过多机制发挥免疫抑制效应
MDSCs是一种具有免疫抑制功能的异质性细胞群体,主要包括髓系前体细胞和未成熟髓样细胞(immature myeloid cell,IMC)。正常机体内,IMC会迁移到不同的外周器官,并分化为成熟的DC、粒细胞或巨噬细胞,发挥正常的免疫功能,在发生肿瘤、感染等病理情况下,免疫抑制性因子分泌增加,MDSCs分化过程受阻,停留在各个分化阶段,导致MDSC增加并被激活,成为具有免疫抑制功能的细胞。MDSCs可以被募集到肿瘤微环境、淋巴结及外周血中,而肿瘤来源的粒细胞集落刺激因子(granulocytecolony stimulating factor,G-CSF)是导致MDSCs聚集的关键起始因子。Li等[21]研究显示,G-CSF在小鼠肠癌模型中呈现高表达,且与MDSCs在肠癌组织中的高募集相一致,特异性抗体消除G-CSF可显著减少MDSCs的迁移和增殖,抑制肿瘤生长。MDSC可通过抑制NK细胞上的NKG2D活化受体的表达和减少IL-2、IFN-γ的释放而抑制NK活性及杀伤能力,并通过促进Treg的激活及增殖,间接抑制CD4+和CD8+T细胞的活化及增殖,此外,MDSC还可通过产生活性氧族(reactive oxygen species,ROS)抑制CD8+T细胞功能,进而发挥免疫抑制效应[22-23]。研究显示[24-25],结直肠癌患者外周血中,MDSC的比例和数量显著升高,且与患者TNM分期、有无淋巴结转移或复发转移密切相关,而根治性切除可以显著减少外周MDSC和Treg的比例。MDSC还可通过促进免疫检查点配体的表达,发挥免疫抑制作用,如IMC高表达程序性细胞死亡配体-1,促进T细胞的凋亡,同时IMC上调了CTLA-4的表达,阻断了DC的抗原呈递功能,抑制了T细胞的增殖及免疫活性[26]。此外,MDSCs还可通过抑制获得性免疫功能,进一步促进结直肠癌的逃逸,如通过消耗淋巴细胞所需的氨基酸,产生ROS及活性氮而诱发氧化应激反应,同时分泌高浓度的精氨酸酶、诱导型一氧化氮合酶以及IDO、IL-10等多种细胞因子抑制淋巴细胞的增殖和迁移,并诱导Treg发挥抑制免疫应答的作用,促进炎症和肿瘤的进展。研究显示[27-28],结直肠癌患者体内,血清血管内皮生长因子的表达水平显著升高,且与MDSCs的介导的免疫抑制相关。在小鼠模型中,去除MDSCs可以显著抑制肿瘤生长。因此,清除MDSCs或促进MDSCs向成熟髓系细胞转化,可以减少结直肠癌细胞的免疫逃逸,具有光明的应用前景。
综上所述,结直肠癌的免疫逃逸机制十分复杂,癌细胞可通过多种途径逃避或反击机体免疫系统,如图1,然而多数研究是针对肿瘤逃逸机制的某一方面,未能将肿瘤免疫逃逸的多种机制综合起来进行研究,从而忽略了逃逸机制间的相互影响、相互协同的关系。因此,需要进一步研究来探明结直肠癌的多种免疫逃逸机制及相互作用,将免疫细胞及细胞因子间错综复杂的联系阐述清楚,才能为结直肠癌的多靶点防治或高效疫苗的研制提供理论指导。
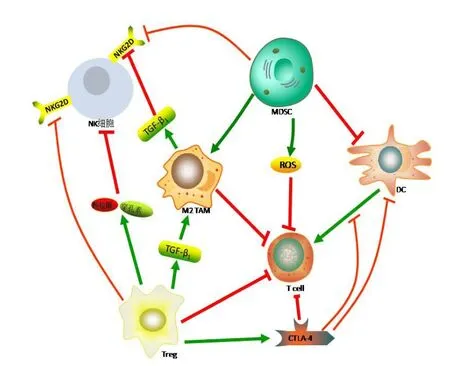
图1 结直肠癌免疫逃逸机制之间的关联性

