UV和UV/H2O2工艺对水中二嗪磷的降解
刘玉灿,苏苗苗,董金坤,张 岩,段晋明,李 伟
UV和UV/H2O2工艺对水中二嗪磷的降解
刘玉灿1*,苏苗苗1,董金坤1,张 岩1,段晋明2,李 伟2
(1.烟台大学土木工程学院,山东 烟台 264005;2.西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
在低压汞灯(LPUV,253.7nm)光照条件下,研究了过氧化氢(H2O2)加入量对二嗪磷降解动力学、产物生成和降解途径的影响规律与作用机理.结果表明,二嗪磷水溶液在单独UV和UV/H2O2工艺中的降解反应均符合准一级反应动力学,且反应速率常数()随H2O2加入量的增加而增大,H2O2加入量为0,5,10mg/L时的分别为0.0234,0.0301,0.0341min–1.在UV光照处理条件下,二嗪磷水溶液中的溶解性有机碳(DOC)随H2O2加入量的增加而降低,但其矿化度均相对较低(光照120min时的DOC去除率均低于20%).此外,UV光照处理时,H2O2的加入对二嗪磷光氧化降解产物的种类及生成量均存在显著影响.二嗪磷水溶液单独UV光照处理60min时检出了8种中间/降解产物,但经UV/H2O2工艺处理60min时仅检出了6种中间/降解产物,且不同H2O2加入量时的光氧化降解产物生成量或浓度及随UV光照处理时间的变化幅度与趋势均存在较大程度的差别.基于二嗪磷及其降解产物的定性、(半)定量分析结果,提出了二嗪磷水溶液在单独UV和UV/H2O2工艺中的降解途径与机理.
二嗪磷;紫外光;H2O2;降解动力学;中间产物;降解途径
大多数农药具有难降解特性,可在土壤和自然水体中长期存在,导致许多国家和地区水体中的农药浓度高出了环境水体可接受的浓度限值[1-2].
毒理学研究表明,大部分农药对人类和动物具有毒性或内分泌干扰作用[3].二嗪磷(diazinon)是一种常用的有机磷杀虫剂(OPPs),被世界卫生组织(WHO)划定为中等毒性II,其可通过抑制乙酰胆碱酯酶影响简单生物的神经系统[4],对人类也具有一定程度的免疫毒性、细胞毒性和基因毒性[5].
水和废水中的OPPs可采用单一氧化剂(如氯、臭氧和H2O2)氧化法处理,但其去除效率均相对较低[6].为提高OPPs的去除效率,能产生较高氧化电位自由基(如×OH)的高级氧化工艺(AOPs)被大量研究并在实际水处理中推广应用[7].×OH(ORP 2.8eV)能无选择性地将有机物氧化成CO2、H2O和矿物盐,对有机物的氧化效率和矿化度均较高,处理过程中的溶液毒性也会随之发生不同程度的改变.应用AOPs处理水中有机农药时,可通过不同的方式和途径产生×OH,因此该工艺能较好地满足不同条件下的水处理需要[8].
UV光照能有效去除水中的有机微污染物,可作为去除水和废水中有机微污染物和持久性有机污染物(POPs)的深度处理方法[9].UV与H2O2联用的AOPs具有高效的氧化能力,且不需要向水中加入不易去除或影响水质安全的化学药剂,因此该工艺是去除水中有机污染物最有应用前景的方法之一[5].许多学者对水中有机污染物在单独UV工艺或UV–AOPs中的去除效率进行了研究[8,10-11].例如,有使用单独UV和UV/H2O2工艺处理水中二嗪磷的研究报道,结果表明,二嗪磷在2种处理工艺中具有不同的降解速率[6,10].作者先前也系统地研究了溶液pH值对二嗪磷UV光解产物及降解途径的影响,发现溶液pH值会显著地影响二嗪磷的光氧化降解速率、降解产物种类与生成量及其随光照时间的变化趋势[12].先前研究多关注单独UV和UV/H2O2工艺中二嗪磷母体的去除效率[6,10,13],而二嗪磷在单独UV和UV/H2O2工艺中的降解动力学、降解产物生成与降解途径差异还未见报道.由于2种工艺对水溶液中二嗪磷的矿化程度均较低[14],因此有必要对二嗪磷经处理后的迁移转化规律与机理进行研究.
本研究以低压汞灯(LPUV)为光源,分别使用单独UV和UV/H2O2工艺对二嗪磷水溶液进行处理,采用超高效液相色谱–电喷雾离子源–三重四极杆质谱联用仪(UPLC–ESI–MS/MS)对二嗪磷及其降解产物进行定性与(半)定量分析,研究二嗪磷在2种工艺中的降解动力学、降解产物生成和降解途径,以便为采用2种处理工艺进行水处理时的二嗪磷氧化去除效率、迁移转化规律、降解产物生成提供理论依据,也可为2种工艺实际应用过程中的运行管理、水质预测提供基础数据和技术支持.
1 材料与方法
1.1 化学试剂
二嗪磷(纯度>99%)购买于AccuStandard公司;甲醇(HPLC级)购买于Merck公司;硫酸(GR)和氢氧化钠(GR)购买于国药集团化学试剂有限公司;磷酸二氢钠(GR)和磷酸氢二钠(GR)购买于天津市科密欧化学试剂有限公司;实验用水为超纯水(UPW, 18.2MΩ×cm, ρ(TOC)£1μg/L).
1.2 仪器与设备
UPLC–ESI–MS/MS和ACQUITYTMUPLC BEH C8色谱柱(2.1mm×100mm×1.7μm)购置于美国Waters公司(Milford, MA, USA); UPW制备系统(Purelab Ultra Analytic,英国ELGA公司);光化学反应器(上海比郎仪器有限公司),LPUV(广州泰普勒有限公司);紫外–可见分光光度计(DR5000,美国HACH公司);精密酸度计(PHS–3C,上海大普仪器有限公司).
1.3 色谱与质谱条件
使用UPLC–ESI–MS/MS对经UV光氧化处理后反应溶液中的二嗪磷及其光氧化降解产物进行定性、(半)定量分析,ACQUITY™ UPLC BEH C8色谱柱用于色谱分离.在全扫描(MS)模式下使用ESI+和ESI–同时采集数据,扫描的质荷比()范围设定为45~350.为确定待测样品中降解/中间产物的分子结构,在子离子扫描模式下对各产物进行了碰撞诱导裂解(CID),并对CID能量进行了优化.
色谱条件:流动相由甲醇(流动相A)和超纯水(流动相B)组成,恒流速(0.2mL/min)洗脱;流动相洗脱梯度和样品测定循环时间经一系列优化后设定为:5%A运行6min,随后在10min内升至100%A并保持运行5min,最后降至5%A并保持运行3min;每次进样量为10μL;色谱柱和样品室的温度分别设定为35,25℃.
质谱条件:采用电喷雾离子源(ESI),且在ESI+和ESI–模式下同时进行扫描数据的采集;毛细管电压设定为2.5kV;离子源温度和脱溶剂气(N2)温度分别设定为110和350℃;脱溶剂气(N2)、锥孔气(N2)和碰撞气(Ar)的流量分别设定为500L/h、30L/h和0.12mL/min.
1.4 实验方法与程序
光照试验在光化学反应器内进行,环形石英玻璃管内加入250mL待处理的二嗪磷水溶液,环形石英玻璃管中心轴线上安装一支发射波长为253.7nm的LPUV,测得光照反应时的光通量为1.18× 10–7Einstein/s.
使用UPW制备浓度为50mg/L的二嗪磷储备液,然后使用UPW将其进一步稀释成浓度为5mg/L的二嗪磷水溶液.试验前,使用磷酸缓冲盐(2mmol/L)和盐酸(1mol/L)将反应溶液的pH值缓冲调节至7.0,光照过程中按设定时间间隔取样,置于1.5mL玻璃进样瓶中待测.若不能及时测定,将样品置于冰箱中冷藏.本研究的实验数据结果均使用Origin进行绘图分析.
2 结果与讨论
2.1 二嗪磷的光氧化降解动力学研究
天然水体和实际水处理中的pH值多近中性,且pH=7.0时的二嗪磷UV光氧化产物种类与生成及降解途径更具代表性[12].因此,本研究使用2mmol/L的磷酸缓冲盐将二嗪磷水溶液(5mg/L)的pH值缓冲至7.0,光照反应前分别向二嗪磷水溶液中加入0,5, 10mg/L的H2O2,研究水溶液中的二嗪磷在以LPUV为光源条件下的降解反应动力学.
暗对照实验表明,二嗪磷(降低率均<3%)在一定浓度的H2O2溶液中可稳定存在.因此,光解和光催化降解是二嗪磷经UV光氧化处理后浓度降低的主要原因[12].经单独UV(0mg/L H2O2)和UV/H2O2工艺(5, 10mg/L H2O2)处理后,水溶液中二嗪磷的浓度与光照时间的关系见图1.
光氧化处理时,反应体系中二嗪磷的浓度(/0)随光照处理时间的增加而逐渐降低(图1).由于有机物的光氧化降解机理较为复杂,很难得到一个完全准确的动力学模型[6].文献中多采用一级反应动力学(ln(/0)=)对实验结果进行拟合,通过评估线性相关性的优劣,确定其反应是否符合一级反应动力学模型[1,6,12-13].
本研究对不同H2O2加入量条件下溶液中二嗪磷浓度随光照时间的变化按一级反应动力学进行了拟合,一级反应线性相关系数均较好(2=0.996~ 0.998),表明二嗪磷在单独UV和UV/H2O2工艺中的降解反应均符合一级反应动力学模型.H2O2浓度为0,5,10mg/L时,二嗪磷的一级反应速率常数()分别为0.0234,0.0301,0.0341min–1.
由上述结果可知,二嗪磷在UV/H2O2工艺中的降解速率较单独UV工艺中大.这是因为UV光照处理时,H2O2的加入可促使反应体系中生成氧化性较强且无选择性的×OH,在UV光解和×OH氧化的双重作用下,二嗪磷的光氧化降解速率较单独UV光解时大[6,10,13-14].当H2O2加入量由5mg/L增至10mg/L时,二嗪磷的降解速率出现大幅度提高,表明一定范围内增大H2O2浓度可促使反应体系中生成更多的×OH,使得二嗪磷的降解速率增大[10-11,15].且H2O2的浓度由0mg/L增至5mg/L时,的增加量高于H2O2浓度由5mg/L增至10mg/L时的增加量.这是因为高浓度H2O2的加入,会导致反应体系中的H2O2与目标物二嗪磷之间形成光量子竞争关系,造成溶液中二嗪磷吸收的光量子数量减少.此外,高浓度H2O2的加入也会导致H2O2与×OH发生反应,生成反应活性相对较低的HO2×[10].但H2O2浓度由5mg/L增至10mg/L的过程中,H2O2在UV光照反应体系中对农药降解的促进作用大于上述的负面作用.因此,在本研究加入的H2O2浓度范围内,二嗪磷的降解速率仍随加入到反应体系中H2O2浓度的增加而增大.相似的研究结果在先前文献中亦有报道[10-11].

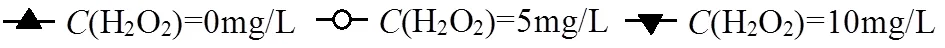
2.2 二嗪磷溶液经光氧化处理后的DOC变化
溶解性有机碳(DOC)是一项评价水体有机污染的综合性指标,常被用来表征和衡量水处理过程中的有机物去除效果或矿化程度[14].为研究UV光氧化处理时反应体系中有机物含量的降低或二嗪磷的矿化程度,本文对二嗪磷溶液中DOC随光照时间的变化关系和去除情况进行了研究.
由图2可知,相同光照时间条件下,溶液中DOC随H2O2浓度的增加而逐渐降低;向二嗪磷水溶液中分别加入初始浓度为0,5,10mg/L的H2O2,UV光照处理60min时的DOC去除率分别为5.7%,7.9%和10.0%.此外,相同H2O2加入量时,溶液的DOC随光照时间的增加亦呈现出持续降低的变化趋势.例如,UV光照H2O2浓度为5mg/L的二嗪磷水溶液60和120min时的DOC去除率分别为7.9%和16.0%.研究结果表明,二嗪磷在UV/H2O2工艺中的矿化程度较单独UV工艺中高,在UV/H2O2工艺中的矿化程度也随H2O2初始浓度的增加而增大.
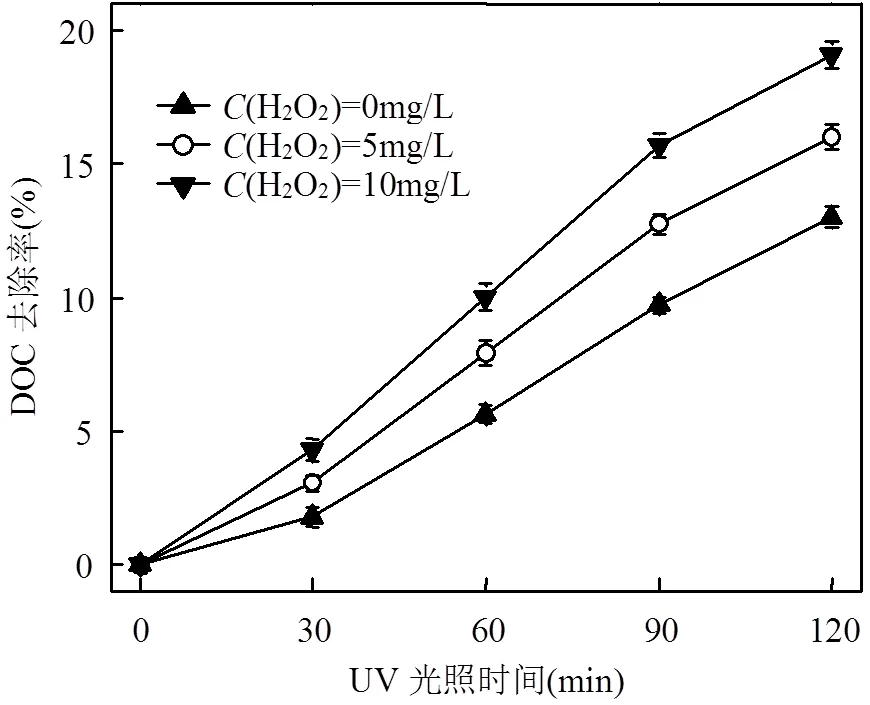
图2 不同H2O2加入量对含二嗪磷水中的DOC去除率随UV光照时间变化的影响
整体而言,UV光照3个H2O2初始浓度的二嗪磷水溶液时,DOC的去除率均相对较低(图2).例如,UV光照H2O2初始浓度为0,5,10mg/L的二嗪磷水溶液120min时的DOC去除率仅分别为13.0%, 16.0%和19.1%.上述结果表明,单独UV和UV/H2O2工艺对水溶液中二嗪磷的矿化度均相对较低,二嗪磷在2种光氧化工艺中均未被有效矿化为CO2和H2O,而只是在光氧化作用下降解转化成为了小分子有机中间产物或降解产物[22].在对含农药的水和废水进行处理时,尽管希望水中的农药能够达到完全或较高的矿化度,但实际水处理运行过程中(尤其在含有大量NOM或SOC的条件下)却很难实现[14].
因此,采用单独UV和UV/H2O2工艺处理水中二嗪磷时,除关注二嗪磷母体的去除率外,还要考虑其降解产物的种类、生成量及随光照时间的变化关系.
2.3 二嗪磷光氧化降解产物的鉴定
本研究对3个H2O2浓度(0,5和10mg/L)条件下UV光照前后的二嗪磷水溶液进行了测定分析.通过对光照前后反应溶液的总离子流图(TIC)进行对比分析,得到了二嗪磷溶液经光氧化处理后产生的新色谱峰(既产物峰).不同H2O2加入量条件下,二嗪磷水溶液经UV光照处理60min时的提取离子色谱图(EIC)见图3.
由图3可知,二嗪磷水溶液经单独UV和UV/H2O2工艺处理60min时的降解产物种类存在较大差别.单独UV工艺处理后,共检出了二嗪磷及其8种主要光氧化降解产物.为便于后续讨论,将图3(A)中9个色谱峰分别标记为P1、P2、P3、P4、P5、P6、P7、P8和P9(二嗪磷).而同条件下,经UV/H2O2工艺处理后的二嗪磷水溶液中共检出了P1、P2、P5、P7、P8、P9(二嗪磷)和P10等7个色谱峰(图3(B)),其中P10为经单独UV工艺处理后未检出的产物,但此工艺中未检出产物P3、P4和P6.上述结果表明,UV光照处理二嗪磷溶液时,H2O2的加入会影响二嗪磷UV光氧化产物的种类.研究表明,UV光照处理时,H2O2的加入能显著地影响农药阿特拉津(atrazine)经不同途径的转化量[11].
图3中色谱峰的停留时间(RT)及全扫描模式下采集的质谱(MS)信息见表1.为准确推导二嗪磷光氧化产物的分子结构,本研究以全扫描模式下测得的MS色谱图中各色谱峰对应的分子离子或最强碎片作为该物质的前级离子,在子离子扫描模式下对其进行CID,得到了各色谱峰对应的二级质谱(MS/MS)信息.二嗪磷(P9)及产物P7、P8、P10仅在ESI+模式下能测出,产物P1、P2仅在ESI–模式下能测出,产物P3、P4、P5、P6在ESI+和ESI–模式下均有响应.
基于采集的色谱(图3)和质谱信息(表1),并结合文献报道[12,16-17],推导出了二嗪磷溶液在单独UV和UV/H2O2工艺中主要光氧化降解产物的分子结构(表1).

2.4 二嗪磷光氧化产物的生成
不同H2O2加入量时,反应溶液中二嗪磷光氧化降解产物的浓度与UV光照处理时间的关系见图4. 其中,各产物的峰面积是在优化后的子离子模式下,通过提取产物离子的/积分得到.
P1(DEP)在3个H2O2浓度条件下的生成量不同,此结果与先前研究结果一致[10].其中,H2O2浓度为5mg/L时的DEP生成量高于H2O2浓度为0和10mg/L时的生成量.H2O2浓度为0和10mg/L时,溶液中DEP的浓度在光照60min时达到最大值;但当光照时间进一步增加时,其浓度却变化较小. 5mg/L H2O2初始加入量条件下,光照时间在0~ 40min时, DEP的浓度随光照时间的增加而增大;光照时间在40~90min时,DEP的浓度变化较小;光照时间由90min增至120min时,DEP浓度的增加幅度较大.
P2(DETP)为二嗪磷的主要光氧化产物之一[10,17-18].单独UV工艺处理时,溶液中DETP的浓度随光照时间的增加而持续增大;而在UV/H2O2工艺中,DETP的浓度随光照时间的增加呈现出先增大后降低的变化趋势,且其浓度均在光照40min时达到最大,但H2O2初始加入量为5mg/L时的DETP最大生成量稍大于H2O2初始加入量为10mg/L时的最大生成量.

表1 UV和UV/H2O2工艺中二嗪磷及其产物的色谱保留时间、MS和MS/MS质谱图中主要m/z及建议分子结构

续表1
注:表中加粗/碎片为对应物质在子离子模式下的前级离子.
P3、P4和P6在二嗪磷水溶液经单独UV工艺处理后均有检出,但在UV/H2O2工艺处理时未被检出(图4).表明二嗪磷在2种光氧化工艺中具有不同的降解产物,因此二嗪磷在2种处理工艺中的降解途径与机理亦不相同.
不同H2O2浓度条件下,反应溶液中P5(IMP)的浓度均随光照处理时间的增加呈现出先逐渐增大后不断降低的变化趋势.有研究表明,在LPUV光照条件下,P5会被氧化降解为产物P3、P4和P7[10,16,18].因此,二嗪磷水溶液在光照处理期间同时伴随着P5的生成与降解.处理初期,P5的生成量大于其降解量,导致反应体系中P5的浓度随UV光照时间的增加呈现出逐渐增大的变化趋势;处理一段时间后,P5的生成量小于了其降解量,造成反应体系中P5的浓度随UV光照时间的增加而不断降低[16].H2O2初始加入量为0,5,10mg/L时,P5的浓度达到最大值时的光照时间分别为40,30,20min,但3种条件下P5的最大浓度基本相同.上述结果表明,增大反应体系中H2O2的加入量会加快二嗪磷转化为P5的速率,但未影响P5的最大生成量.
P7在3个H2O2初始加入量条件下均有生成,且光照60min内,其浓度均随光照时间的增加而增大;但光照时间进一步增加时,3个H2O2浓度条件下P7的浓度均变化较小.
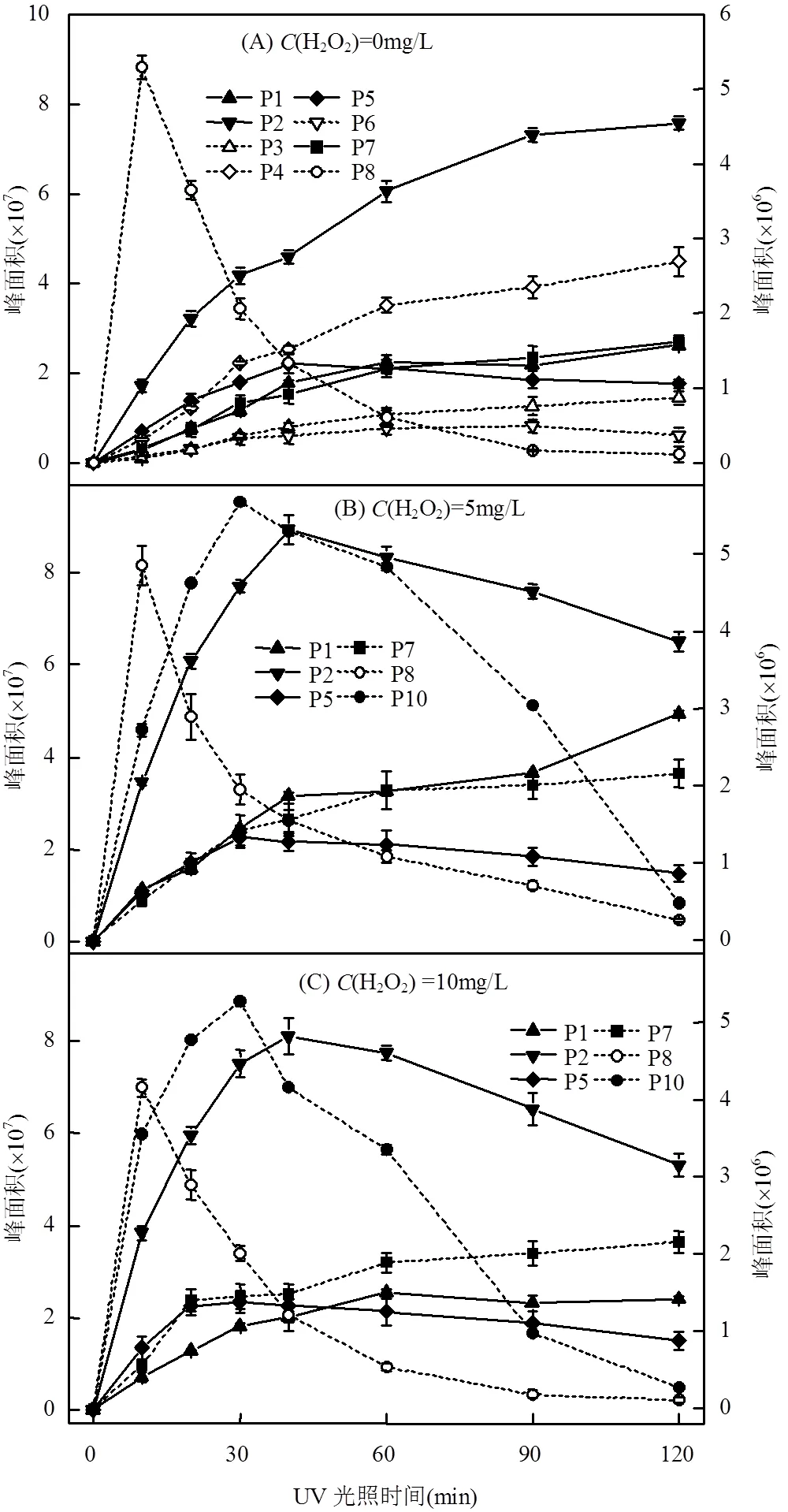
图4 不同H2O2加入量条件下二嗪磷光降解产物随UV光照时间的变化关系
实线使用左侧纵坐标,虚线使用右侧纵坐标
P8在单独UV和UV/H2O2工艺中均有生成,且浓度均在光照10min时达到最大值;当光照时间进一步增加时,P8的浓度均随光照时间的增加而降低.此结果与先前研究结果一致[19].
本研究中,二嗪磷溶液经单独UV工艺处理后未检出二嗪磷氧同系物P10(diazoxon),但在UV/ H2O2工艺中检出了P10[10,14,20].反应体系中P10的浓度随光照时间的增加呈现出先增大后降低的变化趋势,最大浓度均出现在UV处理30min时.P10在5mg/L H2O2初始加入量时的最大生成量稍高于10mg/L H2O2初始加入量时的最大生成量,但光照30min后,H2O2初始加入量为5mg/L的反应体系中P10浓度的降低速度明显低于H2O2初始加入量为10mg/L时的降低速度.
综上所述,二嗪磷在单独UV和UV/H2O2工艺中具有不同种类的降解产物,且同一种产物的生成量及随UV光照处理时间的变化幅度与趋势亦不完全相同.在UV/H2O2工艺中,H2O2的加入量未影响二嗪磷降解产物的种类,但对二嗪磷降解产物的生成量及其随光照时间的变化规律与趋势存在一定影响.
2.5 二嗪磷的光氧化降解途径
基于二嗪磷及其氧化产物的定性、(半)定量分析结果,并结合文献报道,本研究提出了LPUV光照条件下,水溶液中二嗪磷在单独UV和UV/H2O2工艺中的光氧化降解途径(图5).

图5 二嗪磷在单独UV和UV/H2O2工艺中的建议降解途径
单独UV工艺处理时,水溶液中的二嗪磷有3个主要光氧化降解途径[12].第一个途径为P9(二嗪磷)分子中嘧啶环上相连的P–O键发生断裂,生成了产物P5和P2(图5).有研究表明,该反应在水解、光解或受×OH攻击时均能发生[16,21].P5在UV光照作用下可转化为产物P3、P4和P7[10,16,18],其中P3和P4为嘧啶环的开环产物.第二个途径为二嗪磷分子中异丙基(–CH(CH3)2)的第一个C发生羟基化(–OH),转化为羟基化二嗪磷;该中间产物分子中的1–羟基–异丙基(–C(CH3)2OH)发生氧化反应和脱羧反应转化为羟基化乙基衍生物,进一步氧化后转化为P8(二嗪磷甲基酮)[16].P8分子中的二乙基硫代磷酸基团从嘧啶环上断裂,伴随着P2和P5的生成,P5的降解与上述二嗪磷的第一个降解途径相同.第三个途径为硫代磷酸基团中P=S键的氧化置换(P=O),生成了P10[16,19,21],后经羟基化反应转化为羟基化产物,进一步反应转化为羟基化乙基衍生物,最后转化为P6[16,22],P6分子中的二乙基磷酸基团从嘧啶环上断裂,生成了P1.
在UV/H2O2工艺中,二嗪磷的光氧化降解途径也主要有3个.其中,二嗪磷的2个降解途径与其在单独UV工艺中相似,只是P5的进一步降解时仅生成了P7.二嗪磷在UV/H2O2工艺中的第三个降解途径为二嗪磷硫代磷酸基团中的P=S键被氧化成P=O键,生成了P10,此反应在文献中亦有报道[10,14,20].
3 结论
3.1 二嗪磷水溶液在LPUV光照条件下的氧化降解反应符合准一级反应动力学模型,二嗪磷在单独UV工艺中的降解速率较UV/H2O2工艺中低,且在UV/H2O2工艺中的氧化降解速率随H2O2浓度的增加而增大.
3.2 二嗪磷溶液经单独UV和UV/H2O2工艺处理后的DOC去除率均较低,表明2种工艺均不能有效地将二嗪磷矿化,而只是将其氧化降解成不同种类的小分子中间产物或降解产物.
3.3 UV光照处理条件下,向二嗪磷溶液中加入H2O2会显著地影响二嗪磷光氧化降解产物的种类及生成量,二嗪磷水溶液经单独UV工艺处理后共检出了8种主要光氧化中间/降解产物,而经UV/H2O2工艺处理后的溶液中仅检出了6种主要光氧化中间降解产物,H2O2的加入及浓度还会显著地影响光氧化降解产物的生成量及随光照处理时间的变化趋势.
3.4 基于定性与(半)定量检测分析结果,本研究确定了二嗪磷在单独UV和UV/H2O2工艺中的主要降解产物种类及生成转化规律,提出了二嗪磷在2种工艺中的可能降解途径,二嗪磷发生的主要光氧化降解反应类型为异丙基的氧化、硫代磷酸基团中P=S键的氧化置换(P=O)、二乙基硫代磷酸基团或二乙基磷酸基团从嘧啶环上的断裂及嘧啶环的氧化开环.
[1] 刘玉灿,苏苗苗,张 岩,等.溶液制备过程引入的甲醇对阿特拉津UV光氧化速率和降解机理的影响 [J]. 化学学报, 2019,7(1):72–83. Liu Y C,Su M MZhang Y, et al. Influence rule of organic solvents methanol from sample preparation on degradation rate and mechanism of atrazine in UV–based oxidation processes [J]. Acta Chimica Sinica, 2019,77(1):72–83.
[2] Wang D, Singhasemanon N, Goh K S. A review of diazinon use, contamination in surface waters, and regulatory actions in California across water years 1992–2014 [J]. Environmental Monitoring and assessment, 2017,189(7):310-316.
[3] Ogasawara N, Matsushima M, Kawamura N, et al. Modulation of immunological activity on macrophages induced by diazinon [J]. Toxicology, 2017,379:22-30.
[4] Velki M, Meyer Alert H, Seiler T B, et al. Enzymatic activity and gene expression changes in zebrafish embryos and larvae exposed to pesticides diazinon and diuron [J]. Aquatic Toxicology, 2017,193:187- 200.
[5] Parker A M, Lester Y, Spangler E K, et al. UV/H2O2advanced oxidation for abatement of organophosphorous pesticides and the effects on various toxicity screening assays [J]. Chemosphere, 2017, 182:477-482.
[6] Real F J, Benitez F J, Acero J L, et al. Removal of diazinon by various advanced oxidation processes [J]. Journal of Chemical Technology & Biotechnology: International Research in Process, Environmental & Clean Technology, 2007,82(6):566-574.
[7] Reddy P V L, Kim K H. A review of photochemical approaches for the treatment of a wide range of pesticides [J]. Journal of Hazardous materials, 2015,285:325-335.
[8] Oturan M A, Aaron J J. Advanced oxidation processes in water/ wastewater treatment: principles and applications. A review [J]. Critical Reviews in Environmental Science and Technology, 2014, 44(23):2577-2641.
[9] Reddy P V L, Kim K H. A review of photochemical approaches for the treatment of a wide range of pesticides [J]. Journal of Hazardous Materials, 2015,285:325-335.
[10] Shemer H, Linden K G. Degradation and by-product formation of diazinon in water during UV and UV/H2O2treatment [J]. Journal of Hazardous Materials, 2006,136(3):553-559.
[11] Lekkerkerker Teunissen K, Benotti M J, Snyder S A, et al. Transformation of atrazine, carbamazepine, diclofenac and sulfamethoxazole by low and medium pressure UV and UV/H2O2treatment [J]. Separation and Purification Technology, 2012,96:33-43.
[12] 刘玉灿,段晋明,李 伟.溶液pH值对二嗪磷紫外光降解产物及降解途径的影响 [J]. 化学学报, 2015,73(11):1196-1202. Liu Y C, Duan J M, Li W. Influence of solution pH on photolysis intermediates and degradation pathway of diazinon during UV irradiation treatment [J]. Acta Chimica Sinica, 2015,73(11):1196– 1202.
[13] Fadaei A M, Dehghani M H, Mahvi A H, et al. Degradation of organophosphorus pesticides in water during UV/H2O2treatment: role of sulphate and bicarbonate ions [J]. Journal of Chemistry, 2012, 9(4):2015-2022.
[14] Ikehata K, El-Din M G. Aqueous pesticide degradation by hydrogen peroxide/ultraviolet irradiation and Fenton-type advanced oxidation processes: a review [J]. Journal of Environmental Engineering and Science, 2006,5(2):81-135.
[15] Clark K K, Mezyk S P, Abbott A, et al. Kinetic studies of the AOP radical-based oxidative and reductive destruction of pesticides and model compounds in water [J]. Chemosphere, 2018,197:193-199.
[16] Kouloumbos V N, Tsipi D F, Hiskia A E, et al. Identification of photocatalytic degradation products of diazinon in TiO2aqueous suspensions using GC/MS/MS and LC/MS with quadrupole time-of- flight mass spectrometry [J]. Journal of the American Society for Mass Spectrometry, 2003,14(8):803-817.
[17] Sancho J V, Pozo Ó J, Ibáñez M, et al. Potential of liquid chromatography/time-of-flight mass spectrometry for the determination of pesticides and transformation products in water [J]. Analytical and Bioanalytical Chemistry, 2006,386(4):987-997.
[18] Čolović M, Krstić D, Petrović S, et al. Toxic effects of diazinon and its photodegradation products [J]. Toxicology Letters, 2010,193(1):9-18.
[19] Ku Y, Chang J L, Cheng S C. Effect of solution pH on the hydrolysis and photolysis of diazinon in aqueous solution [J]. Water, Air, and Soil Pollution, 1998,108(3/4):445-456.
[20] Jonidi-Jafari A, Gholami M, Farzadkia M, et al. Application of Ni-doped ZnO nanorods for degradation of diazinon: Kinetics and by-products [J]. Separation Science and Technology, 2017,52(15): 2395-2406.
[21] Souza A G, Cardeal Z L, Augusti R. Electrospray Ionization Mass Spectrometry (ESI-MS) monitoring of the photolysis of diazinon in aqueous solution: Degradation route and toxicity of by-products against Artemia salina [J]. Journal of Environmental Science and Health, Part B, 2013,48(3):171-176.
[22] Nakaoka Y, Katsumata H, Kaneco S, et al. Photocatalytic degradation of diazinon in aqueous solution by platinized TiO2[J]. Desalination and Water Treatment, 2010,13(1-3):427-436.
Degradation rule and mechanisms of diazinon in water by sole UV and UV/H2O2process.
LIU Yu-can1*, SU Miao-miao1, DONG Jin-kun1, ZHANG Yan1, DUAN Jin-ming2, LI Wei2
(1.School of Civil Engineering, Yantai University, Yantai 264005, China;2.School of Environmental & Municipal Engineering, Xi’an University of Architecture and Technology, Xi’an 710055, China)., 2019,39(4):1602~1610
The degradation kinetics, intermediates formation and degradation pathway of diazinon at different dosages of H2O2under ultraviolet (UV) irradiation (253.7nm) was investigated. The results showed that H2O2significantly affected on the photo-degradation rate of diazinon in UV irradiation treatment processes. The rate was lower under sole UV treatment (the pseudo-first-order rate constant () was 0.0234min-1) than UV/H2O2treatment with H2O2dose of 5 and 10mg/L (=0.0301min-1and=0.0341min-1, respectively). More than 94% of diazinon was degraded within 120 min of UV irradiation during sole UV and UV/H2O2treatment processes. In addition, dissolved organic carbon (DOC) in diazinon aqueous solution decreased with the dosage of H2O2increased from 0 to 10mg/L under the UV irradiation treatment. However, the removal efficiency of DOC was relatively low, which was less than 20% within 120 min of UV irradiation during all treatment conditions in this study. The degradation intermediates of diazinon varied significantly under different H2O2dosages. Eight major species of degradation intermediates were detected after 60 minutes of sole UV irradiation, while only six species were detected after 60 minutes of the UV/H2O2oxidation treatment. A systematic qualitative and semiquantitative analyses of the intermediates of diazinon under different H2O2dosages were conducted, the degradation pathways of diazinon during the sole UV and UV/H2O2treatment processes were discussed as well.
diazinon;ultraviolet;H2O2;degradation kinetics;intermediates;degradation pathway
X703.1,TU991.27
A
1000-6923(2019)04-1602-09
2018-09-29
山东省自然科学基金资助项目(ZR2017BEE016);国家自然科学基金资助项目(51609207);烟台大学科技项目(TM17B19)
*责任作者, 讲师, liuyucanfendou@163.com
刘玉灿(1986-),男,山东曹县人,讲师,博士,主要从事水中有机微污染物的定性、定量分析及迁移转化规律与机理方面的研究.发表论文10余篇.

