长江口潮滩沉积物古菌群落结构与多样性
李小飞,侯立军,刘 敏
长江口潮滩沉积物古菌群落结构与多样性
李小飞1,侯立军2,刘 敏3*
(1.福建师范大学,湿润亚热带生态地理过程教育部重点实验室,福建 福州 350007;2.华东师范大学,河口海岸学国家重点实验室,上海 200241;3.华东师范大学地理科学学院,地理信息科学教育部重点实验室,上海 200241)
以长江口潮滩为研究对象,采用高通量测序技术,研究了潮滩沉积物古菌群落结构与多样性及其影响因素.结果表明,沉积物中古菌群落OTUs数量为900~1417,Shannon指数为7.02~8.02,均表现出从低盐度向高盐度样点降低的变化特征.各采样点古菌群落特异性OTUs占各采样点总OTUs的24.2%~57.3%,而共有的OTUs仅占1.2%,说明各样点沉积物中古菌群落特异性较高.沉积物中古菌主要隶属于广古菌门(Euryarchaeota)和奇古菌门(Thaumarchaeota),而深古菌门(Bathyarchaeota)也是古菌群落的重要组成部分,其相对丰度占到17.7%~25.9%.主成分和聚类分析表明芦潮港和东海农场沉积物中古菌群落结构相似,白龙港和浏河口群落组成相近,而浒浦与其他采样点的古菌群落组成差别较大.通过典范对应分析,研究区沉积物中古菌群落结构与沉积物盐度水平有着非常密切的关系.上述研究结果表明长江口潮滩沉积物中古菌群落结构组成和多样性具有高度的空间差异性,且沉积物盐度是群落差异的决定性影响因素.
高通量测序;古菌群落;多样性;潮滩沉积物
河口潮滩是重要的生态系统,其生物地球化学循环过程受到人们的广泛重视[1-2].生物地球化学循环过程主要以微生物介导作用完成,微生物在物质循环与能量流动方面起着非常的重要作用[3].微生物种类丰富,数量庞大,适应性强,并且能够对环境变化做出快速而又敏感的反应,因而微生物成为了评价河口环境状况和功能变化的重要指标之一[4].近年来,大量的人为污染物进入到河口环境,对河口生态环境造成了严重威胁[5].此外,由全球变化导致的海平面上升、盐水入侵和植被入侵等环境问题也影响着河口生态服务功能和生物地球化学循环[1-2,6-7].在这些环境变化下,河口潮滩微生物群落结构和多样性也势必发生明显的变化,进而影响其生物地球化学循环过程.因此,深入研究河口潮滩微生物群落的动态变化及其影响因素具有重要的意义.
近年来,河口环境微生物多样性及其功能成为了热点研究内容[4-5,8-9].有研究发现Chesapeake河湾爆发的季节性蓝藻会对细菌群落产生重要的影响,这种影响主要通过细菌厌氧呼吸所导致[10].然而,也有研究发现,浮游植物不是影响细菌群落的因素,而是受制于营养盐水平作用影响[4].此外,滨海地区由陆向海的空间距离是沉积物中微生物群落变化的最主要因素,并且微生物和是氮污染变化的敏感微生物群落[8].此外,有研究表明长江口崇明东滩,中潮滩和低潮滩沉积物优势细菌为变形菌(),高潮滩的优势菌为拟杆菌();并且细菌多样性表现为中潮滩最高,而高低潮滩较低,由此说明潮滩环境能够显著影响微生物群落结构和多样性[11].迄今为止,有关河口潮滩及近海沉积物中微生物的研究主要集中于细菌或氮循环微生物群落及影响因素,而古菌的群落结构与多样性及其对环境变化的响应研究鲜见报道.在微生物群落中,古菌是一类有别于细菌的原核微生物[12-13],具有分布广泛、资源潜力大,在生物地球化学循环中起着重要作用[14].此外,古菌具有独特的基因类型和代谢特征,对环境变化具有适应甚至改变能力[13,15-16].因此,研究河口潮滩古菌群落结构与多样性对于了解河口生态服务功能具有重要的现实意义和科学价值.
近年来,受人类活动高强度的影响,长江口地区生态环境发生了显著变化[17],不仅影响生物地球化学循环过程,而且对微生物的群落结构与多样性产生重要的影响[5,9].此外,由于咸淡水的交互作用以及人为污染物排放,长江口环境因子具有明显的时空差异特征[5].为此,本研究以长江口潮滩为典型研究对象,采用高通量测序技术,开展沉积物古菌群落结构、多样性及其影响因素研究,不仅可深化河口潮滩微生物对环境变化的认识,同时也可为评价河口生态环境提供重要的参考依据.
1 材料与方法
1.1 研究区概况与样品采集
长江口是长江的入海口,位于我国东部滨海岸(21º5~122º30´E,30º52~31º46´N).因河流携带的泥沙和潮周期作用的影响,长江口发育着广阔的潮滩湿地[18].长江口气候类型为亚热带季风气候,夏季年平均温度为28.9℃,冬季年平均温度为5.6℃,且年平均降水量为1100mm[19].近年来,由于人类活动的影响,长江口活性氮的浓度升高了约10倍,成为了富营养化发生和加剧的主要因素之一[20].于2017年6月,在长江口的浒浦(XP)、浏河口(LHK)、白龙港(BLG)、东海农场(DHNC)和芦潮港(LCG)的5个潮滩落潮后露出的表层沉积物(0~5cm)进行采集,采样点空间分布如图1.在样品采集的过程中,现场记录采样点的经纬度和潮滩环境整体特征.在每个样点进行多点沉积物采集,相同质量的鲜重沉积物混合,并保存于已灭菌的离心管中,放置于带有冰块的保温箱中立即带回实验室.在实验室里,将沉积物样品充分混匀,并分成2份.一份沉积物保存于4℃冰箱中,立即分析其理化性质;另一份保存于–80℃超低温冰箱中用于微生物分析.
图1 长江口采样点地理位置
1.2 样品理化性质分析
沉积物pH值和盐度用1:2.5(沉积物:水)混匀后,分别采用pH计(S210,梅特勒-托利多,瑞士)和盐度计(YSI Model 30,美国)测定.沉积物粒径组成采用马尔文激光粒度仪测定(Mastersizer 2000,英国).经过烘干研磨的沉积物用1mol/L盐酸除去无机碳后,有机碳采用元素分析仪测定(MaxCNOHS,德国).沉积物中NH4+-N,NO3–-N和NO2–-N用2mol/L氯化钾溶液浸提后,采用连续流动仪测定(SAN+++, Skalar,荷兰).沉积物二价铁和三价铁用1mol/L盐酸浸提,采用邻菲罗啉比色法测定[21].在样品分析过程中,每个理化性质进行3个重复测定,结果取平均值.
1.3 沉积物DNA提取与PCR扩增及高通量测序
沉积物DNA采用强力土壤DNA试剂盒,并按照说明书的步骤进行提取(MoBio, USA).采用微量紫外分光光度计测定提取后的DNA的浓度和纯度(Thermo, USA),随后用1%的琼脂糖进行电泳.沉积物古菌群落以古菌16S rRNA的V4~V5区域作为目标DNA序列进行PCR 扩增[22].PCR 扩增采用的引物为上游524F (5'–TGYCAGCCGCCGCGGTAA–3')和下游958R (5'–YCCGGCGTTGAVTCCAATT–3'),并各自添加不同的Barcode序列进行V4~V5区域扩增.PCR扩增均采用Takara试剂公司提供的试剂进行,且反应条件为95℃预变性3min;95℃变性30s,55℃退火30s,72℃延伸45s,45个循环;最后72℃延伸10min.PCR扩增结束后,产物使用1%琼脂糖进行凝胶电泳,将其进行纯化,并将纯化后的产物送至北京诺禾致源科技有限公司Illumina-Hiseq平台上进行高通量测序(2´300bp).
1.4 数据处理与分析
将测定的扩增子采用QIIME软件进行分析.对原始序列数据进行质量控制,去除低质量以及嵌合体序列,以获得高精确和高质量的DNA序列信息.采用邻近算法,以97%的相似水平进行古菌操作分类单元(OTU)进行分类.采用MOTHUR计算每个样本古菌的Shannon指数、Simpson指数、Chao 1指数以及ACE指数.群落结构空间差异采用主成分和聚类方法分析.此外,采用典范对应分析进行沉积物理化因子与群落的相关性(Canoco, 4.5).
2 结果
2.1 沉积物理化性质
从表1中可看出,沉积物盐度在空间分布上具有明显的差异,其值为0.2‰~5.5‰,最小值为浒浦,最大值为芦潮港.沉积物pH值在空间差异变化较小,其值为7.6~8.2.白龙港沉积物TOC的含量最高(1.82%),而浏河口沉积物TOC含量最低(1.31%).从沉积物中各形态无机氮的含量来看,NH4+-N含量最高,其值为34.8~73.2µg/g; NO3–含量为11.4~18.3µg/g,其中芦潮港含量最低,浏河口含量最高.各采样点沉积物的NO2–-N含量差别较小,其值为0.05~0.08µg/g.沉积物中Fe(II)和Fe(III)含量分别是9.1~17.1mg/g和4.5~11.4mg/g.沉积物粒径组成主要以粉粒为主,占58.7%~71.3%;其次是黏粒和砂粒,分别占13.2%~ 24.3%和4.4%~28.1%.
2.2 沉积物古菌群落丰富度和多样性
经古菌16S rRNA高通量测序,并将原始序列去除低质量与嵌合体序列后,得到各潮滩沉积物古菌有效序列数量分别为58959,33918,44319,78839和36208.对这些有效序列进行分析,分别得到1417,1082,1320,1087和900个古菌OTUs(表2).样品测序文库覆盖率为97.2%~98.7%,说明文库达到饱和,所获得的OTUs能够代表样品的所有古菌总量.古菌OTUs数量和Chao 1指数从低盐度向高盐度逐渐降低,即说明低盐度沉积物具有较高的古菌丰富度,而高盐度沉积物具有较低的古菌丰富度.白龙港沉积物古菌OTUs数量最高,而浒浦沉积物中古菌Chao 1指数最高;芦潮港沉积物OTUs数量和Chao 1指数最低.
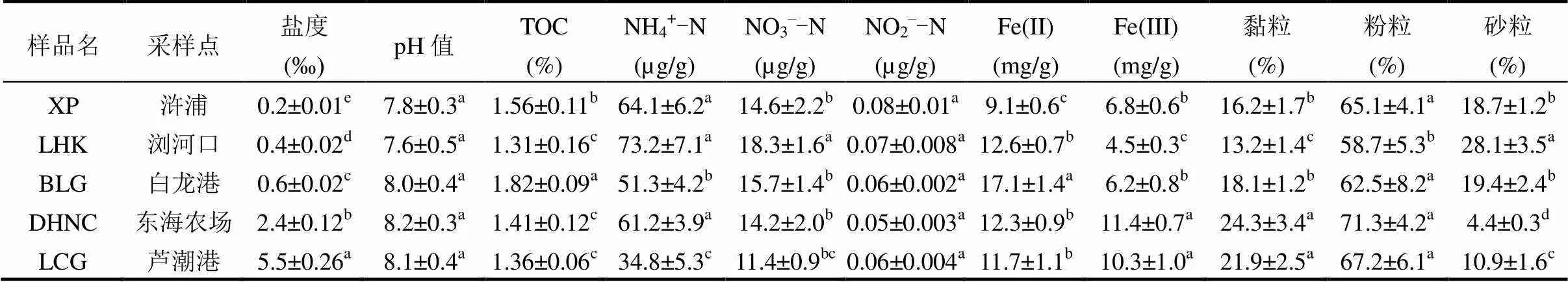
表1 潮滩沉积物理化性质
注:不同小写字母表示样点之间的显著性差异(<0.05).
此外,ACE指数也代表古菌物种数量,其值为1012~1866,表现出低盐度沉积物高,高盐度沉积物低.
Shannon指数和Simpson指数表示群落多样性.发现浒浦样点古菌的Shannon指数最高,白龙港样点古菌的Simpson指数最高.从古菌丰富度和多样性来看,两者都表现出随盐度升高而降低,特别是盐度最高的芦潮港的古菌丰富度和多样性最低,由此说明盐度对古菌群落的丰富度和多样性产生重要影响.

表2 潮滩沉积物古菌群落高通量测序文库质量汇总
注:XP为浒浦,LHK为浏河口,BLG为白龙港,DHNC为东海农场,LCG为芦潮港,下同.
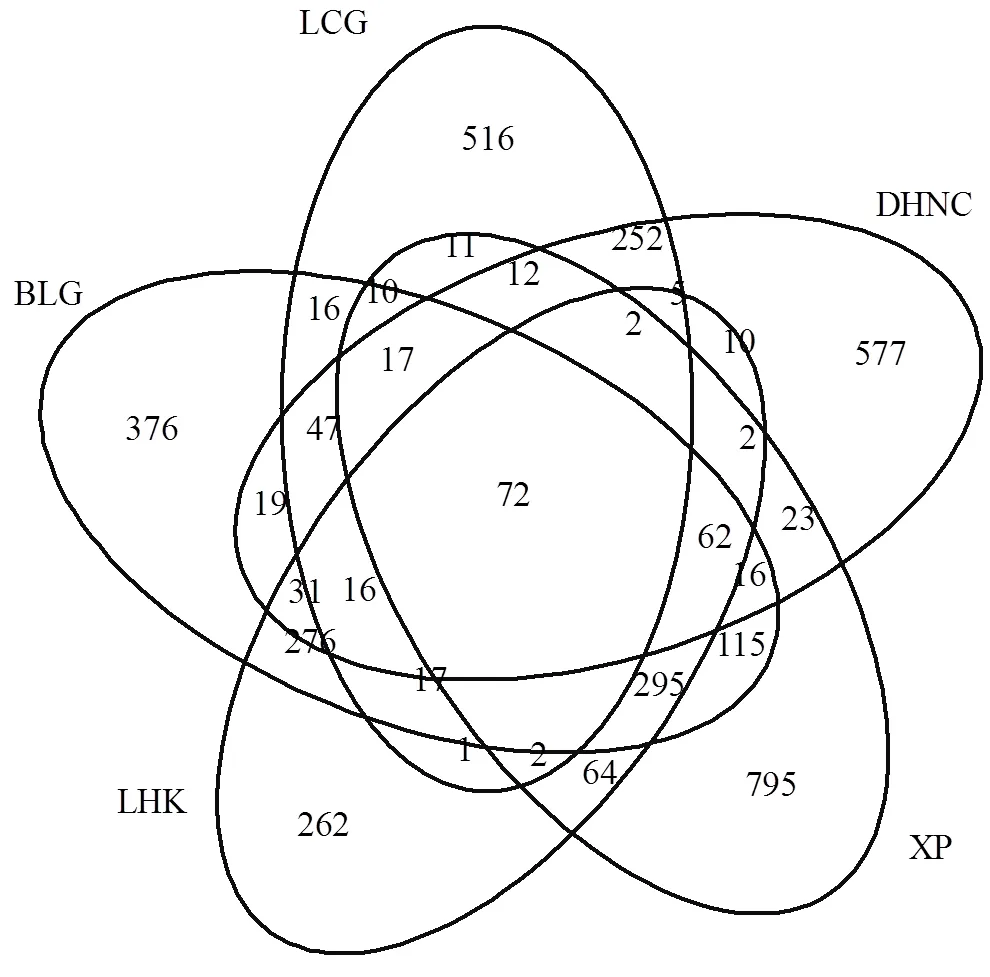
图2 采样点潮滩沉积物古菌群落高通量测序OTUs维恩图
采用维恩图分析了古菌群落OTUs在不同采样点之间的相似性和特异性特征,结果见图2.从图中可看出,5个采样点潮滩沉积物中共有的古菌OTUs数量为72,仅占到总OTUs数量的1.2%,且主要属于广古菌门(Euryarchaeota)和奇古菌门(Thaumarchaeota).研究区浒浦、浏河口、白龙港、东海农场和芦潮港样点沉积物中特有的古菌OTUs数量分别为795,262,376,577和516,其中浒浦样点沉积物古菌特有的OTUs最多,是浏河口样点沉积物古菌特异性OTUs最小的3倍.各样点沉积物特有的古菌群落OTUs占到各总OTUs的24.2%~57.3%,其中芦潮港所在比例最高,而浏河口最低.通过对古菌群落结构PCoA分析,表明古菌群落结构表现出较大的差异.主成分1和2分别贡献了48.2%和29.9%,其中白龙港和浏河口相似性距离较近,与芦潮港、东海农场和浒浦分离较远.潮滩沉积物古菌群落空间差异与沉积物盐度分布极为相似,由此说明盐度是古菌群落差异的主要因素.
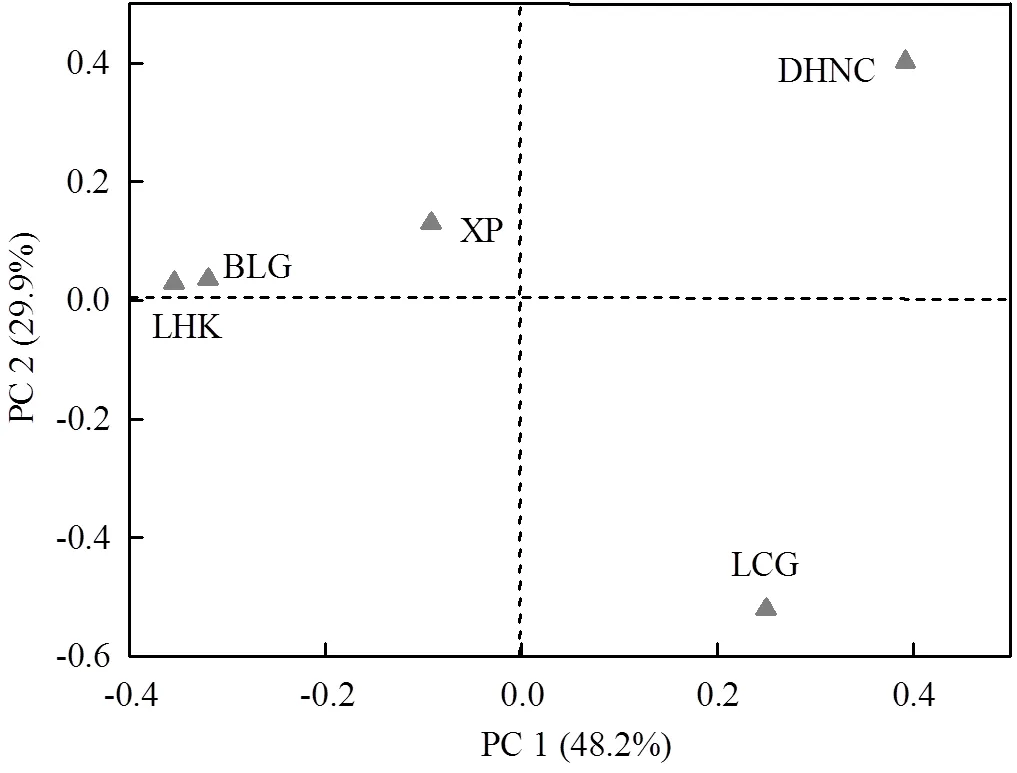
图3 采样点潮滩沉积物古菌群落结构PCoA分析
2.3 沉积物古菌群落组成特征
采样点沉积物古菌群落在门水平的相对丰度如图4所示.沉积物古菌主要隶属于广古菌门(Euryarchaeota)、奇古菌门(Thaumarchaeota)和深古菌门(Bathyarchaeota).广古菌门在样点芦潮港、白龙港和浏河口样点沉积物占绝对优势,相对丰度占47.0%、50.9%和52.9%.东海农场和浒浦样点沉积物中奇古菌门占主要优势,相对丰度为47.3%和37.8%.此外,沉积物中深古菌门也占到很大一部分,特别是浏河口、白龙港和芦潮港样点的深古菌门相对丰度达到25.23%、24.85%和25.91%.
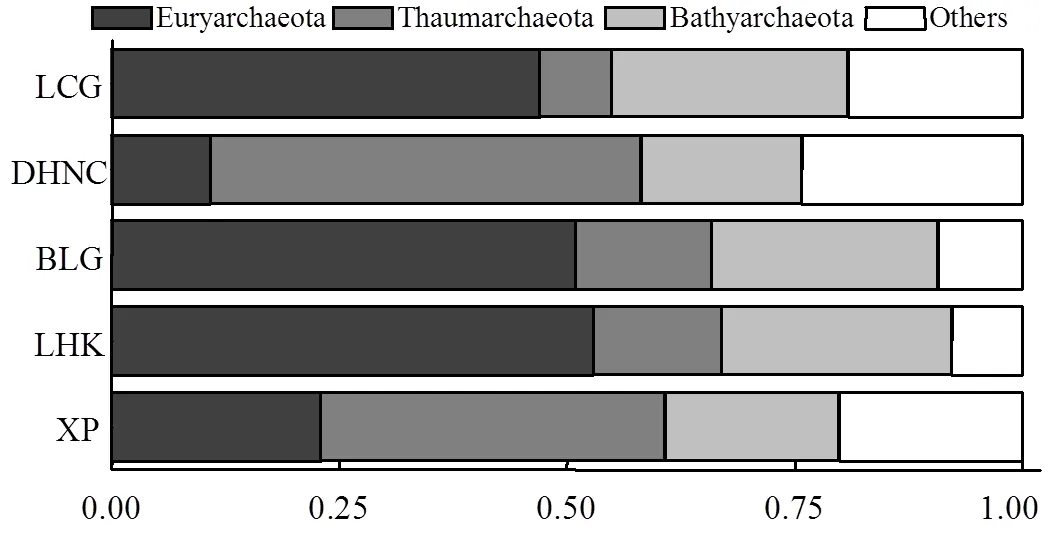
图4 采样点潮滩沉积物古菌在门分类水平的相对丰度
根据群落相对丰度以及古菌群落top10进行主要优势群落分析[13].各采样点沉积物中古菌群落结构组成和主要优势菌属(Top 10)所占比例差异较大(图5).芦潮港沉积物中占优势的古菌菌属为(甲烷八叠球菌属)、(拟甲烷球菌属)以及(氨氧化古菌),相对丰度分别占到21.3%、5.3%和2.9%.东海农场沉积物中占优势的古菌菌属分别为(氨氧化古菌属,17.1%)、(甲烷粒菌属, 4.8%)和(甲烷八叠球菌属,1.1%).白龙港沉积物中占优势的古菌菌属分别为(甲烷鬃菌属,16.1%)、(甲烷杆菌属,9.2%)、(甲烷微菌属,5.2%)、(甲烷绳菌属,4.2%).浏河口沉积物中古菌菌属主要为(甲烷鬃菌属,18.7%)、(甲烷微菌属,6.2%)、(甲烷杆菌属,5.6%)和(甲烷绳菌属,5.5%).浒浦沉积物中占优势的古菌菌属为(甲烷鬃菌属,5.7%)、(甲烷杆菌属,5.7%)、uncultured_(泉古菌属,2.9%)和_(甲烷氧化古菌属,2.1%).
采用Unifrac法将沉积物古菌菌属进行加权聚类分析,并考虑古菌菌属的数量特征和进化关系,以此计算出样品之间的聚类关系与热图(图6).从图中可看出,芦潮港和东海农场的古菌群落组成相似性较近,白龙港和浏河口古菌物种组成相近,而浒浦与其他采样点的古菌物种组成差异较大,由此说明沉积物环境影响着古菌群落的空间差异.各样点沉积物中古菌菌属存在较大的差异,均有特异性的古菌群落.白龙港沉积物主要分布的古菌菌属为和6个属群落.等8个古菌菌属主要分布于浏河口.而浒浦沉积物优势古菌菌属与其他采样点沉积物中的古菌菌属完全不同,主要是11个菌属.和ANME-3等6个古菌菌属主要分布于芦潮港.7个古菌属分布于东海农场.
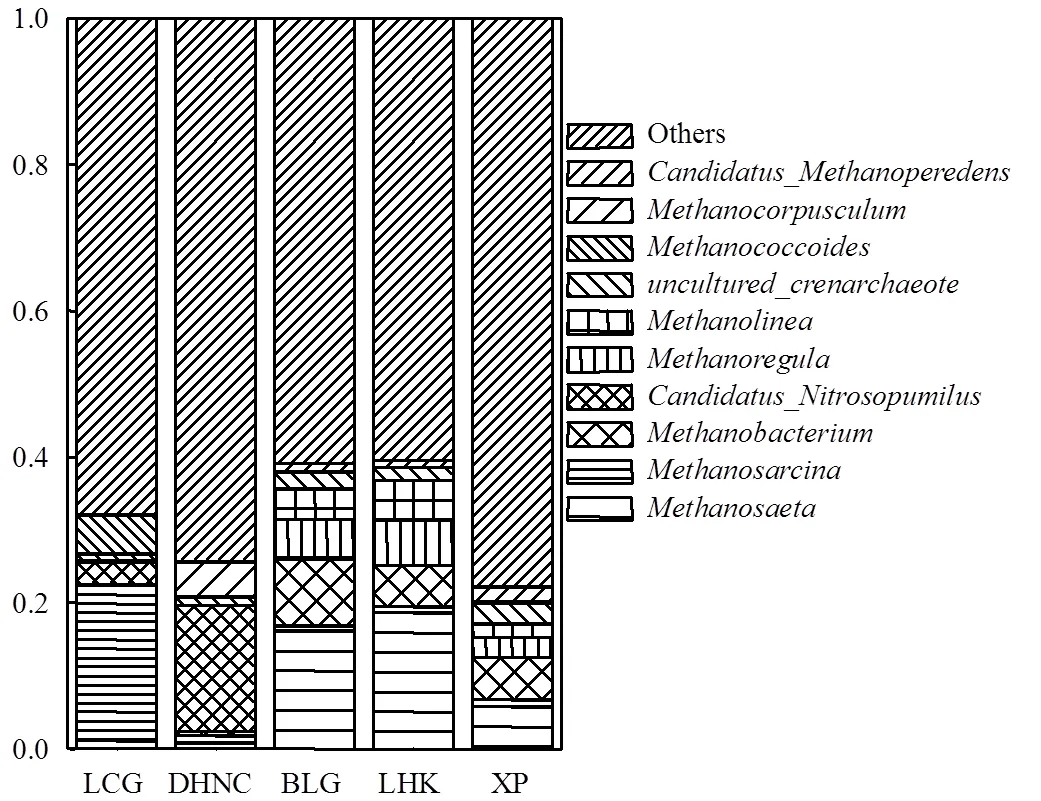
图5 采样点潮滩沉积物古菌的Top 10菌属相对丰度
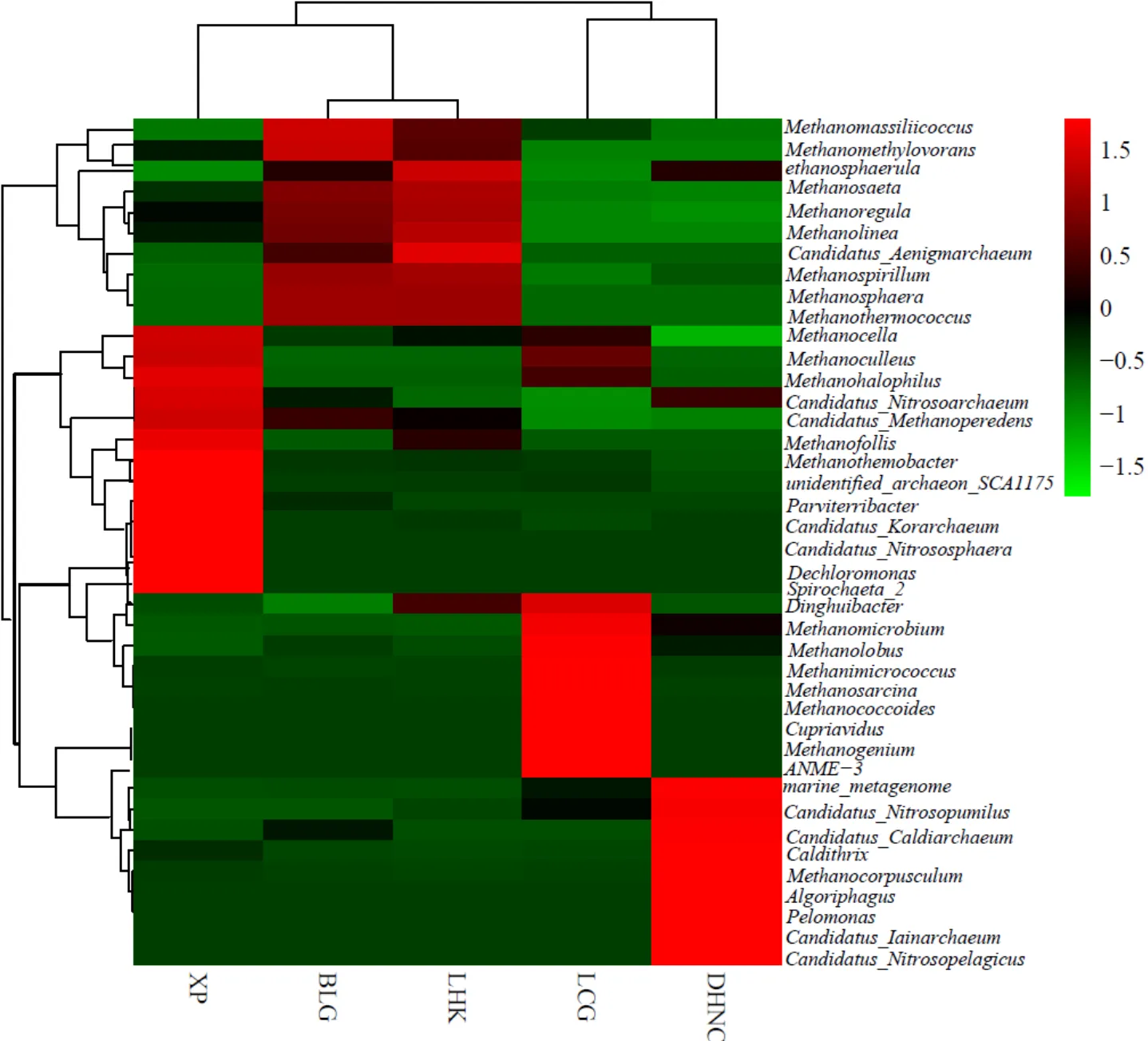
图6 采样点潮滩沉积物古菌属相水平聚类分布
2.4 古菌群落组成与理化因子关系

图7 潮滩沉积物中古菌Top10菌属群落组成与环境因子的典型相关分析
数字1、2、3、4、5、6、7、8、9、10分别代表古菌群落菌属、、、、、、、、、
通过典范对应分析(CCA)了古菌群落组成与环境因子的关系.CCA1 和CCA2 的特征值分别是54.5%和41.4%(图7),共解释了总变异的95.6%,说明这些环境因子能够很好地解释沉积物中古菌群落结构的变化.从图7可知,古菌优势菌属uncultured和与盐度具有明显的相关性,说明盐度对这几种优势菌属具有显著的影响.沉积物中Fe(II)是影响产甲烷菌属和的因素.此外,NO3–-N与NO2–-N对古菌菌属和也有一定的影响.因此,从以上分析的结果看,长江口潮滩沉积物中古菌群落的分布与盐度具有非常密切的关系,表明盐度是古菌群落差异的决定性因素.
3 讨论
自然环境中微生物群落组成与分布是多种环境因子综合作用的结果,既具有普遍性,也具有特异性[23].微生物对外部环境变化具有很强的敏感性,因此,微生物的群落组成与动态变化在很大程度上能够指示环境因子的变化.古菌是一类分布广泛的微生物群落,具有环境来源特异和功能作用突出的特征,且参与碳氮生物地球化学循环过程[24-25].不同的自然环境中,其水热组合与环境因子存在很大的差异,从而显著地影响古菌群落的组成和多样性.有研究报道我国不同地区盐碱土古细菌群落组成差异较大,主要以广古菌门(Euryarchaeota)和奇古菌门(Thaumarchaeota)为主,分别占总群落的3.0%~67.8%和2.8%~72.7%,此外还有少量的泉古菌门(Crenarchaeota)[13].然而,有研究发现黄河口不同盐生植被类型土壤古菌主要属于泉古菌门(Crenarchaeota)和广古菌门(Euryarchaeota),广古菌门为优势菌群,相对丰度占4.63%(白茅土壤)~ 97.15%(光板地);泉古菌门的相对丰度比广古菌门小得多,仅为0.05%(翅碱蓬土壤)~1.61%(白茅土壤)[26].本研究对长江口潮滩沉积物中古菌群落分析,发现各采样点沉积物中古菌群落组成结构一致,不仅包括了分布广泛的广古菌门(Euryarchaeota)和奇古菌门(Thaumarchaeota),还有深古菌门(Bathyarchaeota)这类特异性较高的古菌群落,特别是浏河口、白龙港和芦潮港沉积物中的深古菌门占到很大一部分,相对丰度分别为25.23%、24.85%和25.91%.深古菌门(Bathyarchaeota)能够降解芳香族化合物,具有生物降解的能力,在自然环境中参与污染物降解等生态活动[27].本研究中浏河口、白龙港和芦潮港均为船舶港口,柴油泄漏和燃烧等烷烃有机污染严重,从而导致沉积物中具有较丰富的深古菌门群落.此外,潮滩沉积物中还发现丰度较高的一类古菌菌门Lokiarchaeota(洛基古菌),相对丰度0.2%~ 3.2%,该群落一般生活在深海热泉,而陆地环境分布较少[14].因此,河口潮滩中的古菌群落比其他环境更具有丰富和特异的古菌群落组成,这可能是由于河口潮滩复杂的环境差异所导致的.然而,河口潮滩环境的物理、化学和生物因子时空变化剧烈,古菌群落组成、丰度和多样性很可能具有很大的空间差异性.
长江口潮滩沉积物中优势古菌菌属主要为产甲烷古菌属、氨氧化古菌属以及甲烷氧化古菌.然而,采样点沉积物中的古菌优势菌属既具有相似性又存在着一定的差别,其中盐度较高的芦潮港和东海农场存在相同的菌属有(甲烷八叠球菌属)、以及(氨氧化古菌属);盐度较低的白龙港和浏河口相同的菌属为(甲烷鬃菌属)、(甲烷杆菌属)、(甲烷微菌属)和(甲烷绳菌属);而盐度最低的浒浦为(甲烷鬃菌属)、(甲烷杆菌属)、uncultured(泉古菌属)和(甲烷氧化古菌属).有研究表明闽江口潮汐淡水沼泽湿地土壤中优势产甲烷菌为(甲烷微菌属)和(甲烷八叠球菌属)[28].此外,渤海沉积物中产甲烷菌的优势菌属为(甲烷杆菌属)和(甲烷八叠球菌属)[29].与前人研究结果相比,长江口潮滩沉积物的产甲烷菌菌属种类较多,有(甲烷八叠球菌属)、(甲烷鬃菌属)、(甲烷杆菌属)、(甲烷微菌属)和(甲烷绳菌属).有研究揭示产甲烷菌较适宜在具有一定盐性的环境中生长[30],长江口潮滩环境有着较广的盐度梯度差异,且环境因子组合多样,这也可能导致不同类型的产甲烷菌群的分布.
本研究中,潮滩沉积物古菌菌属分布较多的还有,属于氨氧化古菌,其中盐度较高的东海农场和芦潮港分布最多,相对丰度分别为17.1%和3.0%,其他采样点的相对丰度均低于0.2%,说明菌属适宜在高盐度环境生长.能够把NH4+-N氧化成NO2–-N,利用NH4+-N作为唯一能源正常生长[31].有研究表明在潮滩环境硝化速率与氨氧化古菌具有显著的相关性,而与氨氧化细菌不相关,氨氧化古菌对硝化过程的贡献比氨氧化细菌更大,说明氨氧化古菌对硝化作用起到主导作用[30].此外,在大多数陆地与水生态环境中,氨氧化古菌的丰度和表达量一般高于氨氧化细菌,表明氨氧化古菌在氮素循环中的生态功能更加重要[31].受人为活动的影响,河口环境氮污染日益严重,氨氧化古菌在河口环境的生态作用更加明显.近年来,自然环境中菌群因其参与氮和甲烷耦合过程,且能够氧化甲烷和去除硝酸盐,该群落因而引起了人们的广泛关注.本研究中,所有采样点均发现了菌群的存在,盐度最低的浒浦沉积物中相对丰度最高(2.1%),而盐度高的芦潮港和东海农场相对丰度最低(3.1~9.3),表明菌群不适宜在高盐度环境.然而,由于PCR扩增引物特异性的限制,沉积物中还可能会有一些尚未检测到的古菌群落,需要采用多种方法与手段进行分析,以此得到更加全面的群落信息.
有学者对淡水湿地研究发现,随着添加盐度的增加,土壤中产甲烷菌群落多样性降低[32].同样,本研究发现河口潮滩沉积物古菌群落丰富度和多样性随着盐度增加而降低(表2),表明盐度能够显著地影响古菌群落.然而,也有研究报道渤海沉积物盐度不是影响古菌群落结构的因素,这可能是因为该研究区的盐度梯度变化较小[29].此外,从群落进化亲缘距离来看,盐度对古菌群落进化具有非常重要的影响.本研究发现,相同的盐度环境具有较相似的进化关系(图3、6),亲缘关系较近,说明具有高度相似的古菌群落结构组成.因此,在河口潮滩环境中,盐度是影响沉积物中古菌群落结构和多样性的关键性因素.此外,也有研究表明沉积物中Fe(II)离子也是影响产甲烷菌属和的因子,这是因为高浓度的Fe(II)能够促进产甲烷菌的生长[30].同样,本研究也发现潮滩沉积物中Fe(II)对古菌群落和也有一定的影响.有研究证实,在淹水环境下,氨氧化古菌丰度比细菌要高,这是因为在低氧或缺氧环境更有利于古菌微生物的生长;同时古菌也能够在较低营养盐环境中得到生长[33].此外,植被也会通过营养盐和电子供体有效性来对微生物的群落结构和多样性产生重要的影响,因而在今后的研究中也应引起重视[37].本研究中各样点之间存在较少的共有OTUs数量(图2),进一步说明潮滩沉积物古菌群落的空间差异较大,且复杂多变的环境条件是影响沉积物古菌群落结构差异的重要因素.
4 结论
4.1 长江口潮滩沉积物中古菌物种丰富度和多样性空间变化明显,表现出从低盐度向高盐度环境降低的特征.
4.2 潮滩沉积物中古菌以广古菌门(Euryarchaeota)、奇古菌门(Thaumarchaeota)和深古菌门(Bathyarchaeota)为主;样点芦潮港、东海农场、白龙港、浏河口和浒浦沉积物中的最优势古菌菌属分别为(21.3%),(17.1%),(16.1%),(18.7%)和(5.7%).
4.3 特有古菌群落占到各采样点总古菌群落的24.2%~57.3%,且特异性程度随采样点沉积物盐度升高而增加.
4.4 盐度是潮滩沉积物中古菌丰富度、多样性和群落结构空间差异的主要决定性因子.
[1] Zhou M, Butterbach-Bahl K, Vereecken H, et al. A meta–analysis of soil salinization effects on nitrogen pools, cycles and fluxes in coastal ecosystems [J]. Global Change Biology, 2017,23(3):1338–1352.
[2] Van de Broek M, Vandendriessche C, Poppelmonde D, et al. Long-term organic carbon sequestration in tidal marsh sediments is dominated by old-aged allochthonous inputs in a macrotidal estuary [J]. Global Change Biology, 2018, https://doi.org/10.1111/gcb.14089.
[3] 刘 远,张 辉,熊明华,等.气候变化对土壤微生物多样性及其功能的影响 [J]. 中国环境科学, 2016,36(12):3793–3799. Liu Y, Zhang H, Xiong M H, et al. Effect of climate change on soil microbial diversity and function [J]. China Environmental Science, 2016,36(12):3793–3799.
[4] Kirchman D L, Cottrel M T, DiTullio G R. Shaping of bacterial community composition and diversity by phytoplankton and salinity in the Delaware Estuary, USA [J]. Aquatic Microbial Ecology, 2017, 78(2):93–106.
[5] Hou L J, Zheng Y L, Liu M, et al. Anaerobic ammonium oxidation (anammox) bacterial diversity, abundance, and activity in marsh sediments of the Yangtze Estuary [J]. Journal Geophysical Research: Biogeosciences, 2013,118:1237−1246.
[6] Kirwan M L, Megonigal J P. Tidal wetland stability in the face of human impacts and sea-level rise [J]. Nature, 2013,504:53−60.
[7] Osborne R I, Bernot M J, Findlay S E. Changes in nitrogen cycling processes along a salinity gradient in tidal wetlands of the Hudson River, New York, USA [J]. Wetlands, 2015,35(2):323–334.
[8] Xiong J B, Ye X S, Wang K, et al. Biogeography of the sediment bacterial community responds to a nitrogen pollution gradient in the East China Sea [J]. Applied and Environmental Microbiology, 2014, 80(6):1919–1925.
[9] Li X F, Hou L J, Liu M, et al. Primary effects of extracellular enzyme activity and microbial community carbon and nitrogen mineralization in estuarine and tidal wetlands [J]. Applied Microbiology and Biotechnology, 2015,99(6):2895−2909.
[10] Eggleston E M, Lee D Y, Owens M S, et aI. Key respiratory genes elucidate bacterial community respiration in a seasonally anoxic estuary [J]. Environmental Microbiology, 2015,17(7):2306–2318.
[11] 郑艳玲,侯立军,陆 敏,等.崇明东滩夏冬季表层沉积物细菌多样性研究 [J]. 中国环境科学, 2012,32(2):300–310. Zheng Y L, Hou L J, Lu M, et al. The bacterial diversity in surface sediments from Chongming Eastern tidal flat in summer and winter [J]. China Environmental Science, 2012,32(2):300–310.
[12] Woese C R, Kandler O, Wheelis M L. Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya. [J]. Proceedings of the National Academy of Sciences, 1990,87(12): 4576–4579.
[13] 俞冰倩,杨 赛,朱 琳,等.响应土壤阴离子类型的盐碱土古细菌群落多样性研究[J]. 中国环境科学, 2018,38(7):2731–2739. Yu B Q, Yang S, Zhu L, et al. Diversity characteristic of archaeal community responding to soil anion in saline-alkali soil [J]. China Environmental Science, 2018,38(7):2731–2739.
[14] Spang A, Saw J H, Jørgensen S L, et al. Complex archaea that bridge the gap between prokaryotes and eukaryotes [J]. Nature, 2015,521 (7551):173–179.
[15] Pascual J A, Garcia C, Hernandez T, et al. Soil microbial activity as a biomarker of degradation and remediation processes [J]. Soil Biology and Biochemistry, 2000,32(13):1877–1883.
[16] 刘旻霞,李 瑞,张 灿,等.兰州市南山季节性土壤微生物特征及影响因素[J]. 中国环境科学, 2018,38(7):2722–2730. Liu M X, Li R, Zhang C, et al. Seasonal characteristics and influencing factors of soil microbial in Nanshan, Lanzhou [J]. China Environmental Science, 2018,38(7):2722–2730.
[17] Yin G Y, Hou L J, Liu M, et al. DNRA in intertidal sediments of the Yangtze Estuary [J]. Journal Geophysical Research: Biogeosciences, 2017,122(8):1988–1998.
[18] Chen X, Zhong Y. Coastal erosion along the Changjiang deltaic shoreline, China: History and prospective [J]. Estuarine, Coastal and Shelf Science, 1998,46:733−742.
[19] Tang Y S, Wang L, Jia J W, et al. Response of soil microbial respiration of tidal wetlands in the Yangtze River Estuary to different artificial disturbances [J]. Ecological Engineering, 2011,37:1638– 1646.
[20] Dai Z J, Du J Z, Zhang X L, et al. Variation of riverine material loads and environmental consequences on the Changjiang (Yangtze) Estuary in recent decades (1955−2008) [J]. Environmental Science & Technology, 2010,45(1):223–227.
[21] Lovley D R, Phillips E J P. Rapid assay for microbially reducible ferric iron in aquatic sediments [J]. Applied and Environmental Microbiology, 1987,53:1536−1540.
[22] Pires A C, Cleary D F, Almeida A, et al. Denaturing gradient gel electrophoresis and barcoded pyrosequencing reveal unprecedented archaeal diversity in mangrove sediment and rhizosphere samples [J]. Applied and Environmental Microbiology, 2012,78:5520–5528.
[23] Waldrop M P, Holloway J M, Smith D B, et al. The interacting roles of climate, soils, and plant production on soil microbial communities at a continental scale [J]. Ecology, 2017,98(7):1957–1967.
[24] Leininger S, Urich T, Schloter M, et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils [J]. Nature, 2006,442(17): 806–809.
[25] 鲍林林,陈永娟,王晓燕.北运河沉积物中氨氧化微生物的群落特征 [J]. 中国环境科学, 2015,35(1):179–189. Bao L L, Chen Y J, Wang X Y, et al. Diversity and abundance of ammonia-oxidizing prokaryotes in surface sediments in Beiyun River [J]. China Environmental Science, 2015,35(1):179–189.
[26] 张 玥,孔 强,郭笃发,等.黄河三角洲土壤古菌群落结构对盐生植被演替的响应 [J]. 中国环境科学, 2016,36(7):2162–2168. Zhang Y, Kong Q, Guo D F, et al. The response of soil archaeal community structure to halophyte vegetation succession in the Yellow River Delta [J]. China Environmental Science, 2016,36(7):2162–2168.
[27] Meng J, Xu J, Qin D, et al. Genetic and functional properties of uncultivated MCG archaea assessed by metagenome and gene expression analyses [J]. ISME Journal, 2014,8:650–659.
[28] 曾志华,杨民和,佘晨兴,等.闽江河口区淡水和半咸水潮汐沼泽湿地土壤产甲烷菌多样性[J]. 生态学报, 2014,10:2674–2681. Zeng Z H, Yang M H, She C X, et al. Diversity of methanogen communities in tidal freshwater and brackish marsh soil in the Min River estuary [J]. Acta Ecological Sinica, 2014,10:2674–2681.
[29] 王炳臣,郑世玲,张洪霞,等.渤海不同区域沉积物古菌的多样性分析 [J]. 海洋科学, 2017,41(5):8–16. Wang B C, Zheng S L, Zhang H X, et al. Diversity of archaea in the sediments from different areas of the Bohai Sea [J]. Marine Sciences, 2017,41(5):8–16.
[30] Zheng Y L, Hou L J, Newell S, et al. Community dynamics and activity of ammonia-oxidizing prokaryotes in intertidal sediments of the Yangtze Estuary [J]. Applied and Environmental Microbiology, 2014,80(1):408–419.
[31] Tourna M, Freitag T E, Nicol G W, et al. Growth, activity and temperature responses of ammonia-oxidizing archae and bacteria in soil microcosms [J]. Environmental Microbiology, 2008,10(5):1357– 1364.
[32] Edmonds J W, Weston N B, Joye S B, et al. Microbial community response to seawater amendment in low-salinity tidal sediments [J]. Microbial Ecology, 2009,58(3):558–568.
[33] 钢迪嘎,齐维晓,刘会娟,等.水位变化对消落带氨氧化微生物丰度和多样性的影响[J]. 环境科学学报, 2017,37(5):1615–1622. Gang D G, Qi W X, Liu H J, et al. The impact of water level change on the abundance and diversity of ammonia oxidizing bacteria(AOB) and ammonia oxidizing archaea(AOA) in water-fluctuating zone [J]. Acta Scientiae Circumstantiae, 2017,37(5):1615–1622.
Archaeal community structure and diversity in intertidal sediments of the Yangtze River Estuary.
LI Xiao-fei1, HOU Li-jun2, LIU Min3*
(1.Key Laboratory for Humid Subtropical Eco-geographical Processes of the Ministry of Education, Fujian Normal University, Fuzhou 350007, China;2.State Key Laboratory of Estuarine and Costal Research, East China Normal University, Shanghai 200241, China;3.Key Laboratory of Geographic Information Science of the Ministry of Education, School of Geographic Sciences, East China Normal University, Shanghai 200241, China)., 2019,39(4):1744~1752
High-throughput sequencing was used to investigate the archaeal community structure and diversity, and associated influencing factors in the intertidal sediments of the Yangtze Estuary. The results indicated that the OTUs and Shannon index of archaeal community in the intertidal sediments were 900~1417 and 7.02~8.02, respectively, which both decreased from low to high salinity sampling sites. The specific OTUs of archaeal community structure accounted for 24.2%~57.3% of total OTUs in each sampling site, and identical OTUs only occupied for 1.2%, indicating that archaeal community structure varied highly along the sampling sites. The archaeal community was dominated by the Euryarchaeota and Thaumarchaeota. The Bathyarchaeota contributed a great parts of archaeal community, accounting for 17.7%~25.9% of total community. The principal component and cluster analysis suggested that the archaeal community structure in sites LCG and DHNC was similar, and archaeal community structure in BLG showed a similarity with LHK, while archaeal community structure showed a great difference in XP compared to others sampling sites. Canonical correlation analysis suggested that distribution of archaeal community structure in the intertidal sediments was tightly correlated with the sediment salinity. These results indicated that archaeal community structure and diversity were highly variable in the intertidal sediments of the Yangtze Estuary. In addition, sediment salinity was the crucial factor affecting the variabilities in archaeal community structure and diversity in the Yangtze Estuary.
high-throughput sequencing;archaeal community;diversity;intertidal sediment
X172
A
1000-6923(2019)04-1744-09
2018-09-25
国家自然科学基金资助项目(41701548,41761144062)
*责任作者, 教授, mliu@geo.ecnu.edu.cn
李小飞(1987-),男,四川达州人,博士,讲师,主要从事氮循环及其微生物作用机理方面研究.发表论文10余篇.

