模拟泳池水中氯化消毒副产物的生成规律
崔晓宇,辛会博,孙兴滨
模拟泳池水中氯化消毒副产物的生成规律
崔晓宇,辛会博,孙兴滨*
(东北林业大学林学院,黑龙江 哈尔滨 150040)
以模拟泳池水为研究对象,研究不同的氯化时间、氯投加量、pH值、反应温度条件对泳池水在氯化消毒过程中生成消毒副产物(DBPs)的影响.研究结果表明:延长氯化反应时间,二氯乙酸(DCAA)、三氯乙酸(TCAA)和三氯甲烷(TCM)的浓度不断升高,二氯乙腈(DCAN)、三氯硝基甲烷(TCNM)和1,1,1-三氯丙酮(1,1,1-TCP)的浓度则先升高再降低.DBPs浓度在氯化反应的前24h增幅较大,48h后趋于平缓;随着氯投加量的增加,DCAA、TCAA、TCM、TCNM和1,1,1-TCP浓度一直呈上升趋势,而DCAN浓度则先升高再降低.在氯投加量为2mg/L时,DBPs的浓度较低;在pH值从6升高到8的过程中,DCAA、TCAA、DCAN和1,1,1-TCP浓度先升高再降低,TCM和TCNM浓度则一直升高.pH值在6~7范围内可有效控制DBPs的形成;随着反应温度的升高,DCAA、TCAA、TCM和TCNM浓度持续升高,DCAN和1,1,1-TCP则逐渐降低.综上所述,应合理调节泳池水的氯化消毒条件,在保证舒适度的同时有效控制DBPs的生成.
模拟泳池水;氯化消毒;消毒副产物
随着游泳运动的广泛普及,游泳池水质安全越来越得到人们的重视.为了杀灭泳池水中的病毒和微生物,我国目前广泛采用氯化消毒方式对游泳池进行消毒,然而在消毒过程中生成的氯化消毒副产物(DBPS)对人体健康产生潜在的影响与威胁[1].泳池水中DBPS的主要来源包括来自配水系统的泳池水原水和补充水中的天然有机物(NOM)以及游泳者带入池水中的人体排泄物(HBE).这两种类型的混合物具有完全不同的特征,并且可能对DBPs的形成表现出不同的反应.NOM是由饮用水处理厂处理后残留在水中的多种有机物组成的一类混合物.人体排泄物(HBE)主要由尿液、汗液、粘液、皮屑、头发等组成,其中汗液和尿液中所含的尿素、肌酸酐、柠檬酸、尿酸、葡萄糖酸、各种氨基酸和氯化钠是释放到泳池水中的主要成分[2-3].据估算,平均每场游泳比赛一名游泳者会释放50mL尿液和200mL汗液的混合物[4].
1980年,Weil等[5]首次报道了泳池水消毒反应生成了三卤甲烷(THMs).此后的研究也证明了THMs是泳池水中的主要消毒副产物,同时还检测到了多种氯化物和硝酸盐[6-7].近年来,游泳池水消毒副产物(DBPs)的问题引起了西方发达国家的高度重视.通过对西班牙境内5个氯化和2个溴化公共游泳池进行调查研究,发现并辨别了100多种DBPs[8].目前,对于DBPs的研究主要集中在氯化消毒游泳池,尤其是室内游泳池.
目前已经有研究证实一些DBPs具有致癌性,且可能会引起哮喘,以及对眼睛和粘膜产生刺激,甚至还会影响生殖和发育[9-13].因此, DBPs在世界各地的饮用水中受到了监管与控制[14].游泳池中的DBPs可以通过吞咽、吸入和皮肤吸收等方式进入人体.研究表明,与摄入饮用水相比,在游泳、淋浴和洗澡期间呼吸道吸入和皮肤吸收等途径接触DBPs的风险更高[15-17].此外,对7个具有不同消毒方式和水处理设施的公共游泳池的研究表明,与供给水相比,池水的基因毒性潜能更大[18].
目前国内关于DBPs的研究大多数都是针对饮用水和废水展开,而对于泳池水,虽然泳池卫生情况一直受到人们的关注,但关于泳池水中DBPs的研究却相对较少.本文以模拟泳池水为研究对象,通过分析其在不同氯化时间、氯投加量、pH值、反应温度条件下氯化消毒副产物的生成情况,探究消毒副产物的生成规律,并分析在何种条件下能有效控制DBPs的生成,以期为今后关于泳池水DBPs的控制研究提供参考.
1 材料与方法
1.1 试验水样

表1 模拟泳池水中体液类似物(BFA)配方
模拟泳池水由体液类似物(BFA)和自来水(泳池水原水和补充水)两部分混合配制,其中BFA选用了Judd等[4]模拟人体体液类似物的配方,自来水则为市政管网供水,分别调节BFA及自来水的TOC浓度及比例,使最终混合水样的TOC浓度为5mg/L,即为试验所用模拟泳池水.试验所用消毒剂为次氯酸钠,为了减小实验误差,提高准确性,试验所用溶液均采用超纯水配制,试验过程中所需要的玻璃器皿、玻璃耗材均用去离子水、超纯水洗净后于马弗炉中450℃高温烘烤3h去除有机物后使用.本文所用的BFA各成分及含量如表1所示.
1.2 试验方法
氯化消毒试验均在密封的反应瓶中进行,用聚四氟乙烯瓶盖将反应瓶密闭,摇匀后置于生化培养箱中避光反应,反应结束后投加无水亚硫酸钠溶液终止反应,震荡摇匀后进行抽滤,随后进行消毒副产物的提取.反应基本条件为:氯化反应时间48h,氯消毒剂投加量20mg/L,pH=7,反应温度(25±2)℃.在此基础条件下,改变氯化反应时间(1,3,6,12,24,48,72h),氯消毒剂投加量(2,4,6,8,10,20,30mg/L),pH值(6.0, 6.5,7.0,7.5,8.0),反应温度(20,25,30,35,40℃).每组消毒条件下设置3个平行样,每组均设空白对照.
1.3 水样预处理过程
本试验主要测定的消毒副产物包括二氯乙酸(DCAA)、三氯乙酸(TCAA)、三氯甲烷(TCM)、二氯乙腈(DCAN)、三氯硝基甲烷(TCNM)、三氯丙酮(1,1,1-TCP),提取消毒副产物的预处理方法均参考USEPA551.1的方法[19].消毒副产物提取完成后,随即进行气相色谱分析.
1.4 分析方法
本研究采用GC-2010Plus气相色谱仪(日本SHIMADZU公司)对样品进行检测,气相色谱系统配置ECD检测器,色谱柱为Rtx-5毛细血管分离柱(30m´0.25mm´0.25mm).检测条件为:载气为高纯氮气(>99.999%),总流量为25mL/min,柱流量为1.0mL/min,采用分流进样模式,进样口温度为200℃,色谱柱内气体流速为1.0mL/min,检测器温度为300℃,进样体积为2mL.色谱柱升温程序:初始温度为35℃,保持5min,然后以5℃/min升温至60℃,保持1min,再以10℃/min升温至100℃,保持1min,最后以60℃/min升温至220℃,保持3min.
1.5 数据处理方法
将已知浓度的DCAA、TCAA、TCM、DCAN、TCNM和1,1,1-TCP标准样品分别配制成不同浓度梯度的溶液,并依次用气相色谱进样分析,确定不同消毒副产物的停留时间和峰面积,并分别绘制出每种消毒副产物的峰面积-浓度标准曲线,再将所测样品中各消毒副产物的峰面积代入相应的标准曲线计算得到消毒副产物浓度.该方法测定6种消毒副产物的检出限分别为:DCAA(0.020mg/L),TCAA (0.019mg/L),TCM(0.055mg/L),DCAN(0.001mg/L),TCNM(0.002mg/L),1,1,1-TCP0.016mg/L.
2 结果与讨论
2.1 氯化时间的影响
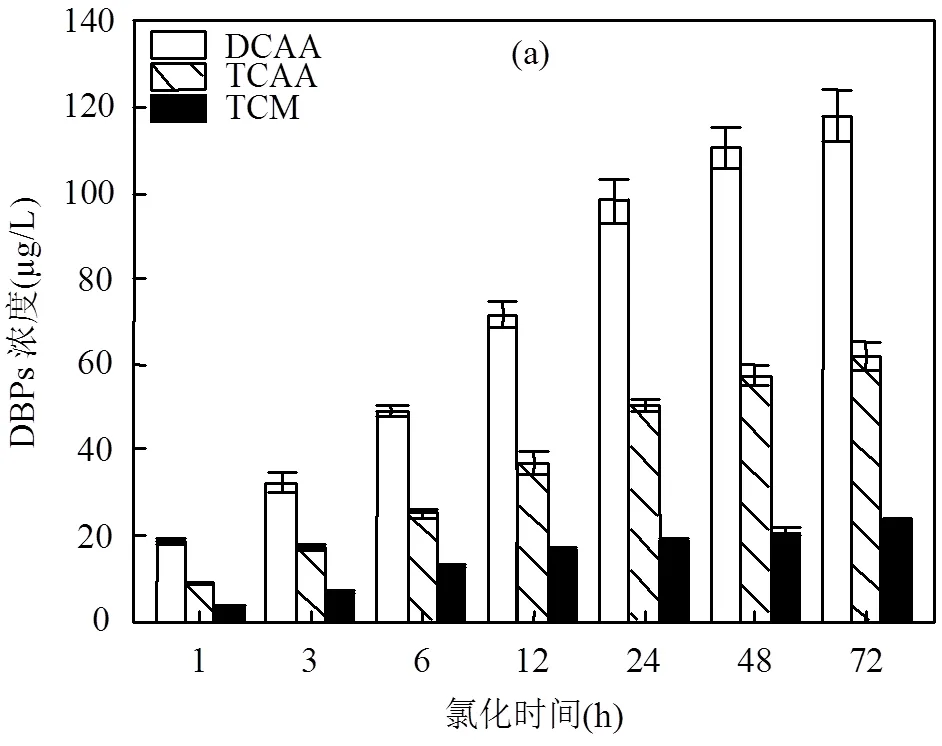
氯化时间对氯化泳池水产生DBPs的影响如图1所示,DCAA的浓度最高,其次为TCAA、DCAN和TCM,而TCNM和1,1,1-TCP的浓度相对较低. DCAA、TCAA和TCM的浓度随反应时间的增加而升高,在反应进行到72h时达到最大浓度,分别为117.82,62.16,23.37mg/L.DCAN、TCNM和1,1, 1- TCP随反应时间的延长浓度先升高后降低, DCAN和TCNM在12h时浓度达到最大值,DCAN最高浓度为31.80mg/L,TCNM浓度为0.99mg/L, 1,1,1-TCP则在反应进行到48h时达到最大浓度1.78mg/L,随后浓度开始降低.
从图1(a)中可以看出,泳池水中DCAA、TCAA的浓度明显高于TCM,这与国内外的研究结果基本一致.可能原因为:①BFA中柠檬酸和组氨酸已被确认为形成卤乙酸(HAAs)的主要前体物,这两种氨基酸具有很高的HAAs生成势[15];②DCAA和TCAA与TCM相比具有较低的挥发性,导致其在泳池中的保留时间更长,所以检测到的浓度相对较高;③游泳池在换水过程中只有很少一部分新水注入,池水经过消毒处理后循环往复使用,在泳池中停留时间较长,而在泳池的常规清洁处理过程中又很少能去除DBPs.
如图1(a)所示,TCM的浓度在反应前12h增长速率较快,12h后增长速度减缓.TCM总生成量的54.7%在反应前6h内生成.与饮用水中TCM的生成速率相比,其在泳池水中早期反应时间内的生成速率更快.Gallard等[20]和Nikolaou等[21]研究发现,在对不同水源地饮用水进行氯化消毒的过程中,仅15%~30%的THMs在氯化前5~6h内形成.而此次研究中TCM的快速生成速率表明,可能在泳池水未经任何处理之前水中已经形成了大部分TCM. DCAA、TCAA在反应前6~7h内生成速率较快,48h后增长较平缓,其中总生成量的41.7%、40.6%在反应的前6h内生成.尽管DCAA和TCAA的72h总生成量高于TCM,但前6h的生成速率却低于TCM. DCAA和TCAA较慢的生成速率表明在泳池水运转期间可能会有更多的机会去除其前体物,从而减少其生成量[15].
DBPs由稳定的DBPs和不稳定的DBPs两大类组成,一般情况下不稳定的DBPs为稳定的DBPs的中间产物,其在水中的生成量受生成速率和分解速率影响.THMs和HAAs为稳定的DBPs,它们一般为氯化反应过程中的最终产物[22],由此可以解释当水中氯消毒剂充足的情况下,DCAA、TCAA和TCM的浓度随着反应时间的延长而持续增加.相关文献显示,DCAN、TCNM和1,1,1-TCP在pH=7时会发生水解反应,且余氯的存在会加快其水解反应的进程.DCAN会水解生成二氯乙酰胺(DCAcAm), DCAcAm又进一步水解生成DCAA[23-24],1,1,1- TCP可以水解为TCAA和TCM[25].在反应前期,泳池水中N-DBPs的前体物相对充足,前体物逐渐与氯消毒剂发生反应,生成DCAN、TCNM和1,1,1-TCP,此阶段生成速率大于水解速率,其浓度不断升高;当反应继续进行,前体物被逐渐消耗,此时生成速率小于水解速率,导致其浓度开始逐渐下降.因此DCAN、TCNM和1,1,1-TCP的浓度随着反应时间的延长先升高再降低.由于不同N-DBPs的水解速率不同,所以导致其各自达到最大浓度所需的反应时间是不同的.总体而言,DBPs浓度在反应的前24h增加速度较快,48h后趋于平缓.
HAAs和THMs为饮用水以及泳池水氯化消毒过程中生成的两类主要DBPs.《游泳池水质标准》(CJ244-2007)[26]将THMs的限值定为200mg/L,本试验结果表明,泳池水氯化消毒过程中产生的TCM浓度远低于200mg/L,符合标准要求.但相对于饮用水中TCM限值要求为60mg/L而言,泳池水中该标准要求明显降低了很多,并且我国还未将泳池水中TCM列入常规项目检测,对其的重视程度还有待提高.到目前为止HAAs还未被列入到游泳池水质标准中,但从实际HAAs在泳池水中的浓度情况来看,建议应该在水质标准中增加其控制指标.卤乙腈(HANs)、卤代硝基甲烷(HNMs)和卤代酮(HKs)在泳池水中的浓度相对较低,且目前国内对这几类泳池水氯化DBPs的研究还较少,若要将其列入水质标准,未来应当针对我国的游泳池水质状况及特点进行更深入和系统的研究.
2.2 氯投加量的影响
图2为氯投加量对氯化泳池水产生DBPs的影响,从图2中可以看出除了DCAN以外,其它5种消毒副产物的浓度都随着氯投加量的增加而升高. DCAN则随着氯投加量的增加浓度先升高再降低,当氯投加量为20mg/L时,DCAN的浓度达到最大值28.70mg/L,之后随着氯投加量的继续增加浓度开始降低.
DCAN为不稳定消毒副产物,同时过量的氯会加快DCAN的水解[24].当氯投加量较低时,DCAN的前体物较为充足,氯会与前体物发生反应,氯为决定因素.随着反应继续进行,氯投加量不断增加,在一定时间内有充足的前体物可以与氯发生反应生成DCAN,此时DCAN的浓度升高.但当氯投加量继续增加,前体物成为决定因素,由于前体物在前期反应中被不断消耗,同时余氯浓度增大可能会促进DCAN水解反应的进行,使其水解速率大于生成速率,导致DCAN的浓度开始降低.由图2(a)中可以看出,DCAA的浓度以及增长速度明显高于TCAA和TCM.BFA组分为亲水性低分子量有机化合物,其被认为是形成HAAs的主要前体物,尤其是DCAA[27].Hong等[28]也曾报道过游离氨基酸组氨酸能形成较高浓度的DCAA.TCNM和1,1,1-TCP的浓度随氯投加量的增加呈现上升趋势,可能在泳池水中其前体物含量较高,有足量的有机物与氯发生反应,所以在氯化消毒过程中生成速率大于水解速率,最终浓度升高.
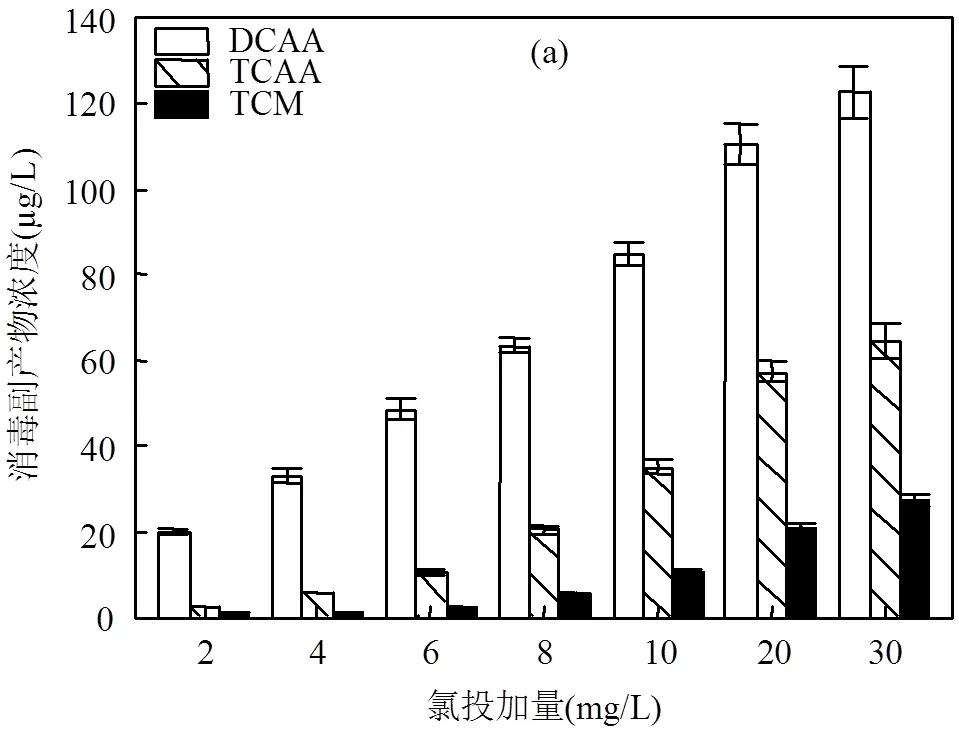
由此可见,当氯投加量为2mg/L时,泳池水中DBPs的生成量较小,且随着氯投加量的增加,泳池水中的有机物与氯不断发生反应生成DBPs.《游泳池水质标准》(CJ244-2007)中规定泳池水中游离性余氯值应保持在0.2~1.0mg/L,因此在实际运营时应在符合该标准的前提下,结合游泳池实际水质状况及特点选择最佳氯消毒剂投加量,合理控制DBPs的形成.
2.3 pH值的影响
图3为不同pH值条件下,氯化泳池水DBPs浓度的变化情况.当pH值为6~7时,随着pH值的增大,DCAA、TCAA、DCAN和1,1,1-TCP的浓度不断升高;当pH值为7~8时,随着pH值的增大,DCAA、TCAA、DCAN和1,1,1-TCP的浓度则逐渐降低,且它们的浓度均在pH值为7时达到最大值,分别为110.76,57.52,28.70,1.78mg/L.这与方晶云[29]关于饮用水消毒副产物的生成规律基本一致.同时可以观察到,TCM和TCNM的浓度随着pH值的增大而一直升高,其浓度在pH值为8时达到最大值,分别为25.58,0.99mg/L.
在投加氯消毒剂(NaClO)进行消毒的过程中,氯消毒剂与水发生反应生成HOCl,而HOCl为弱电解质会电解出OCl-.pH值的变化会影响水中有效氯的存在形态,当pH值较低时,HOCl为有效氯的主要存在形态;当pH值较高时,OCl-为有效氯的主要存在形态.在水中起主要杀毒作用的是HOCl,其消毒能力约为OCl-的80~200倍.因此,泳池水在中性或者略低于中性环境条件下会达到较好的消毒效果,同时HOCl和OCl-的浓度分布会对消毒副产物的生成量产生一定的影响.
pH值的增大有利于TCM的形成,因为TCM的结构简单且较稳定,为氯化消毒反应的最终产物,故其浓度一直呈上升趋势.先前关于饮用水消毒副产物的相关文献中已经报道过THMs的浓度随着pH值的增大而升高,而HAAs的趋势与其相反[30-31].本研究中TCM的变化趋势与其基本一致,而TCAA和DCAA的浓度则先升高再降低,但最终pH=8时的浓度仍大于pH=6时,所以总生成量还是增加的.TCAA和DCAA浓度随pH值的变化趋势也表明自来水(泳池水原水和补充水)中的NOM不是导致模拟泳池水中HAAs形成的主要因素,因为在饮用水中HAAs浓度随着pH值的增大而降低.
pH值也会影响不稳定消毒副产物的水解速率,DCAN和1,1,1-TCP在碱性条件下会发生水解反应,且HAAs是HANs的主要水解产物[23].并且随着pH值的增加这些不稳定的DBPs的水解速率也会增加,其中DCAN最容易水解,其次是1,1,1-TCP,TCAA在碱性条件下也会发生水解,但其水解速率常数相对较低[29].因此,在碱性条件下,TCAA、DCAN和1,1,1-TCP的浓度逐渐降低,而DCAA的化学性质较稳定,浓度略有降低,变化不大.同样在酸性条件下, DCAA和TCAA的浓度增加较快主要因为泳池水中前体物较为充足,生成反应占主导,其次DCAN在酸性条件也会发生水解产生少量TCAA.TCNM的浓度一直增加,pH=8时的浓度比pH=6时增加了29.2%,其他研究人员也曾报道过TCNM的生成量随着pH值的增大而增加[32],同时与DCAA、TCAA和TCM相比,TCNM的浓度非常低(低于1mg/L).

BFA中有4种组分为HANs的前体物,组氨酸已被确定为DCAN的前体物,而肌酸酐则被发现不会形成HANs[33].值得注意的是,HANs(DCAN)是本研究中检测到的毒性最大的消毒副产物[34].据报道,HANs也是氯化消毒泳池水过程中产生的毒性最大的消毒副产物[35].因此,为了限制HANs的形成,确定其形成的环境条件是十分必要的.以上研究表明,泳池水在略低于中性环境条件下可有效控制DBPs的形成,消毒效果较好.因此应在相关法规要求的范围内对游泳池水的pH值不断进行调整,以达到较好的消毒效果.
2.4 反应温度的影响
对游泳池温度的控制决定了泳池的用途,例如,低温泳池(26~28℃)通常为比赛泳池或者娱乐泳池,高温泳池(38~40℃)则为水疗泳池或温泉等.温度对泳池水消毒过程中DBPs的生成也会产生一定的影响,本研究以此为背景考察了不同温度下DBPs的浓度变化情况.由图4可知,DCAA、TCAA、TCM和TCNM的浓度随着温度的升高一直呈上升趋势,而DCAN和1,1,1-TCP的浓度则随着温度的升高而降低.
从图4中可以看出,随着温度的升高,TCM的浓度迅速升高,当温度从20℃升高到40℃时,其浓度增加了37.4%.与TCM相比,相同条件下DCAA和TCAA的浓度则分别增加了8.5%和12.4%,增长趋势稍缓.这可能因为较低的BFA浓度或者TCAA(HAAs)的加热脱羧作用[36],Kanan等[15]也发现了温度对TCM形成的影响要比DCAA和TCAA更为明显.TCNM的生成量则较低,随温度的升高其浓度变化较小,与20℃时相比浓度增加了0.12mg/L.然而DCAN和1,1,1-TCP的变化趋势则与之相反,随着温度的升高浓度逐渐降低,与20℃时相比浓度分别减少了7.24,0.36mg/L.
泳池水中生成DBPs的反应主要是氧化还原、取代和加成反应,温度升高可能有助于水中未发生反应的前体物与氯发生反应.一方面,从化学反应的角度分析,升高温度会使分子运动加快,活化能降低,使反应体系中的活化分子数目增加,分子之间的有效碰撞变多,从而加快氯与有机物的发应速度[37],即生成速率加快,所以随着温度的升高DCAA、TCAA、TCM和TCNM的生成量逐渐增加.而另一方面,DCAN和1,1,1-TCP会发生水解反应,由于水解反应过程吸热,所以温度的升高会加快不稳定DBPs的水解速率[38],导致水解速率的增加大于生成速率的增加,所以DCAN和1,1,1-TCP的生成量会减少.
由以上分析可知,对游泳池的水温进行适当的控制,平衡好游泳舒适度和DBPs生成量之间的利弊关系显得尤为重要,降低游泳池水温是一种有效减少DBPs形成的方法,特别对于高温泳池,如水疗泳池、温泉等.

3 结论
3.1 在本文研究的氯化时间范围内,DCAA、TCAA和TCM的浓度随着反应时间的延长不断升高,在反应进行到72h时达到最大浓度,而DCAN、TCNM和1,1,1-TCP的浓度则先升高再降低,DCAN和TCNM在反应12h时浓度最高,1,1,1-TCP则在48h时浓度达到最大值,总体而言,DBPs浓度在氯化反应的前24h增幅较大,48h后趋于平缓.
3.2 随着氯投加量的增加,DCAA、TCAA、TCM、TCNM和1,1,1-TCP的浓度一直呈上升趋势,而DCAN浓度则先升高再降低,其在氯投加量为20mg/L时,浓度达到最大值.当氯投加量为2mg/L时,泳池水中DBPs的浓度较低,对人体的危害最小.
3.3 pH值为6~7时,DCAA、TCAA、DCAN和1,1,1-TCP的浓度逐渐升高,7~8时,浓度则开始降低,在pH=7时,浓度分别达到最大值.而TCM和TCNM在pH值6~8范围内浓度一直升高.pH值在6~7范围内可有效控制DBPs的生成.
3.4 温度对不同消毒副产物的影响有所不同,随着反应温度的升高,DCAA、TCAA、TCM和TCNM浓度持续升高,在温度为20℃时浓度最低,DCAN和1,1,1-TCP浓度则逐渐降低,在温度为40℃时达到最低值.合理降低水温可有效控制DBPs的形成.
[1] Chowdhury S, Alhooshani K, Karanfil T. Disinfection by products in swimming pool: occurrences, implications and future needs [J]. Water Research, 2014,53(8):68-109.
[2] Anipsitakis G P, Tufano T P, Dionysiou D D. Chemical and microbial decontamination of pool water using activated potassium peroxymonosulfate [J]. Water Research, 2008,42(12):2899-2910.
[3] Barbot E, Moulin P. Swimming pool water treatment by ultrafiltration– adsorption process [J]. Journal of Membrane Science, 2008,314(1/2): 50-57.
[4] Judd S J, Bullock G. The fate of chlorine and organic materials in swimming pools [J]. Chemosphere, 2003,51(9):869-879.
[5] Weil L, Jandik J, Eichelsd E. Organic halogenated compounds in swimming pool water, Indetermination of volatile halogenated hydrocarbons [J]. Z Wass Abwass Forsch, 1980,13:165-169.
[6] Beech J A, Diaz R, Ordaz C,et al. Nitrates, chlorates and trihalomethanes in swimming pool water [J]. American Journal of Public Health, 1980,70(1):79-82.
[7] Chen M J, Lin C H, Duh J M,et al. Development of a multi-pathway probabilistic health risk assessment model for swimmers exposed to chloroform in indoor swimming pools [J]. Journal of Hazardous Materials, 2011,185(2/3):1037-1044.
[8] Richardson S D, Demarini D M, Kogevinas M, et al. What’s in the Pool? A Comprehensive identification of disinfection By-products and assessment of mutagenicity of chlorinated and brominated swimming pool water [J]. Environmental Health Perspectives, 2010,118(11): 1523-1530.
[9] Chiswell B, Wildsoet C F. The causes of eye irritation in swimming pools [J]. Water Science & Technology, 1989,21(2):241-244.
[10] Erdinger L, Kirsch F, Sonntag H G. Irritating effects of disinfection by-products in swimming pools [J]. Zentralblatt für Hygiene und Umweltmedizin, 1998,200(5/6):491-503.
[11] Thickett K M, Mccoach J S, Gerber J M,et al. Occupational asthma caused by chloramines in indoor swimming-pool air [J]. European Respiratory Journal, 2002,19(5):827-832.
[12] Richardson S D, Plewa M J, Wagner E D,et al. Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: a review and roadmap for research [J]. Mutation Research-Reviews in Mutation Research, 2007,636(1-3):178-242.
[13] Goodman M, Hays S. Asthma and swimming: a meta-analysis [J]. Journal of Asthma Research, 2008,45(8):639-647.
[14] Karanfil T. Recent advances in disinfection by-product formation, occurrence, control, health effects, and regulations [J]. ACS Symposium Series, 2008,995:2-19.
[15] Kanan A, Karanfil T. Formation of disinfection by-products in indoor swimming pool water: the contribution from filling water natural organic matter and swimmer body fluids [J]. Water Research, 2011, 45(2):926-932.
[16] Caro J, Gallego M. Assessment of exposure of workers and swimmers to trihalomethanes in an indoor swimming pool [J]. Environmental Science & Technology, 2007,41(13):4793-4798.
[17] Villanueva C M, Cantor K P, Grimalt J O,et al. Bladder cancer and exposure to water disinfection by-products through ingestion, bathing, showering, and swimming in pools [J]. American Journal of Epidemiology, 2007,165(2):148-156.
[18] Liviac D, Wagner E D, Mitch W A, et al. Genotoxicity of water concentrates from recreational pools after various disinfection methods [J]. Environmental Science & Technology, 2010,44(9):3527-3532.
[19] Munch D J, Hautman D J. Method 551.1: Determination of chlorination disinfection byproducts, chlorinated solvents, and halogenated pesticides/ herbicides in drinking water by liquid-liquid extraction and gas chromatography with electron-capture detection [M]. National Exposure Research Laboratory Office of Research and Development U.S. Environmental Protection Agency. 1995.
[20] Gallard H, Von G U. Chlorination of natural organic matter: kinetics of chlorination and of THM formation [J]. Water Research, 2002,36(1): 65-74.
[21] Nikolaou A D, Lekkas T D, Golfinopoulos S K. Kinetics of the formation and decomposition of chlorination by-products in surface waters [J]. Chemical Engineering Journal, 2004,100(1-3):139-148.
[22] Westerhoff P, Chao P, Mash H. Reactivity of natural organic matter with aqueous chlorine and bromine [J]. Water Research, 2004,38(6): 1502-1513.
[23] Glezer V, Harris B, Tal N, et al. Hydrolysis of haloacetonitriles: linear free energy relationship, kinetics and products [J]. Water Research, 1999,33(8):1938-1948.
[24] Chu W H, Gao N Y, Deng Y, et al. Precursors of dichloroacetamide, an emerging nitrogenous DBP formed during chlorination or chloramination [J]. Environmental Science & Technology, 2010,44(10): 3908-3912.
[25] Reckhow D A, Singer P C, Malcolm R L. Chlorination of humic materials: byproduct formation and chemical interpretations [J]. Environmental Science & Technology, 1990,24(11):1655-1664.
[26] CJ 244-2007 游泳池水质标准 [S]. CJ 244-2007 Water quality standards for swimming pools [S].
[27] Hua G, Reckhow D A. Characterization of disinfection byproduct precursors based on hydrophobicity and molecular size [J]. Environmental Science & Technology, 2007,41(9):3309-3315.
[28] Hong H C, Wong M H, Liang Y. Amino acids as precursors of trihalomethane and haloacetic acid formation during chlorination [J]. Archives of Environmental Contamination & Toxicology, 2009,56(4): 638-645.
[29] 方晶云.蓝藻细胞及藻类有机物在氯化消毒中副产物的形成机理与控制[D]. 哈尔滨:哈尔滨工业大学, 2010. Fang J Y. Formation and control of disinfection by-products in chlorination of blue-green algae and algal organic matter (AOM) [D]. Harbin:Harbin Institute of Technology, 2010.
[30] Hua G , Reckhow D A. DBP formation during chlorination and chloramination: Effect of reaction time, pH, dosage, and temperature [J]. Journal American Water Works Association, 2008,100(8):82-95.
[31] 李林林,刘佳蒙,宋弼尧,等.饮用水中典型微生物消毒过程中消毒副产物的生成规律[J]. 中国环境科学, 2016,36(12):3631-3638. Li L L, Liu J M, Song B Y, et al. Formation of major disinfection by-products from representative microorganisms during drinking water chlorination [J]. China Environmental Science, 2016,36(12): 3631-3638.
[32] Hu J. Exploring formation and distribution of halonitromethanes in drinking waters [D]. Clemson, SC: Clemson University, 2009.
[33] Li J, Blatchley III E R. Volatile disinfection byproduct formation resulting from chlorination of organic-nitrogen precursors in swimming pools [J]. Environmental Science & Technology, 2007, 41(19):6732-6739.
[34] Plewa M J. Comparative mammalian cell toxicity of N-DBPs and C-DBPs [J]. Acs Symposium, 2008,995:36-50.
[35] Kramer M, Hübner I, Rörden O,et al. Haloacetonitriles - another important group of disinfection byproducts in swimming pool water [C]. London, UK: Swimming Pool & Spa International Conference, 2009.
[36] Lifongo L L, Bowden D J, Brimblecombe P. Thermal degradation of haloacetic acids in water [J]. International Journal of Physical Sciences, 2010,5(6):738-747.
[37] 孙兴滨,胡 阳,袁 婷等.高锰酸钾预氧化对剑水蚤DBPsFP的去除特征研究[J]. 中国环境科学, 2015,35(11):3296-3302. Sun X B, Hu Y, Yuan T, et al. The removal characteristic of DBPsFP by potassium permanganate preoxidation during chlorination of Cyclops metabolite [J]. China Environmental Science, 2015,35(11): 3296-3302.
[38] Nikolaou A D, Golfinopoulos S K, Kostopoulou M N,et al. Decomposition of dihaloacetonitriles in water solutions and fortified drinking water samples [J]. Chemosphere, 2000,41(8):1149-1154.
Formation of disinfection by-products in chlorination of simulated swimming pool water.
CUI Xiao-yu, XIN Hui-bo, SUN Xing-bin*
(School of Forestry, Northeast Forestry University, Harbin 150040, China)., 2019,39(4):1485~1492
The objective of present study was to investigate the formation of disinfection by-products by simulated swimming pool water chlorination process under different conditions. Evaluated factors included chlorination time, chlorine dosages, pH and reaction temperature. The concentration of DCAA, TCAA and TCM increased constantly, the concentration of DCAN, TCNM and 1,1,1-TCP increased firstly and then decreased with the prolonged chlorination time. The concentration of DBPs increased significantly within 24h of chlorination reaction, and became flat after 48h. In response to increased dosage of chlorine, the concentration of DCAA, TCAA, TCM, TCNM and 1,1,1-TCP showed a tendency of increase, but the concentration of DCAN increased firstly and then decreased. The concentration of DBPs was lower when the chlorine dosage was controlled at 2mg/L; With the pH increased from 6to 8, the concentration of DCAA, TCAA, DCAN and 1,1,1-TCP initially increased and then decreased, and the concentration of TCM and TCNM increased gradually. When the pH was between 6and 7, the formation of DBPs can be effectively controlled; With the increased of reaction temperature, the concentration of DCAA, TCAA, TCM and TCNM increased continuously, while the concentration of DCAN and 1,1,1-TCP decreased gradually. Overall, the chlorination conditions of the swimming pool water should be reasonably adjusted to effectively control the generation of DBPs and ensure the comfort level of the pool.
simulated swimming pool water;chlorination;disinfection by-products
X506
A
1000-6923(2019)04-1485-08
2018-10-16
黑龙江省自然科学基金资助项目(E200812);中国博士后基金特别资助项目(200902408)
*责任作者, 教授, sunxingbin1025@163.com
崔晓宇(1993-),女,黑龙江佳木斯人,东北林业大学硕士研究生,主要从事水处理工艺理论与技术研究.

