湖北旋覆花化学成分及抗结核活性研究
胡西南,徐健龙,张诗浩,刘朝霞,刘呈雄,程 凡,邹 坤
三峡大学 生物与制药学院 天然产物研究与利用湖北省重点实验室,宜昌 443002
湖北旋覆花Inulahupehensis(Ling)为菊科(Composite)旋覆花属(Inula)多年生草本植物,又名六月菊、覆花、金佛草、金沸草[1]。主要分布在中国湖北神农架和恩施地区,以及四川东部(巫山)[2]。在我国传统中医药文化中,最早关于旋覆花的功效记载于《神农本草经》:“主结气胁下满,惊悸。除水,去五脏间寒热,补中,下气”。是土家族的一种传统中草药,性味咸、温。具有降气、消痰、行水、止呕等功效,主治咳嗽消痰、胁下胀满大腹水肿、去头目风、泄散风寒[3]。
该植物为我国特有品种,主要产于湖北恩施和神农架,地理位置特殊,植物资源集中。湖北旋覆花的化学成分为倍半萜、黄酮、甾醇、百里酚以及多糖类化合物,倍半萜类为特征成分。国内外大量研究显示旋覆花属植物倍半萜类成分在抗肿瘤、抗炎和治疗糖尿病方面均具有良好的生物活性[4-8],但关于抗结核方面的研究鲜有报道。据WHO统计,2016年全世界范围内每年约有1 040万人感染结核并引起死亡[9]。结核病是由结核分枝杆菌引起的一种慢性、消耗性传染病。最早的抗结核药物链霉素来自于放线菌,但近年来结核杆菌产生了耐药性,现有抗结核药物很难杀死耐药菌株。因此,本文对湖北旋覆花化学成分及抗结核活性进行了研究,对于开发其药用资源,从天然产物中寻找新型抗结核杆菌活性物质具有重大意义,也为以后该植物的药用开发提供了参考依据。
1 仪器与材料
1.1 菌株
标准菌株人型结核分枝杆菌M.tuberculosisH37RV、牛分枝杆菌M.bovisBCG,均购于上海公共卫生临床中心。
1.2 主要试剂与仪器
柱层层析硅胶(批号:0370245青岛海洋化工有限公司);MCI GEL(批号:3E804日本三菱化学);色谱级甲醇(批号:17065112美国TEDIA 公司);色谱级乙腈(批号:17065094美国TEDIA 公司);分析级甲醇(批号:20140319国药集团化学试剂有限公司);分析级石油醚(批号:20150930国药集团化学试剂有限公司);分析级乙酸乙酯(批号:20170422天津科密欧化学试剂有限公司);分析级丙酮(批号:2017111001成都市科隆化学品有限公司);Middlebrook 7H9培养基(批号:271310美国BD公司);吐温80(批号:20170319国药集团化学试剂有限公司);DMSO(批号:20170823国药集团化学试剂有限公司);利福平(批号:H32021677常州制药厂有限公司)。
Bruker AV 400核磁共振谱仪(瑞士布鲁克公司);SHIMADU LC-6AD高效液相色谱仪,(岛津企业管理中国有限公司);YMC-Pack ODA-A色谱柱(10 μm,250×10 mm半制备型;5 μm,250×4.6 mm分析型,日本YMC公司);FreeZone 2.5 L低温冷冻干燥机(美国Labconco公司);Sartorius cp324s电子分析天平(上海梅特勒-托利多仪器有限公司);GL-H-100C恒温恒湿培养箱(德国BINDER公司);Haier HR40-ⅡA2生物安全柜(上海恒勤仪器设备有限公司);Unic 2000可见分光光度计(上海旦鼎国际贸易);TOMY ss-325高压灭菌锅(北京久航润达科技有限公司)。
1.3 药材
2017年8月采自于湖北神农架林区,经三峡大学生物与制药学院王玉兵副教授鉴定为湖北旋覆花(InulahupehensisLing)。植物标本现保存于三峡大学天然产物研究与利用湖北省重点实验室。
2 实验方法
2.1 提取分离
取干燥旋覆花花序部分 4.51 kg,粉碎后用 95%乙醇浸提3次,每次12 h,提取液合并过滤,减压蒸馏干燥得乙醇提取物 685.71 g,提取率为 15.2%。将乙醇提取物悬浮于水中,依次用石油醚、乙酸乙酯和正丁醇萃取,得各部位萃取物:石油醚萃取物121.97 g、乙酸乙酯萃取物108.48 g、正丁醇萃取物43.74 g。
取石油醚萃取物浸膏37.64 g,经正相硅胶柱层析分离,以石油醚-丙酮溶剂系统 (100∶1~1∶1)梯度洗脱,依据薄层色谱合并得20个组分 (Fr.1~20)。Fr.5进行高效液相色谱半制备分离纯化(乙腈-水=75∶25,2.5 mL/min),得到化合物1(16.1 mg)、2(1.1 mg)。Fr.6经MCI层析柱甲醇-水 (10∶90~1∶0)分离,得5个部分 (Fr6.1~5)。 Fr6.3经甲醇重结晶得化合物3(64.9 mg)。Fr.7经正相硅胶柱层析分离,石油醚-乙酸乙酯 (10∶1~1∶1)洗脱,进行高效液相色谱半制备分离纯化(乙腈-水=51∶49,2.5 mL/min),得到化合物4(3.0 mg)、6(28.2 mg)、7(452.2 mg)、10(27.3 mg)。
取乙酸乙酯萃取物103.68 g,经正相硅胶柱层析分离,以氯仿-甲醇溶剂系统 (100∶1~1∶1)梯度洗脱,得15个组分IH.1-15。 IH.2经正相硅胶柱石油醚-乙酸乙酯溶剂体系 (30∶1~1∶1)反复分离纯化,经高效液相色谱半制备分离纯化(乙腈-水=40∶60,2.5 mL/min),得到化合物5(85.3 mg)、8(22.6 mg)、9(28.4 mg)。
化合物结构均采用质谱(MS)、核磁共振(NMR)波谱方法鉴定,并与文献对照确定化合物1~10的结构。
2.2 肉汤二倍稀释法考察体外抗结核分支杆菌增殖抑制活性
2.2.1 10%(v/v)的OADC的配置
H2O (375 mL),GS(10 g),NaCl(4.25 g),Oleic acid (0.3 mL),BSA (25 g),上述试剂搅拌1 h直至完全溶解,调体积至500 mL,用0.22 μm无菌过滤器过滤,放于4 ℃保存。
2.2.2 接种菌株的准备
试验菌株 H37Rv和 BCG 在 Middlebrook 7H9肉汤附加0.5% glycerol,0.25% 吐温80和10% OADC 37 ℃培养至对数生长期(OD6000.6~1),两种培养物与足够体积的灭菌Middlebrook 7H9 肉汤培养基混合,达到OD600为0.08,即为检测用的菌液。
2.2.3 肉汤二倍稀释法操作过程[10]
试验在 96 孔平底细胞培养板中进行。设置空白、阳性对照、阴性对照。不同单体化合物平行检测三次。加200 μL无菌蒸馏水到微板的外围孔中,于第2列孔中加200 μL Middlebrook 7H9肉汤,继续向第二列孔中注入各化合物溶液(100 μM)、阳性药物利福平、阴性对照物DMSO,剩余孔中都增补 100 μL Middlebrook 7H9肉汤,留一行做空白对照,不加任何物质只加培养基,对每列进行系列二倍稀释,100 μL菌悬液加到所有检测孔中。被检测溶液的最终浓度从 50 μM到0.78 μM。平板套上封闭的塑料袋在 37 ℃ 的培养箱中孵育7~9天,而后观察浊度。无混浊现象的最低浓度定义为MIC。
3 实验结果
3.1 化合物结构式
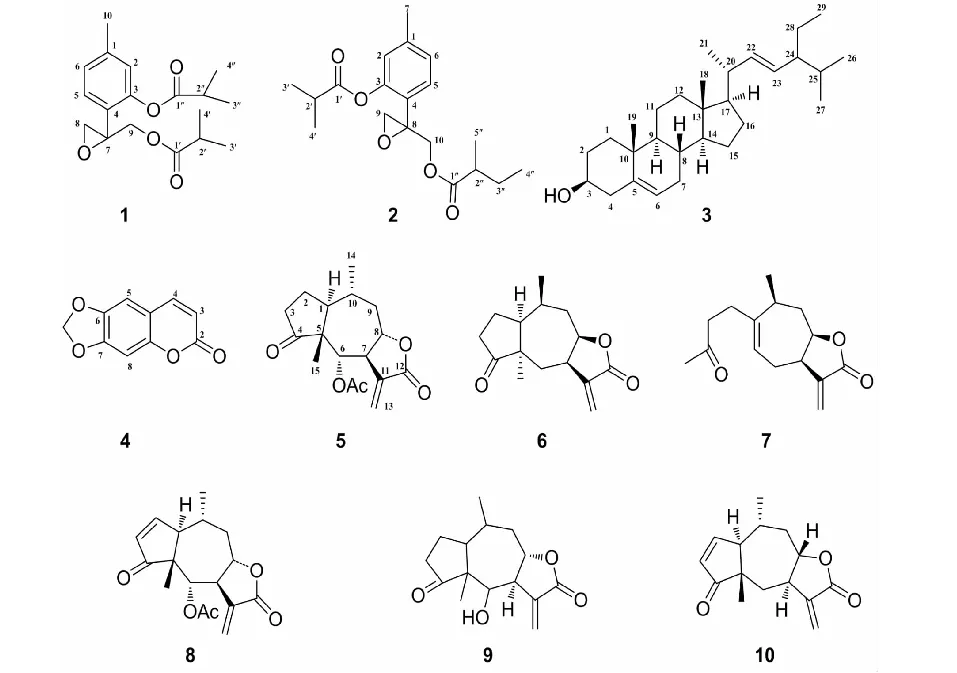
图1 化合物1~10的化学结构Fig.1 The chemical structures of compounds 1-10
3.2 化合物结构鉴定
化合物1无色油状物(CHCl3),EI-MSm/z338 [M]+,分子式为C18H26O6;1H NMR (CDCl3,400 MHz)δ:6.86 (1H,s,H-2),7.35 (1H,d,J=8.0 Hz,H-5),7.04 (1H,dd,J=8.0 Hz,H-6),3.02 (1H,d,J=4.0 Hz,H-8a),2.79 (1H,d,J=4.0 Hz,H-8b),4.57 (1H,d,J=12.0 Hz,H-9a),4.19 (1H,d,J=12.0 Hz,H-9b),2.34 (3H,s,H-10),2.51 (1H,dt,J=16.0,8.0,4.0 Hz,H-2′),1.09 (3H,d,J=8.0 Hz,H-3′),1.10 (3H,dd,J=16.0,8.0 Hz,H-4′),2.84 (1H,dt,J=16.0,8.0,4.0 Hz,H-2"),1.32 (3H,d,J=12.0 Hz,H-3"),1.32 (3H,d,J=12.0 Hz,H-4");13C NMR (CDCl3,100 MHz)δ:139.88 (C-1),122.93 (C-2),148.56 (C-3),125.96 (C-4),128.91 (C-5),126.70(C-6),56.89 (C-7),50.68 (C-8),64.83 (C-9),21.10 (C-10),176.39 (C-1′),33.82 (C-2′),18.99 (C-3′),18.99 (C-4′),175.30 (C-1"),34.17 (C-2"),18.87 (C-3"),18.83 (C-4")。以上数据与文献[11]报道一致,故鉴定化合物为 7,8-epoxy-9-(isobutyryloxy)thymolisobutyrate。
化合物2无色油状物(CHCl3),EI-MSm/z334 [M]+,分子式为C19H26O5;1H NMR (CDCl3,400 MHz)δ:6.87 (1H,s,H-2),7.35 (1H,d,J=8.0 Hz,H-5),7.04 (1H,d,J=8.0 Hz,H-6),2.34 (3H,s,H-7),2.78 (1H,d,J=4.0 Hz,H-9a),3.02 (1H,d,J=8.0 Hz,H-9b),4.06 (1H,d,J=12.0 Hz,H-10a),4.17 (1H,d,J=12.0 Hz,H-10b),2.84 (1H,m,H-2′),1.33 (3H,d,J=8.0 Hz,H-3′),1.33 (3H,d,J=8.0 Hz,H-4′),2.50 (1H,m,H-2"),1.59 (1H,m,J=8.0 Hz,H-3a"),1.41 (1H,m,H-3b"),0.80 (3H,t,J=8.0 Hz,H-4"),1.08 (3H,d,J=8.0 Hz,H-5");13C NMR (CDCl3,100 MHz)δ:139.89 (C-1),122.93 (C-2),148.56 (C-3),125.98 (C-4),128.92 (C-5),126.73 (C-6),21.11 (C-7),56.95 (C-8),50.64 (C-9),64.74 (C-10),176.01 (C-1′),34.19 (C-2′),19.01 (C-3′),18.90 (C-4′),175.33 (C-1"),40.85 (C-2"),26.59 (C-3"),16.45 (C-4"),11.37 (C-5")。以上数据与文献[12]报道一致,故鉴定化合物为 10-(2-methylbutyloxy)-8,9-epoxythymolisobutyrate。
化合物3白色无定形固体(CHCl3),EI-MSm/z390 [M]+,分子式为C29H48O;1H NMR (CDCl3,400 MHz)δ:3.51 (m,H-3a),5.34 (d,J=4.0 Hz,H-7),0.76 (s,H-18),0.83 (s,H-19),5.15 (1H,t,J=12.0,8.0 Hz,H-21),5.01 (t,J=12.0,8.0 Hz,H-22),0.70 (d,J=8.0 Hz,H-25),0.78 (d,J=8.0 Hz,H-26),1.0 (d,J=8.0 Hz,H-28),1.0 (d,J=8.0 Hz,H-29);13C NMR (CDCl3,100 MHz)δ:137.20 (C-1),31.60 (C-2),71.80 (C-3),42.20 (C-4),140.70 (C-5),121.73(C-6),31.89 (C-7),31.92 (C-8),50.81 (C-9),36.58 (C-10),21.07 (C-11),39.62 (C-12),42.23 (C-13),56.83 (C-14),24.38 (C-15),28.91 (C-16),55.92 (C-17),12.07 (C-18),19.45 (C-19),40.51 (C-20),21.22 (C-21),138.31 (C-22),129.28 (C-23),51.22 (C-24),31.89 (C-25),21.02 (C-26),18.89 (C-27),25.39 (C-28),12.29 (C-29)。以上数据与文献[13]报道一致,故鉴定化合物为 stigmasterol。
化合物4无色固体粉末(CHCl3),EI-MSm/z190 [M]+,分子式为C10H6O4;1H NMR (CDCl3,400 MHz)δ:6.12 (2H,s,H-2),6.33 (1H,d,J=12.0 Hz,H-7),7.62 (1H,d,J=8.0 Hz,H-8),6.88 (1H,s,J=8.0 Hz,H-9);13C NMR (CDCl3,100 MHz)δ:151.32 (C-3a),161.35 (C-6),113.46 (C-7),143.42 (C-8),112.72 (C-8a),105.04 (C-9),144.94 (C-9a),102.34 (OCH2O)。以上数据与文献[14]报道一致,故鉴定化合物为 ayapin。
化合物5无色片状结晶(CHCl3),EI-MSm/z306 [M]+,分子式为C17H22O5;1H NMR (CDCl3,400 MHz)δ:2.29 (1H,J=16.0,12.0,4.0 Hz,ddt,H-1),2.16 (1H,m,H-2a),1.46 (1H,m,H-2b),2.14 (1H,m,H-3a),2.39 (1H,dd,J=24.0,20.0,8.0 Hz,H-3b),5.50 (1H,d,J=8.0 Hz,H-6),3.04 (1H,m,H-7),4.49 (1H,ddd,J=12.0,10.0,4.0 Hz,H-8),1.57 (1H,d,J=12.0 Hz,H-9a),2.51 (1H,m,H-9b),1.86 (1H,m,H-10),5.85 (1H,d,J=4.0 Hz,H-13a),6.21 (1H,d,J=4.0 Hz,H-13b),1.11 (3H,d,J=8.0 Hz,H-14),1.07 (3H,s,H-15),2.02(3H,s,OAc);13C NMR (CDCl3,100 MHz)δ:46.76 (C-1),24.49 (C-2),37.92 (C-3),218.66 (C-4),56.08 (C-5),74.72 (C-6),52.70 (C-7),76.25 (C-8),44.33 (C-9),30.01(C-10),137.29 (C-11),169.39 (C-12),122.14 (C-13),19.99 (C-14),18.43 (C-15),169.14 (MeCO),21.13 (COCH3)。以上数据与文献[15]报道一致,故鉴定化合物为 ergolide。
化合物6无色片状结晶(CHCl3),EI-MSm/z248 [M]+,分子式为C15H20O3;1H NMR (CDCl3,400 MHz)δ:1.51 (2H,m,H-2b),4.31 (1H,ddd,J=12.0,8.0,4.0 Hz,H-8),1.63 (1H,m,H-9a),2.49 (3H,m,H-9b),1.96 (2H,m,H-10),6.21 (1H,d,J=4.0 Hz,H-13a),5.54 (1H,d,J=4.0 Hz,H-13b),1.12 (3H,d,J=8.0 Hz,H-14),1.06 (3H,s,H-15);13C NMR (CDCl3,100 MHz)δ:48.69 (C-1),24.14 (C-2),35.22 (C-3),222.40 (C-4),50.02 (C-5),34.54 (C-6),44.76 (C-7),80.86 (C-8),44.06 (C-9),26.61 (C-10),140.25 (C-11),169.88 (C-12),120.10 (C-13),20.00 (C-14),22.04 (C-15)。以上数据与文献[16]报道一致,故鉴定化合物为 5,10-epi-2,3-dihydroaromatin。
化合物7黄色油状物(CHCl3),EI-MSm/z248 [M]+,分子式为C15H20O3;1H NMR (CDCl3,400 MHz)δ:2.24(2H,t,J=8.0 Hz,H-2),2.57 (1H,ddd,J=24.0,16.0,8.0 Hz,H-3a),2.46 (1H,m,H-3b),5.44 (1H,m,H-5),2.18 (1H,m,H-6a),2.44 (1H,m,H-6b),3.33 (1H,m,H-7),4.65 (1H,m,H-8),2.03 (1H,m,H-9a),1.92 (1H,ddd,J=12.0,8.0 Hz,H-9b),2.36 (1H,m,H-10),5.53 (1H,d,J=4.0 Hz,H-13a),6.25 (1H,d,J=4.0 Hz,H-13b),1.13 (3H,d,J=8.0 Hz,H-14),2.16 (3H,s,H-15) ;13C NMR (CDCl3,100 MHz)δ:144.42 (C-1),30.42 (C-2),42.61 (C-3),208.28 (C-4),120.10 (C-5),26.55 (C-6),42.10 (C-7),79.32 (C-8),36.64 (C-9),35.42 (C-10),138.98 (C-11),170.29 (C-12),122.14 (C-13),20.95 (C-14),29.93 (C-15)。以上数据与文献[17]报道一致,故鉴定化合物为 xanthalongin。
化合物8无色针状结晶(CHCl3),EI-MSm/z304 [M]+,分子式为C17H20O5;1H NMR (CDCl3,400 MHz)δ:3.05(1H,m,H-1),7.75 (1H,dd,J=6.0,4.0 Hz,H-2),6.14 (1H,dd,J=8.0,4.0 Hz,H-3),5.66 (1H,d,J=8.0 Hz,H-6),3.12 (1H,m,H-7),4.65 (1H,ddd,J=12.0,8.0,4.0 Hz,H-8),2.60 (1H,m,H-9a),1.60 (1H,ddd,J=24.0,12.0 Hz,H-9b),2.10 (1H,m,H-10),5.96 (1H,d,J=4.0 Hz,H-13a),6.27 (1H,d,J=4.0 Hz,H-13b),1.33 (3H,d,J=4.0 Hz,H-14),1.25 (3H,s,H-15),2.01 (3H,s,COCH3) ;13C NMR (CDCl3,100 MHz)δ:52.22 (C-1),161.61 (C-2),130.82 (C-3),209.18 (C-4),56.29 (C-5),73.12 (C-6),53.98 (C-7),76.17 (C-8),44.41 (C-9),27.23 (C-10),137.16 (C-11),169.63 (C-12),122.18 (C-13),19.82 (C-14),22.71 (C-15),168.95 (COCH3),21.13 (COCH3)。以上数据与文献[18]报道一致,故鉴定化合物为 bigelovin。
化合物9无色片状结晶(CHCl3),EI-MSm/z264 [M]+,分子式为C15H20O4;1H NMR (CDCl3,400 MHz)δ:4.05(1H,d,J=8.0 Hz,H-6),3.05 (1H,s,C-6-OH),2.91 (1H,m,H-7),4.42 (1H,ddd,J=12.0,10.0,4.0 Hz,H-8),6.02 (1H,d,J=4.0 Hz,H-13a),6.24 (1H,d,J=4.0 Hz,H-13b),1.12 (3H,d,J=4.0 Hz,H-14),1.06 (3H,s,H-15) ;13C NMR (CDCl3,100 MHz)δ:50.06 (C-1),24.60 (C-2),44.16 (C-3),223.20 (C-4),57.75 (C-5),75.36 (C-6),45.19 (C-7),76.05 (C-8),37.70 (C-9),30.18 (C-10),138.96 (C-11),169.68 (C-12),121.86 (C-13),19.09 (C-14),20.10 (C-15)。以上数据与文献[19]报道一致,故鉴定化合物为 carpesiolin。
化合物10无色片状结晶(CHCl3),EI-MSm/z246 [M]+,分子式为C15H18O3;1H NMR (CDCl3,400 MHz)δ:2.79(1H,dt,J=16.0,8.0 Hz,H-1),7.68 (1H,dd,J=8.0,4.0 Hz,H-2),6.18 (1H,dd,J=8.0,4.0 Hz,H-3),1.69 (1H,dd,J=16.0,12.0,8.0 Hz,H-6a),2.52 (1H,d,H-6b),2.94 (1H,m,H-7),4.55 (1H,ddd,J=12.0,8.0,4.0 Hz,H-8),1.49 (1H,d,J=24.0,12.0,4.0 Hz,H-9a),2.56 (1H,m,H-9b),2.17 (1H,m,H-10),5.57 (1H,d,J=4.0 Hz,H-13a),6.24 (1H,d,J=4.0 Hz,H-13b),1.30 (3H,d,J=12.0 Hz,H-14),1.23 (3H,s,H-15);13C NMR (CDCl3,100 MHz)δ:54.23 (C-1),161.60 (C-2),130.35 (C-3),213.73 (C-4),51.19 (C-5),32.07 (C-6),46.51 (C-7),79.62 (C-8),44.21 (C-9),27.97 (C-10),140.31 (C-11),169.64 (C-12),120.19 (C-13),19.87 (C-14),27.20 (C-15)。以上数据与文献[20]报道一致,故鉴定化合物为 aromaticin。
3.3 体外抗结核分支杆菌增殖抑制实验结果
经过文献调研显示旋覆花属植物中倍半萜类化合物具有显著的生物活性,因此本文选取了分离得到的倍半萜类化合物5~10进行体外抗结核分支杆菌增殖抑制活性测试。结果表明化合物5,6,8~10对人型结核分枝杆菌M.tuberculosisH37RV、牛分枝杆菌M.bovisBCG具有较好的增值抑制活性,其中化合物9和10的增殖活性更加显著,化合物7没有抗结核分支杆菌增殖抑制活性。具体活性结果见表1 。

表1 化合物5、6、7~10对结核分支杆菌的增殖抑制影响(n=3)
注:利福平为阳性对照药。
Note:RIF of positive control.
4 结果
目前对湖北旋覆花化学成分及抗结核药理作用研究较少,本课题组对湖北旋覆花的花序进行了深入研究。从中共分离鉴定了10个化合物。其中包括6个倍半萜类,2个百里酚类,1个甾醇和1个酚类,化合物1、2、5、6、8~10均为首次从该植物中分离得到。通过肉汤二倍稀释法评价了体外抗结核分支杆菌增殖抑制活性,与化合物7比较,化合物5、6、8~10对人型结核分枝杆菌M.tuberculosisH37RV、牛分枝杆菌M.bovisBCG都具有良好的增值抑制活性,猜测活性部位主要为闭环A以及5位甲基,其中化合物9和10的增殖活性更加显著,可能与7、8位取代基有关。
由于主要近年来结核分支杆菌对现有抗结核药物产生了广泛耐药性,耐药菌株很难被药物杀死。本文对湖北旋覆花化学成分及抗结核活性的研究,从结果来看,倍半萜类化合物具有良好的抗结核生物活性,也为从天然化合物中筛选有效抗结核活性物质提供了途径。这对于开发其药用资源,从天然产物中寻找新型抗结核杆菌活性物质具有重大意义,也为计算机辅助研究分子构效关系以及寻找活性位点提供了参考依据。
致谢:感谢上海市公共卫生临床中心范小勇研究员在抗结核活性试验中给予的指导和帮助,在此致以真诚的谢意!
——结构和生物活性

