雪灵芝多糖的分离纯化及免疫活性评价
连紫宛,李占强,张海燕,刘瑞欣 ,陈辛玲 ,王 刚*
1青海大学医学院;2青海大学医学院高原医学研究中心;3青海省高原医学应用基础重点实验室 青海-犹他高原医学联合重点实验室;4青海省第五人民医院,西宁 810000
雪灵芝(Arenariakansuensis)为生长在海拔3 500~5 300米砾石带的石竹科无心菜属垫状草本植物,其藏药名为阿仲嘎布,《藏药志》中称其“以全草入药,其性味苦寒,有清热、利肺、止咳、散肿等功效”,藏族民间用其水煮液进行药浴治疗关节炎[1,2]。近年来,随着高原植物药学研究的日益深入,有关雪灵芝的药用价值也逐渐被国内研究者重视。在药化研究方面,雪灵芝含有多糖、三萜皂苷、黄酮、生物碱等活性物质;在药效研究方面,雪灵芝提取物具有抗炎、免疫调节及抗肿瘤等相关研究也见诸于报道[3]。本课题组前期开展的体内外研究,分别从水溶性提取物、粗多糖层次,证实了雪灵芝具有激活淋巴细胞、巨噬细胞及促进Th1型细胞因子水平的生物活性[4-8],而对雪灵芝多糖进行纯化并追踪其免疫激活活性的研究尚未见报道。本研究采用柱色谱分离法、GPC-RI-MALS法和HPLC法对雪灵芝多糖进行分离纯化、测定纯化组分的分子量和单糖组成,并观察不同分离纯化阶段的雪灵芝多糖对体外培养的脾淋巴细胞增殖、腹腔巨噬细胞功能的影响。
1 材料与方法
1.1 实验动物
清洁级昆明小鼠,共12只,雌雄各半,4~6周龄,体重20±2 g,购自青海省地方病研究所实验动物中心,生产许可证号SYXK青2012-001。
1.2 主要试剂与仪器
甘肃雪灵芝全草购自青海九康医药保健品有限公司,由中国科学院西北高原生物研究所刘增根副研究员鉴定为甘肃雪灵芝(ArenariakansuensisMaxim)。DEAE Cellulose 52柱(北京Solarbio科技有限公司),Sephadex G-75柱(北京华迈科生物技术有限责任公司),半乳糖醛酸、甘露糖、核糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、岩藻糖(上海源叶生物科技有限公司),木糖、阿拉伯糖(长春市安谱生物科技有限公司),1-苯基-3-甲基-5-吡唑啉酮(PMP)购自山东西亚化学股份有限公司,NO试剂盒(南京建成生物工程研究所),小鼠 IFN-γ ELISA试剂盒(深圳市达科为生物技术有限公司)。
高效液相色谱仪(美国 Agilent 公司),自动部分收集器(上海嘉鹏科技有限公司),冷冻干燥机(德国Christ 公司),旋转蒸发器(上海亚荣生化仪器厂),18角度激光光散射凝胶渗透色谱仪(美国怀雅特公司),细胞培养箱(美国 Forma 公司), 96孔板离心机(德国Eppendorf公司),酶标仪(日本Bio-rad公司)。
1.2 雪灵芝多糖的提取及分离纯化
1.2.1 雪灵芝粗多糖的提取
参照文献[4],采用水提醇沉法提取雪灵芝粗多糖。
1.2.2 雪灵芝多糖分离纯化
1.2.2.1 DEAE Cellulose 52 离子交换柱层析
配制10 mg/mL的雪灵芝粗多糖水溶液,充分溶解后4 000 rpm离心10 min,取上清沿柱壁缓慢加入2.5 cm×45 cm 的DEAE -52纤维素层析柱,按流速2 mL/min,以蒸馏水、0.1、0.15、0.2、0.3 mol/L的NaCl溶液进行梯度洗脱。苯酚-硫酸法于490 nm检测波长下隔管检测多糖吸光度,直到无多糖组分流出。以管数为横坐标,吸光度为纵坐标绘制洗脱曲线。收集浓缩同一峰洗脱液,浓缩,脱盐,冻干,获得AKP-1~5共五个多糖组分。
1.2.2.2 Sephadex G-75凝胶柱层析
取AKP-2多糖样品0.2 g溶于60 mL去离子水中,充分溶解后,4 000 rpm离心10 min,取上清加至42 cm×100 cm 的Sephadex G-75凝胶柱,设置流速为0.5 mL/min,以蒸馏水进行洗脱,以5 mL/管自动部分收集器收集洗脱液,期间进行苯酚硫酸法检测,直至无多糖流出。以管数为横坐标,吸光度为纵坐标绘制洗脱曲线。收集浓缩同一峰洗脱液、冷冻干燥,得到AKP-2a多糖组分。
1.3 苯酚-硫酸法检测雪灵芝多糖的总糖含量
1.3.1 葡萄糖标准曲线的绘制
以葡萄糖为标准品,配制为1 mg/mL浓度,分别吸取标准品液0.4、0.6、0.8、1.2、1.8 mL,以蒸馏水补至2.0 mL,设2.0 mL蒸馏水为空白对照。各管加入6%苯酚1.0 mL及浓硫酸5.0 mL,摇匀冷却后40 ℃水浴15 min,室温下静置30 min,于490 nm处测吸光度值,以吸光度值为纵坐标,葡萄糖浓度为横坐标,绘制标准曲线。
1.3.2 雪灵芝多糖总糖含量测定
配制0.5 mg/mL浓度的不同纯化阶段的多糖样品溶液2 mL,按上步骤操作,在490 nm波长处测吸光度值,按葡萄糖标准曲线计算各样品总糖含量。
1.4 雪灵芝多糖AKP-2a分子量测定
采用凝胶渗透色谱-十八角激光光散射(GPC-MALS)法测定AKP-2a多糖的分子量。液相色谱条件:色谱柱为ShodexOHpak SB-806HQ/804HQ;流动相:超纯水(0.02%叠氮钠),PH=6 ;流速:1.0 mL/min;柱温为 25 ℃;进样量为 100 μL。样品溶液的处理:称取2 mg AKP-2a多糖样品,加流动相1 mL,0.22 μm微孔滤膜过滤后,进行检测。
1.5 AKP-2a单糖组分测定
1.5.1 单糖标准混合液和AKP-2a水解样品的制备
称取10种单糖标准品各10 mg分别定容至1 mL,将其等体积混合配成浓度为1 mg/mL 的单糖标准品液;称取10 mg AKP-2a样品,加入4 mol/L TFA(三氟乙酸)0.5 mL,在120 ℃条件下水解2 h,氮气吹干,500 μL去离子水溶解样品,0.22 μm微孔滤膜过滤后备用。
1.5.2 单糖标准品和AKP-2a水解样品衍生化
取雪灵芝多糖AKP-2a水解液和单糖标准品混合液各200 μL,分别加入0.3 mol/L NaOH溶液500 μL和0.5 mol/L PMP甲醇溶液500 μL,混匀后70 ℃水浴60 min,冷却至室温,加0.3 mol/L HCl溶液500 μL,摇匀后加500 μL氯仿,振荡摇匀后静置20 min,弃氯仿层,重复3次,水层过0.45 μm微孔滤膜备用。
1.5.3 单糖标准曲线的绘制
配制浓度梯度分别为13.33、10.00、6.67、5.00、2.67 μg/mL的单糖混合标准溶液,进行HPLC检测,色谱条件:色谱柱SHISEIDO C18柱(250×4.6 mm,5 μm);流动相:0.1 mol/L 磷酸盐缓冲溶液(pH6.9)-乙腈(v/v=82∶18);流速:1 mL/min;检测波长:245 nm;进样量:10 μL;柱温:25 ℃。按照单糖浓度与峰面积建立回归方程。
1.5.4 单糖标准品和AKP-2a样品HPLC 检测
将衍生化处理的单糖标准品和AKP-2a样品,按1.5.3的方法进行HPLC 检测。
1.6 雪灵芝多糖对小鼠脾淋巴细胞增殖的影响
1.6.1 小鼠脾淋巴细胞悬液制备
实验小鼠7只,参照文献[4]制备小鼠脾淋巴细胞悬液。
1.6.2 MTT法检测小鼠脾淋巴细胞增殖
小鼠脾淋巴细胞悬液(2×106/mL)按100 μL/孔接种于96孔细胞培养板。设置空白对照组、香菇多糖(终浓度为5 μg/mL)阳性对照组、以及不同纯化阶段的雪灵芝多糖的低、中、高(终浓度为分别为50、100、200 μg/mL)处理组,每个样本设3复孔对照孔及3复孔刺激孔,除空白孔加入100 μL培养液,其余各孔分别加入100 μL培养液溶解的药物。置于37 ℃ 5% CO2培养箱44 h后,各孔加入MTT(5 mg/mL)溶液20 μL继续培养4 h后,将96孔板置于平板离心机,2 000 rpm离心5 min,将上清180 μL吸弃,每孔加150 μL DMSO,振荡溶解10 min,酶标仪测定490 nm波长处的吸光度。结果以刺激指数(SI)表示:SI=刺激孔OD值/对照孔OD值。
1.7 雪灵芝多糖AKP-2a对小鼠腹腔巨噬细胞功能的影响
1.7.1 小鼠腹腔巨噬细胞悬液制备及分组
实验小鼠5只,参照文献[4]制备小鼠腹腔巨噬细胞悬液。小鼠腹腔巨噬细胞悬液(1×105/mL)按 180 μL/孔接种于96 孔培养板,置于37 ℃,5% CO2培养箱培养3 h 后吸弃上层培养液,去除未贴壁细胞。设空白对照组,脂多糖(终浓度为5 μg/mL)阳性对照组, AKP-2a 低、中、高(终浓度为分别为25、50、100 μg/mL)处理组,每样本设3个复孔,除空白孔加入20 μL培养液,其余各孔分别加入20 μL培养液溶解的药物,置于37 ℃,5% CO2培养箱,培养48 h。
1.7.2 小鼠腹腔巨噬细胞NO释放水平检测
吸取培养上清,按NO一步法试剂盒说明书操作,检测NO释放水平。
1.7.3 小鼠腹腔巨噬细胞IFN-γ水平检测
吸取培养上清,按双抗体夹心法ELISA试剂盒说明书操作,检测IFN-γ水平。
1.8 统计学分析
采用SPSS19.0统计学软件进行分析,数据以均数±标准差表示,组间比较采用单因素方差分析,以LSD法进行显著性检验。
2 结果
2.1 雪灵芝多糖提取与分离纯化
2.1.1 雪灵芝粗多糖提取
雪灵芝干粉8 kg经水提醇沉法,Sevage法脱蛋白后,共获得61.8 g雪灵芝粗多糖,经计算得率为0.77%。
2.1.2 雪灵芝多糖DEAE Cellulose 52离子交换柱层析
雪灵芝粗多糖经DEAE-52纤维素柱层析,获得中性多糖AKP-1和酸性多糖AKP-2、AKP-3、AKP-4、AKP-5(见图1)。
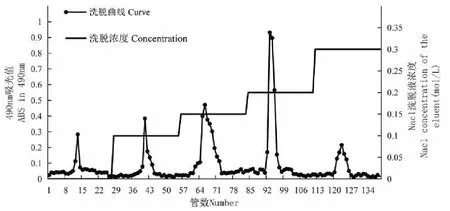
图1 DEAE-52纤维素NaCl溶液梯度洗脱曲线Fig.1 NaCl gradient elution curve with DEAE-52 cellulose column
2.1.3 Sephadex G-75凝胶柱层析
将AKP-2进行Sephadex G-75凝胶柱层析,得到单一峰的AKP-2a多糖组分(见图2)。
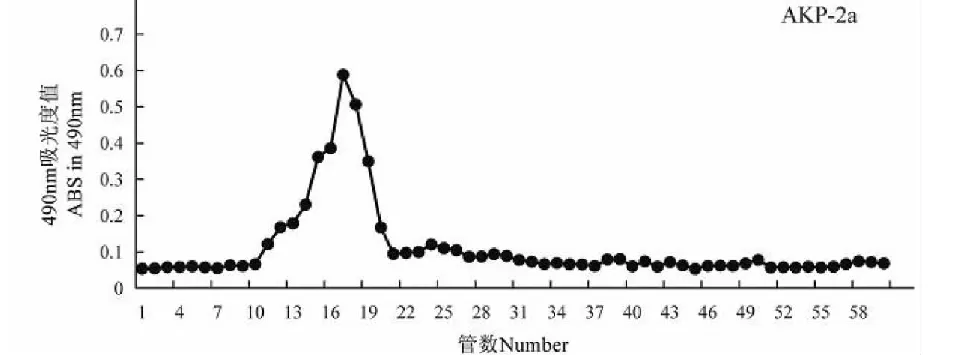
图2 AKP-2a Sephadex G-75 洗脱曲线Fig.2 Elution curve of AKP-2a on Sephadex G-75 column

图3 AKP-2a的GPC-MALS分析Fig.3 GPC-MALS analysis of AKP-2a
2.2 不同纯化阶段雪灵芝多糖的总糖含量测定
以苯酚-硫酸法,测得雪灵芝粗多糖AKCP的总糖含量为52%,雪灵芝多糖AKP-2的总糖含量为70%,雪灵芝多糖AKP-2a的总糖含量为79%。
2.3 雪灵芝多糖AKP-2a分子量测定
AKP-2a经GPC-MALS检测,AKP-2a重均分子量Mw为2.07×105Da,数均分子量Mn为9.838× 104Da,分散系数(Mw/Mn)为2.104(见图3)。
2.4 雪灵芝多糖AKP-2a单糖组成分析
对浓度梯度单糖混合标准品溶液进行HPLC检测,按各单糖对应的峰面积建立回归方程,结果在2.67~13.33 μg/mL浓度范围内线性良好(见表1);混合单糖标准品与AKP-2a的HPLC色谱分析见图4;AKP-2a单糖组成为半乳糖醛酸、甘露糖、核糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖及岩藻糖(见表2)。其摩尔比为:1∶0.25∶0.01∶0.20∶0.11∶0.25∶0.61∶0.07∶0.21∶0.12。

图4 10种混合单糖对照品(a),AKP-2a(b)的HPLC色谱图Fig.4 HPLC chromatograms of 10 mixed standard monosaccharides (a) and AKP-2a (b)注:1.甘露糖2.核糖3.鼠李糖4.葡萄糖醛酸5.半乳糖醛酸6.葡萄糖7.半乳糖8.木糖9.阿拉伯糖10.岩藻糖。Note:1.Mannose 2.Ribose 3.Rhamnose 4.Glucturonic acid 5.Galacturonic acid 6.Glucose 7.Galactose 8.Xylose 9.Arabinose 10.Fucose.
2.5 AKCP 、AKP-2、AKP-2a对小鼠脾淋巴细胞体外增殖的影响
MTT法检测小鼠脾淋巴细胞体外增殖,结果显示,香菇多糖组、AKCP、AKP-2、AKP-2a各浓度组SI均高于空白对照组(P<0.05),其中以AKP-2a高剂量组刺激作用最为明显,高于香菇多糖组及其它各药物浓度组(P<0.05),(见图5)。
2.6 AKP-2a对小鼠腹腔巨噬细胞功能的影响
经NO释放实验及ELISA检测,脂多糖组、AKP-2a各浓度组小鼠腹腔巨噬细胞培养上清中NO水平、IFN-γ水平,均显著高于空白对照组(P<0.01),(见表3)。

表1 单糖标准曲线

表2 AKP-2a单糖含量测定

表3 AKP-2a对小鼠腹腔巨噬细胞功能的影响
注:与空白对照组比较,*P<0.01。
Note:Compared with control group,*P<0.01.
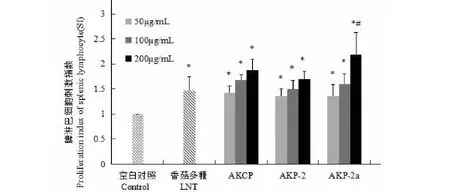
图5 AKCP、AKP-2、AKP-2a 对体外培养小鼠脾淋巴细胞增殖水平的影响Fig.5 Effects of AKCP、AKP-2、AKP-2a on the level of lymphocyte proliferation in vitro 注:与空白对照组比较,*P<0.05;与香菇多糖组、AKCP和AKP-2高、中、低浓度组、AKP-2a中、低浓度组比较,#P<0.05。Note:Compared with control group,*P<0.05;Compared with LNT,AKCP-H,AKCP-M,AKCP-L,AKP-2-H,AKP-2-M,AKP-2-L,AKP-2a-M,AKP-2a-L,#P<0.05.
3 结论
目前,植物来源多糖分离纯化及免疫活性研究日益广泛[9-11],而有关雪灵芝多糖的分离、纯化及活性研究方面报道较少。国内彭光华等[12]对西藏来源的雪灵芝提取粗多糖,采用DEAE-52离子交换柱进行色谱分离获得5个多糖组分,其中蒸馏水洗脱的的第1峰和0.13 M·L-1NaCl洗脱的第4峰组分,经2次葡聚糖凝胶G-75柱分离,获得单一对称峰的MAP1和MAP4组分;通过气相色谱法分析这2个组分中的6种单糖组成,结果显示以甘露糖、葡萄糖、半乳糖含量较高。
本研究选择青海分布最广、资源量最大的甘肃雪灵芝为原料,水提醇沉法提取雪灵芝粗多糖,经去除蛋白、色素后,采用DEAE-52纤维素柱色谱分离到1个中性和4个酸性多糖组分(AKP-1~AKP-5)然而这5个多糖组分在洗脱的盐浓度梯度、各峰高度及峰面积方面,与彭光华等人的色谱图有所差异。另外,本研究选择0.1 mol/L NaCl洗脱的第2峰多糖组分(AKP-2)经过1次葡聚糖凝胶G-75柱色谱分离,获得单一峰AKP-2a组分。经高效液相色谱法分析10种单糖组成,显示AKP-2a以半乳糖糖醛酸含量最高,其次分别为半乳糖、葡萄糖及甘露糖。以上差异,提示不同地区分布的野生雪灵芝种类、种群间多糖的组成可能存在差异,而且不同盐浓度梯度洗脱组分的单糖组成有所不同。本研究通过DEAE-52纤维素柱层析、葡聚糖凝胶G-15柱脱盐及葡聚糖凝胶G-75柱层析,使雪灵芝多糖的总糖含量从粗多糖AKCP的52%,逐步提高到AKP-2的70%以及AKP-2a的79%,表明上述方法可有效分离纯化雪灵芝多糖。
脾淋巴细胞增殖是适应性免疫激活的重要环节[13,14]。本研究结果显示,在50~200 μg/mL浓度范围,AKCP 、AKP-2、AKP-2a均显示出浓度依赖性的促进体外培养小鼠脾淋巴细胞增殖的活性,其中以AKP-2a高浓度组最为明显。巨噬细胞是固有性免疫的重要组成,IFN-γ表达及NO释放水平,是其活化的主要标志。本研究结果,在25~100 μg/mL浓度范围,AKP-2a对于体外培养的小鼠腹腔巨噬细胞中二者的表达,显示出显著的浓度依赖性刺激作用,与我们之前的研究结果[3]相比,显示出对巨噬细胞更强的激活作用。即AKP-2a 在100 μg/mL 浓度下达到的激活效应,与粗多糖在200 μg/mL浓度下达到的激活效应相当。上述结果提示,本研究通过分离纯化所获得的雪灵芝多糖AKP-2a,保持了对适应性、固有性免疫细胞的激活作用并有所增强。这为今后进一步开展雪灵芝多糖的分子结构及免疫激活机制方面的研究打下了一定基础。

