异常糖链糖蛋白不同截断值排查肺癌的效能
张红军 房延凤 谢永宏 金发光 顾 兴
目前有许多研究发现,在正常细胞癌变时,其细胞膜表面的聚糖结构会发生某些变化,造成血液循环当中的异常糖链糖蛋白(tumor abnormal protein, TAP)水平不同程度的升高[1-2]。随着研究的深入,表明TAP是细胞原癌基因(proto-oncogene)和抑癌基因(caner suppressor gens)突变后表达的产物,是不同种类的癌细胞在异常增生过程中的共同特征[3],在细胞恶变时细胞膜表面的聚糖结构发生改变,并分泌到血液,达到一定浓度后可以通过技术手段在外周血中检测出来[2, 4]。国内许多学者在研究中还发现,TAP在肺、甲状腺、口腔、食道、胃、肝胆、结直肠,以及乳腺、卵巢、子宫与淋巴等多种实体肿瘤患者外周血当中均具有相当高的表达[5],而且,其敏感度可高达80%以上[6-8],所以TAP可作为较好的肿瘤检测标志物(tumor markers, TM)之一[9]。
肺癌是当今世界上发病率和死亡率最高的恶性肿瘤,5年生存率不高于15%[10]。早发现、早诊断和早治疗,从而降低肺癌患者死亡率及改善预后是全世界医学家们所努力的共同课题。2013年8月6日,TAP检测项目被卫生部列入国家《医疗机构临床检验项目目录》(共计1 462种),TAP检测从此在临床各学科逐渐开展起来。同时,TAP在肺癌领域的应用也越来越多,其目的是想努力实现肺癌的早诊早治[11]。但是,查阅国内外文献,发现TAP在肺癌领域的相关研究甚少。怎样解读TAP检测结果,TAP排查肺癌的效能如何,这些问题仍然使许多临床医生感到困惑。本文通过肺癌患者和非肺癌患者的TAP检测数据进行回顾性分析,对TAP不同截断值排查肺癌的效能进行了探讨。
对象与方法
一、研究对象
选我院呼吸与危重症医学科 2018年4月至 2018年7月经治的肺癌患者176例,年龄34~84岁,平均年龄63岁;其中男性136例(77.3%),女性40例(22.7%);腺癌56例(31.8%),鳞癌64例(36.4%),小细胞癌39例(22.2%),未分类癌17例(9.6%)。另收集同时期经治的非肺癌患者113例,年龄26~91岁,平均年龄63岁;其中男性70例(61.9%),女性43例(38.1%);慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD) 18例(15.9%),肺结核(pulmonary tuberculosis, TB)20例(17.7%),特发性肺间质纤维化(idiopathic pulmonary interstitial fibrosis, IPF)9例(8.0%),肺部感染60例(53.1%),其它病种6例(5.3%)。患者入选标准:①所有肺癌患者均经电子支气管镜或经皮肺穿刺活检行病理学检查确诊;②所有肺癌患者及非肺癌患者均进行TAP检测。
二、研究方法
对所有入选的肺癌患者及非肺癌患者检测到的TAP结果进行分析,判定理想截断值,并与TAP检验报告解读及处理建议所提供的截断值相比较,探讨这两种截断值排查肺癌的效能。
所有肺癌患者及非肺癌患者均清晨空腹,予5 ml注射器抽取静脉血3 ml,采用由浙江瑞生医疗仪器厂提供的综合诊断仪和TAP凝聚剂,用凝聚素亲和法进行TAP检测。检测时使用其公司的原装配套试剂盒,并严格按照试剂盒的说明进行。
三、统计学方法
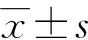
结 果
一、肺癌组与非肺癌组的年龄、性别、TAP及构成类型特点
经检验分析显示,肺癌组与非肺癌组相比较,两组在年龄方面没有明显差异(P=0.635),具有可比性;而在性别方面,两组相比较,肺癌组男性患者人数高达77.3%,其差异具有统计学意义(P=0.005)。另外,经单因素方差分析,发现肺癌组TAP(171.82±36.26)明显高于非肺癌组(158.54±32.61),差异具有统计学意义(P=0.002)。
二、肺癌患者TAP理想截断值是170 μm2
通过ROC曲线分析发现,TAP用于排查肺癌患者的理想截断点是170 μm2,敏感度54.55%,特异度64.60%,ROC曲线下的面积(AUC)是0.622(标准误0.034,95%可信区间0.554-0.689,P<0.001),见表1、图1。
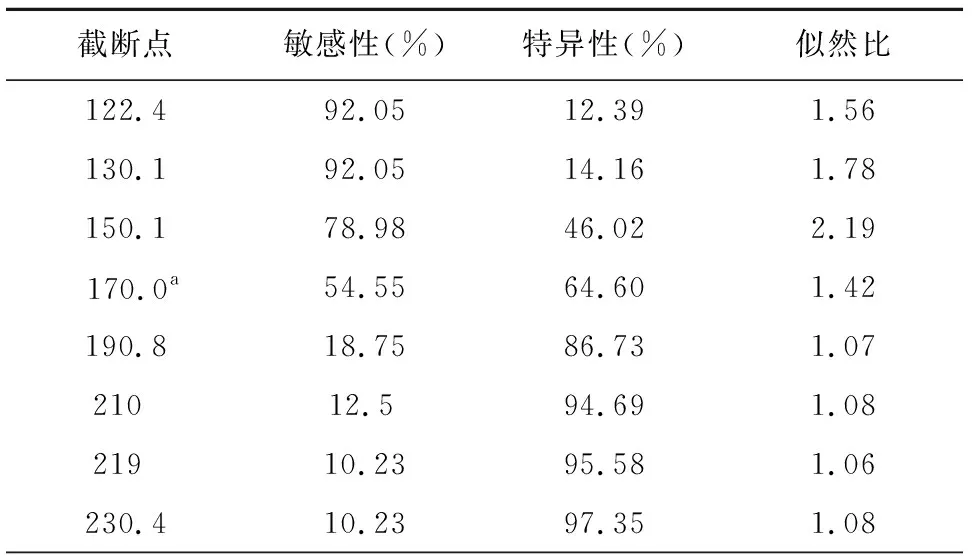
表1 TAP不同截断点的敏感度、特异度和似然比
注:a理想截断值

图1 TAP的ROC曲线
三、TAP不同截断值排查肺癌的效能比较
根据TAP检验报告解读及处理建议,TAP检验结果可解读为三个级别:①TAP≤121 μm2:说明被检者体内TAP含量正常,无明显凝聚物,或肿瘤患者治疗有效,或接近或进入终末期的肿瘤患者;②121~225 μm2:说明被检者体内TAP含量异常,凝聚物较小,存在肿瘤风险;③≥225 μm2:说明被检者体内TAP含量异常,凝聚物较大,肿瘤风险较大。为此,我们应用其推荐值的三个区间分别对肺癌组、非肺癌组及肺癌组+非肺癌组进行分析,计算各自阳性率,经χ2检验,发现三组之间并无明显的差异(P=0.577)。同理,我们将本文所得截断值,以170 μm2为界,按两个区间分别对肺癌组、非肺癌组及肺癌组+非肺癌组进行分析,计算各自阳性率,经χ2检验,发现肺癌组54.55%与诊断一致,非肺癌组64.60%与诊断一致,而肺癌组+非肺癌组两个区间分别是47.06%和52.94%,三组之间的差异具有统计学意义(P=0.006),见表2。
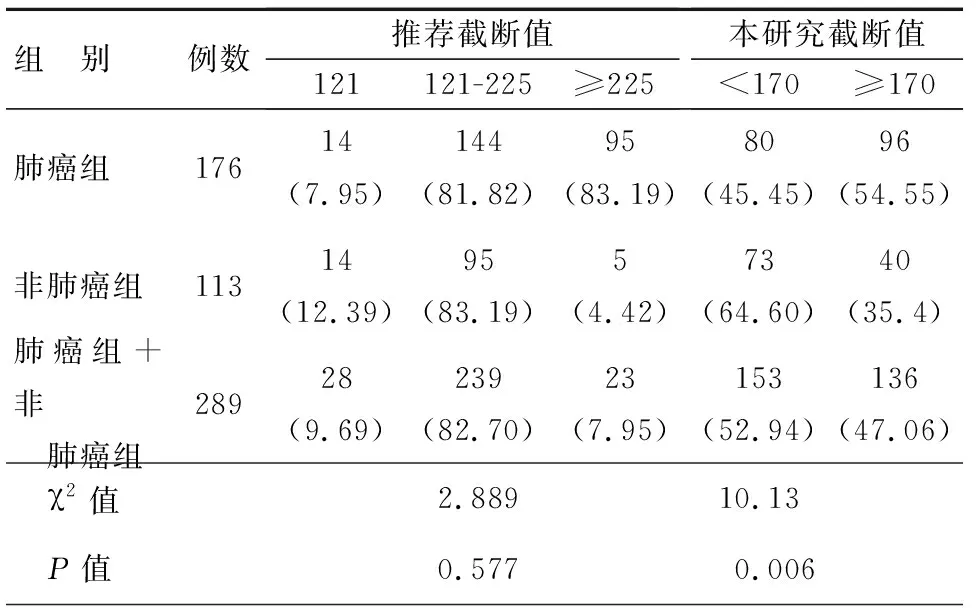
表2 TAP不同截断值排查肺癌的效能比较[n(%)]
讨 论
异常糖链糖蛋白(TAP)最初是由乌克兰科学院的伽利欣院士发现的,当时将其与甲胎蛋白(AFP)进行联合检测,大大的提高了肝癌的检出率[4]。后来,随着研究的不断深入,发现TAP的检测是一种组合肿瘤标志物检测技术,它以糖蛋白上的“异常糖链”作为识别位点,能够一次性组合检测几十种TAP,如AFP、CEA、糖蛋白抗原系列(CA 系列)、碱性磷酸酶、人绒毛膜促性腺激素及酸性磷酸酶等[12],所以TAP对全身肿瘤均具有很高的敏感性[13-18]。由于TAP可高浓度聚集多种肿瘤信号,具有灵敏度高、适用癌谱广、痛苦小、易于普及等多种优势[19-21],临床上应用越来越广泛。尤其在肺癌领域,TAP临床应用日益增多[11, 22-25],相关研究也逐渐开展起来。我们曾对腺癌、鳞癌及小细胞癌等不同病理类型的肺癌患者TAP水平,以及其与CEA、鳞状细胞癌抗原(SCC)、糖类抗原125(CAl25)、神经元特异性烯醇化酶(NSE)和细胞角蛋白19片段(CYFRA21-1)等传统肿瘤标志物的相关性进行了研究,发现TAP在肺腺癌患者中与传统肿瘤标志物具有较好的正相关性[26]。那么,随着TAP的临床应用和相关研究的开展,还有没有急需解决的问题?答案是肯定的,如:怎样解读TAP检测结果,TAP排查肺癌的效能如何等。
为更好的解读TAP检测结果,本文通过回顾性分析,对TAP在肺癌领域的应用进行了初步探讨。结果发现,与非肺癌患者相比较,肺癌患者TAP明显高于前者。进一步通过ROC曲线分析可以得出,TAP用于排查肺癌患者的理想截断点是170 μm2。我们将此截断值(170 μm2)与TAP检验报告解读及处理建议所提供的截断值(≤121 μm2、121~225 μm2、≥225 μm2)分别应用于肺癌组、非肺癌组及肺癌组+非肺癌组,结果发现这两种截断值排查肺癌的效能不同,前者在三组间存在显著性差异,而后者在三组之间并无明显差别。那么,170 μm2是否具有很好的排查肺癌的效能呢?从本文中可以看出,TAP的ROC曲线下面积是0.622,虽然其在0.5~1之间,但是根据Swets判断标准[27-30],面积在0.5以下,说明实验没有诊断价值,面积在0.5~0.7之间有较低的准确性,面积在0.7~0.9之间具有一定的准确性,因此可以认为,170 μm2这个截断值排查肺癌的效能还是比较低的。本文数据表明,以170 μm2作为截断值,肺癌组、非肺癌组及肺癌组+非肺癌组的阳性率及阴性率分别是54.55%与45.45%、64.6%与35.4%、47.06%与52.94%,虽然他们的差异具有统计学意义,但是由于阳性率较低,而阴性率又太高,显然很难满足临床需要。
本研究通过临床数据分析,对不同截断值的TAP排查肺癌效能进行了初步探讨,获得了初步研究结果,但是由于本研究样本量较少,研究对象存在性别差异,也没有纳入正常人群进行校正,对研究结果的可靠性存在一定的影响,具体程度不得而知,尚需今后扩大样本量、扩大研究人群进一步研究。
综上所述,肺癌患者TAP明显高于非肺癌患者,其对肺癌的排查具有一定的参考价值,但是,TAP不同截断值排查肺癌的效能是不同的,如仅将TAP单独应用于肺癌领域,其效能并不高,这一点需引起临床注意。

