YAP调控肺癌A549/DDP细胞顺铂耐药性的机制分析
肖 丹 杜 琴 贺斌峰 郭晓兰
肺癌是我国以及全球最常见的恶性肿瘤,也是癌症死亡的主要原因[1-2]。全球每年有1 800万人被诊断患有肺癌,并且有1 600万人因该病而死亡。肺癌主要以非小细胞肺癌(non-small cell lung cancer, NSCLC)为主,约占85%。目前临床上除根治性手术切除以外,以顺铂为例的常用化疗药物也在NSCLC治疗中占据重要位置。由于大多数患者确诊时已处于肺癌晚期,手术治疗不佳,而肿瘤初始固有的或后天产生的顺铂抵抗,又使化疗效果不尽如人意。肺癌患者5年生存率仅为4%~17%[3]。目前对NSCLC顺铂耐药机制仍尚不清楚,因此研究顺铂耐药机制,从分子水平或多药联合最大化顺铂的抗癌疗效极为重要。
Yse相关蛋白(Yes-associated proteini, YAP)作为控制组织器官大小的高保守Hippo信号通路中的核心成员,当其过度激活时会造成肿瘤过度增殖、凋亡减少、化疗抵抗等[4]。但YAP对非小细胞肺癌顺铂耐药性的影响尚不清楚。因此,本实验采用维替泊芬作为YAP分子抑制剂,探讨维替泊芬抑制YAP对A549/DDP细胞顺铂耐药性影响及可能机制[5]。
材料与方法
一、实验材料
人肺腺癌耐顺铂细胞株A549/DDP 购于中乔新舟公司、人肺腺癌细胞株A549由中科院上海细胞所提供。胎牛血清购于Gemini Bio公司;F12K、谷氨酰胺购于GIBCO公司;RPMl l640、青霉素一链霉素(双抗)、胰酶均购于上海源培公司;顺铂注射液购于江苏毫森公司;维替泊芬(Verteporfin, VP)购于Selleckchem公司;MTS试剂盒、逆转录试剂盒、RT-qPCR试剂盒购于Promega公司;PCR引物由生工合成;YAP(货号:14074T)、β-Actin(货号:3700S)抗体购于CST公司;山羊抗兔IgG(H+L) (货号:131879)、山羊抗鼠IgG(H+L) (货号:135529)购于Jackson ImmunoResearch公司。
二、实验方法
1. 细胞培养: A549细胞用含10%胎牛血清的F12K培养,A549/DDP细胞用含 10%胎牛血清以及1 μg/ml顺铂作为维持浓度的RPMl l640培养,细胞均置于37 ℃、5%CO2孵箱中培养。当细胞融合面积约90%时,进行传代。
2. MTS实验检测顺铂对A549细胞以及A549/DDP细胞的IC50:取对数生长期细胞,胰酶消化、离心、10%血清培养基重悬、计数,将细胞数调整为4×104/ml,取100 μl A549细胞以及A549/DDP细胞悬液加入96孔板,将96孔板放于37 ℃、5%CO2箱孵培养12 h。待细胞完全贴壁后,去除原有培养基,将顺铂浓度为1、2、5、10 μg/ml的血清培养基分别加入A549细胞以及A549/DDP细胞中,每组样本设置4个复孔,将只加培养基不加细胞的样本设置为空白对照组,将细胞中加 DMSO培养基的样本设置为阴性对照组。按MTS实验说明书,除去孔内培养基,加入100 μl培养基和20 μl MTS,放孵箱继续培养2.5 h。酶标仪测量490 nm各孔OD值,实验重复三次以上。计算细胞活率、IC50以及耐药指数。细胞活率(%)=(对照组OD值一空白对照组OD值)/(实验组OD值一空白对照组OD值)×100%;耐药指数=A549/DDP细胞株IC50/A549细胞株IC50。
3. MTS实验检测A549/DDP细胞在DMSO对照组、DDP处理组、VP处理组以及DDP联合VP处理组中细胞活力: 将A549/DDP细胞消化,按4 000个每孔接种于96孔板,过夜培养后。用含5 μg/ml DDP,5 μM VP以及5 μg/ml DDP+5μM VP的血清培养基分别处理A549/DDP细胞,每组样本设置4个复孔,并设置空白对照。将96孔板置于37 ℃、5%CO2箱孵分别培养0、24和48 h后去除培养基,加入100 μl培养基和20 μl MTS,放孵箱继续培养2.5 h酶标仪测量490 nm各孔OD值,实验重复3次。
4. Westem blot法检测YAP的表达: 对数生长期A549/DDP细胞铺板,待12 h细胞完全贴壁后,分别用含5 μM VP血清培养基处理48 h。收集细胞后加适当体积蛋白裂解液,冰上裂解30 min(每10 min涡旋震荡,充分裂解细胞),以离心半径8 cm,12 000 r/min,4 ℃离心10 min获得蛋白上清,用BCA法测定蛋白浓度。用12%SDS-PAGE胶电泳,转膜300 mA 60 min(PVDF膜预先用甲醇激活,也要避免胶与膜之间气泡产生),5%脱脂牛奶室温封闭1 h,孵一抗(YAP、GAPDH),抗体按1︰1 000稀释,4 ℃摇床过夜,TBST洗膜10 min,重复3次,室温二抗按1︰5 000孵育1 h,TBST洗膜10 min,重复3次,用ECL化学发光试剂盒显影,实验重复3次以上。
5. qPCR检测YAP以及ALDHA1、CD133、OCT4、NANOG、SOX2表达: 收集对数生长期A549和A549/DDP细胞以及A549/DDP用5 μM VP处理48 h后细胞。加入1 ml Trizol裂解细胞,氯仿、异丙醇提取总RNA,测浓度,取1 000 ng RNA按Promega逆转录试剂盒说明书20 μl体系逆转为cDNA,用DEPC水稀释cDNA,按 Promega实时荧光定量PCR试剂盒说明书10 μl体系进行qPCR,观察扩增曲线和溶解曲线,计算目的基因的相对表达量。实验重复3次,每个样本均设3个副孔。内参基因GAPDH以及各目的基因引物序列如下:YAP F:5′-TAGCCCTGCGTAGCCAGTTA-3′,R:5′-TCATGCTTAGTCCACTGTCTGT-3′;SOX2 F:5′-TGCTGCCTCTTTAAGACTAGGAC-3′,R:5′-CCTGGGGCTCAAACTTCTCT-3′;OCT4 F:5′-CTTCGCAAGCCCTCATTTC-3′,R:5′-GAGAAGGCGAAATCCGAAG-3′;CD133 F:5′-GCATTGGCATCTTCTATGGTT-3′,R:5′-CGCCTTGTCCTTGGTAGTGT-3′;ALDH1A1 F:5′- AGGGGCAGCCATTTCTTCTCA-3′,R:5′- CACGGGCCTCCTCCACATT-3′; NANOG F:5′-GATGCCTCACACGGAGACT-3′,R:5′-TTTGCGACACTCTTCTCTGC-3′;GAPDH F:5′-GATTCCACCCATGGCAAATTCC-3′,R:5′-CACGTTGGCAGTGGGGAC-3′。
三、统计学方法
结 果
一、A549和A549/DDP细胞顺铂耐药性比较
用浓度梯度顺铂处理A549和A549/DDP细胞,经MTS实验检测,绘制细胞活力曲线(见图1A),结果显示顺铂对A549以及A549/DDP细胞活力均有抑制作用,但顺铂对A549细胞抑制明显高于A549/DDP细胞(P<0.05)。A549细胞的IC50为(4.07±0.0235)μg/ml,A549/DDP细胞的IC50为(23.44±0.975) μg/ml(见图1B),耐药指数为5.76。
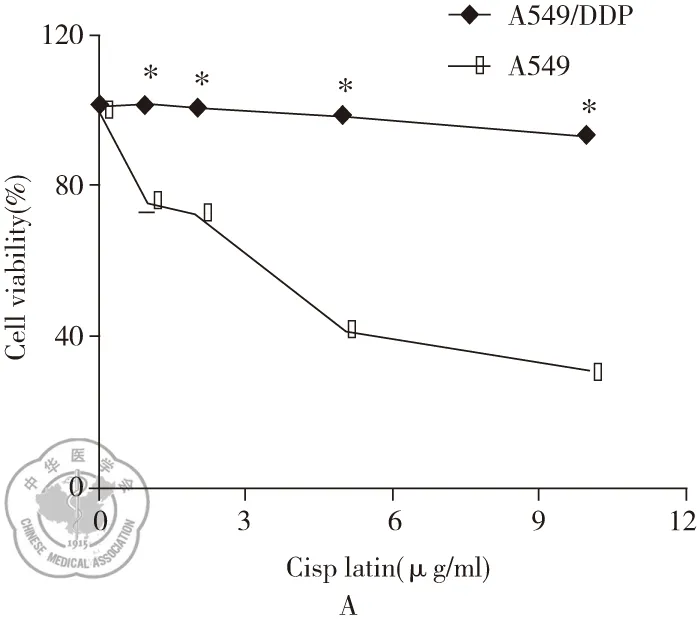
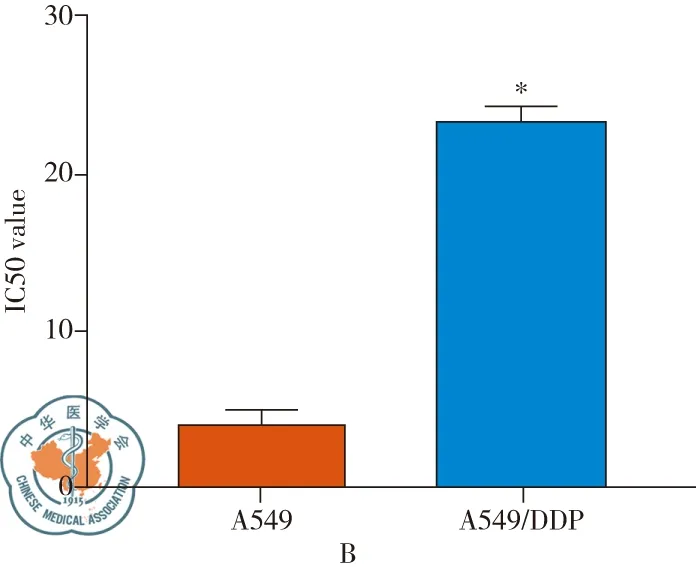
图1 A549/DDP抵抗顺铂的杀伤作用;注:A:MTS顺铂处理A549以及A549/DDP细胞的细胞活力曲线;B:A549以及A549/DDP细胞的顺铂IC50;注:*与A549细胞相比,P<0.05
二、YAP在A549以及A549/DDP细胞中的表达
A549以及A549/DDP细胞经qPCR检测,发现YAP mRNA在A549/DDP细胞中相对表达量是A549细胞的(3.806±0.224)倍,差异具有统计学意义(P<0.05)(图2A)。Western blot检测显示YAP蛋白在A549/DDP细胞中的表达水平显著高于A549细胞(图2B)。
三、VP增强A549/DDP细胞对顺铂敏感性
Western blot检测发现,A549/DDP细胞经VP处理组后,YAP的表达水平较DMSO处理组明显降低(图3A)。经MTS实验检测细胞活力显示,5 μg/ml DDP,5μM VP以及5 μg/ml DDP+5 μM VP组在48 h细胞活力显著低于DMSO组(P<0.05),在24 h时5 μg/ml DDP组与DMSO组无显著差异(P>0.05)。5 μg/ml DDP+5 μM VP组在24 h和48 h时间点时的细胞活力显著低于5 μg/ml DDP组(P<0.05)。上述结果提示VP处理后 A549/DDP细胞对顺铂的药物敏感性显著提高(图3B)。
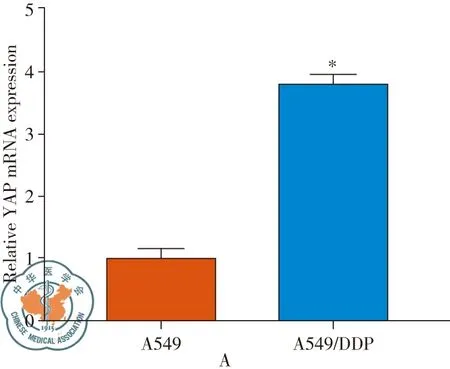

图2 检测YAP在A549/DDP中的表达;注:A:qPCR检测YAP mRNA在A549以及A549/DDP细胞中的表达; *,与A549细胞相比,*P<0.05;B:Western blot检测YAP蛋白在A549以及A549/DDP细胞中的表达
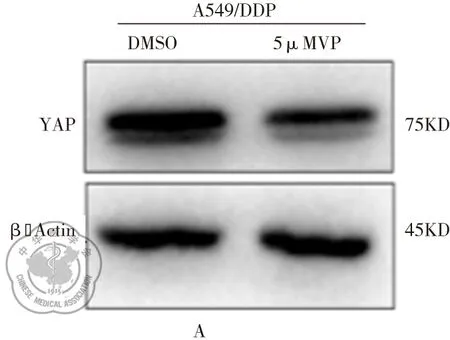
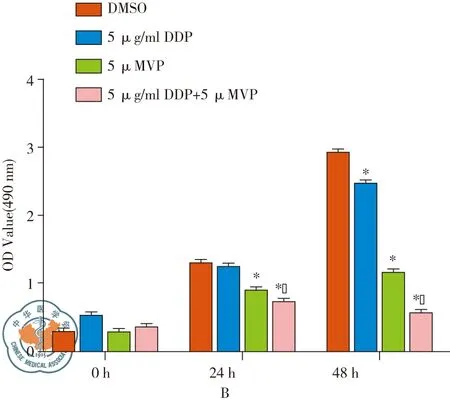
图3 VP增强A549/DDP细胞对顺铂敏感性;注:A:Western blot检测VP 处理后A549/DDP细胞中YAP蛋白表达;B:经药物处理后A549/DDP细胞的细胞活力;注:*,与DMSO组相比,*P<0.05;^,与DDP组相比,^P<0.05
四、VP抑制A549/DDP细胞中干细胞标志物
经qPCR检测,结果显示A549/DDP细胞VP处理组中ALDHA1、CD133、OCT4、NANOG、SOX2 mRNA的表达较DMSO处理组均明显降低,见图4。
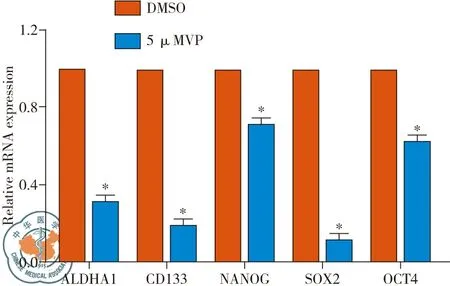
图4 qPCR检测A549/DDP细胞经VP处理后干细胞标志物mRNA的表达变化;注:*,与DMSO组相比,*P <0.05
讨 论
HIPPO信号通路是在果蝇体内发现的高保守信号通路,通过一系列激酶级联磷酸化反应,最终磷酸化下游的转录共激活因子YAP。相反,如果YAP在细胞浆中发生磷酸化修饰,则与14-3-3蛋白结合,从而滞留于细胞质,降低其在细胞核中的共转录活性,实现控制组织器官大小[6]。研究显示,当YAP过度激活时会造成肿瘤增殖、迁移、侵袭、耐药等[4, 7]。本实验通过qPCR以及Western blot检测发现相对于A549细胞,耐顺铂的A549/DDP细胞中YAP显著高表达,提示YAP可能与A549/DDP细胞顺铂耐药有关。
VP临床上常用于治疗继发于年龄相关性黄斑变性,近年来研究发现维替泊芬可作为YAP抑制剂[5]。本实验采用VP处理A549/DDP细胞后,可显著下降YAP的表达,与文献报道相一致[5]。大量研究发现VP抑制YAP,可与化疗药物出现协同抗肿瘤作用。VP抑制 YAP,进而下调ABCG2,使肺癌干细胞样细胞对化疗药物阿霉素敏感[8]。YAP可促进厄洛替尼对敏感的非小细胞肺癌EGFR突变类型的HCC827 (exon 19 deletion)细胞系产生厄洛替尼抗性,VP则可抑制YAP增加对非小细胞肺癌EGFR突变H1975(L858R+T790M)细胞系对厄洛替尼的敏感性[9]。其他研究也表明VP可阻断YAP/TEAD1/PDGF-BB/PDGFR环,增强DNA破坏,从而抑制膀胱癌干细胞样细胞的顺铂耐药性,增强尿路上皮细胞癌细胞对顺铂的敏感性[10-11]。这提示维替泊芬可能在改善肿瘤化疗耐药方面发挥重要作用。因此,研究YAP分子抑制剂VP能否增强非小细胞肺癌耐顺铂细胞对顺铂的敏感性具有较高的临床价值。本实验用VP联合顺铂干预A549/DDP细胞后,可有效杀伤耐药细胞,而单纯顺铂无明显的抑制耐药细胞增殖的作用。上述结果说明抑制YAP可促进耐药细胞A549/DDP细胞对顺铂的敏感性,进而增强顺铂对该细胞的杀伤作用。
肺癌细胞的耐药机制较为复杂,目前认为肺癌细胞的“干细胞特性”在其中发挥着关键的作用。其标志物主要包括SOX2、OCT4、NANOG、CD133、ALDHA1。它们在维持胚胎干细胞、胚胎发育、建立诱导多能干细胞中发挥重要作用[12-14,17]。干细胞是许多组织中寿命最长的细胞,而癌症的发生需多种突变积累,因此,最初的致癌突变可能发生在干细胞中。近年来研究认为肿瘤的生长是由干细胞特性的细胞亚群即癌症干细胞(cancer stem cell, CSC)推动的,且与癌症发生、维持、耐药、转移、复发密切相关[18-20]。通常治疗抵抗的肿瘤与治疗前相比具有更高比例的干细胞特性特征的细胞,通过抑制CSC可能是一种逆转癌症治疗抵抗的新策略[21]。SOX2高表达与吉西他滨抗性相关,而下调SOX2可使胰腺癌细胞对吉西他滨治疗敏感。在妊娠滋养细胞疾病中表达干细胞标志物NANOG和SOX2以及更高水平的OCT4(NANOG+/OCT4high/SOX2+)的滋养细胞干细胞样细胞(SLCs)对化学治疗药物阿霉素也具有抗药性。既往研究表明YAP/TAZ途径在维持人类癌症的CSC特性中起重要作用。在膀胱癌中YAP可作为癌症干细胞调节因子,沉默YAP抑制ALDH1A1基因的表达。血清反应因子介导YAP与乳腺干细胞特征基因启动子相结合可以诱导基底样乳腺癌干细胞特性。本实验发现,A549/DDP细胞经VP处理后,SOX2、OCT4、CD133、NANOG、ALDHA1的mRNA表达均显著下降,提示抑制YAP可能通过下调干细胞标志物的表达,抑制耐药细胞的“干细胞特性”从而降低A549/DDP细胞对顺铂的耐药性。
综上所述,本实验发现YAP可能参与了肺癌细胞的耐药。抑制YAP可通过抑制肿瘤干细胞特性,进而发挥逆转耐药的作用。因此,YAP可能是治疗肺癌及肺癌耐药的的重要靶点。

