睾酮、雌二醇在男性肺结核合并炎症性贫血患者中的表达意义
黄东轩 廖毅力 何朝文 黄冬生 彭剑锋 杨 帆 曹亚辉
肺结核(tuberculosis, TB)为世界上单一传染病病死率第一位,确诊后需采取抗结核杆菌治疗方能避免疾病进一步恶化[1-3]。探索更迅速、有效治疗TB患者的方法已成为医学研究热点,干扰宿主细胞信号传导及免疫细胞所需营养已成为治疗TB的一种方法,而其中Fe2+对TB的治疗发挥着重要作用[4]。TB治疗效果较差的原因可能是未对相关合并症进行细致观察和及时处理,一项风险评估实验中发现合并炎症性贫血(inflammatory anemia, AI)的TB患者病死率更高[5]。TB本质为气道炎性反应加重、抗感染能力减退引起免疫功能进一步降低,一旦合并AI可进一步介导细胞因子的稳态调节而加重炎性应激反应,导致疾病迁延不愈。近年的一项TB病死率的大数据分析结果显示,男性病死率高于女性,考虑与男性相关性激素有关[6]。睾酮(testosterone, T)、雌二醇(estradiol, E2)参与多种心血管疾病、免疫应答、炎性应激反应,其可能对AI抑制有重要价值[7]。T、E2作为一类甾体类类固醇激素,由性腺和肾上腺皮质分泌,通过血液循环运输至全身发挥生理病理作用。目前并未对T、E2作出定量定性分析并探讨其与AI的相关性,在鉴别诊断和预后预测上存在一定片面性。因此本文探讨T、E2在TB合并AI患者中的表达、临床意义及其相关性,旨在为TB合并AI的治疗及预后预测提供具有临床价值的信息。
资料与方法
一、一般资料
经本院医学伦理委员会讨论后批准,选择2018年1月至2019年9月于我院确诊的TB患者39例和TB合并AI患者34例作为研究对象,所有患者及家属均签署知情同意书。纳入标准:①TB诊断参照肺结核诊断标准,AI诊断参照AI诊断标准[8-9];②均为男性;③年龄20~65岁;④病历资料完整,各项检查完善;⑤无严重感染性疾病且凝血功能正常;⑥非其他原因引起的贫血;⑦生活作息较规律,无不良嗜好。排除标准:①合并心、肝、肺等严重功能不全者;②合并其他类型激素异常疾病或性腺功能障碍;③近期使用过激素类药物或免疫调节剂;④合并严重精神病或沟通障碍;⑤并发肺性脑病、休克、昏迷者;⑥依从性特别差或中途要求退出的受试者;⑦临床研究过程中出现严重合并症或并发症者需进行其他治疗。
二、研究方法
收集并比较研究对象基线资料,年龄、身高、身体质量指数(body mass index, BMI)、吸烟史、饮酒史、高血压病史、糖尿病病史;实验室指标,抽取研究对象前臂肘空腹静脉血5 ml,置于含促凝剂的真空采血管中,在20 min内,于4 ℃、以离心半径8 cm,1 000 r/min离心15 min,分离血清后置于-80 ℃冰箱保存备用;速率法检测红细胞计数(red blood cell count, RBC)、血红蛋白(hemoglobin, Hb)、网织红细胞计数(reticulocyte, RET),仪器为BS390全自动生化分析仪(迈瑞生物医药公司);激素水平,取上述备用血,参照ELISA试剂盒(Abcam公司)说明书,采用E170全自动电化学发光免疫分析仪(瑞士罗氏公司)测定计数器上各沉淀管放射性计数,经过数据处理后获得标准曲线并读取E2、T水平。
将TB患者外周血CD4+、CD8+T细胞纯化后放入含10%胎牛血清的培养基中培养并计数,实验组为E2+T+PBS溶液,对照组为PBS溶液;培养24 h后室温下离心5 min,取上清液采用ELISA法检测E2、T表达量。
三、统计学方法
使用SPSS21.0软件进行统计分析,计量资料比较采用t检验,非正态分布计量资料采用秩和检验;计数资料比较采用χ2检验;采用Spearman相关系数分析激素水平与实验室指标相关性;对并发AI有鉴别诊断意义(P<0.05)的自变量均引入二分类Logistic多元回归方程,Logistic回归分析TB并发AI高危因素;P<0.05表示差异有统计学意义。
结 果
一、TB组与TB合并AI组临床资料比较
TB组与TB合并AI组患者身高、BMI、吸烟史、饮酒史、高血压病史、糖尿病病史比较无显著差异(P>0.05),年龄、RBC、Hb、RET、E2、T比较有显著差异(P<0.05),见表1。
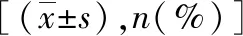
表1 TB两组临床资料
注:BMI:身体质量指数;RBC:红细胞计数;Hb:血红蛋白;RET:网织红细胞计数;T:睾酮;E2:雌二醇
二、相关性分析
E2与T呈显著正相关关系,P<0.05,见图1。

图1 T、E2相关性图
E2、T与RBC、Hb、RET均呈显著正相关关系,P<0.05,见表2。

表2 E2、T与RBC、Hb、RET相关性分析
注:RBC:红细胞计数;Hb:血红蛋白;RET:网织红细胞计数
三、Logistic回归方程分析TB并发AI危险因素
以单因素分析中差异存在统计学意义的影响因素作自变量,采用多因素Logistic回归分析TB并发AI的独立影响因素。分析结果显示:RBC、Hb、E2、T为保护因素(P<0.05),年龄、RET是TB并发AI独立影响因素,P<0.05,见表3。
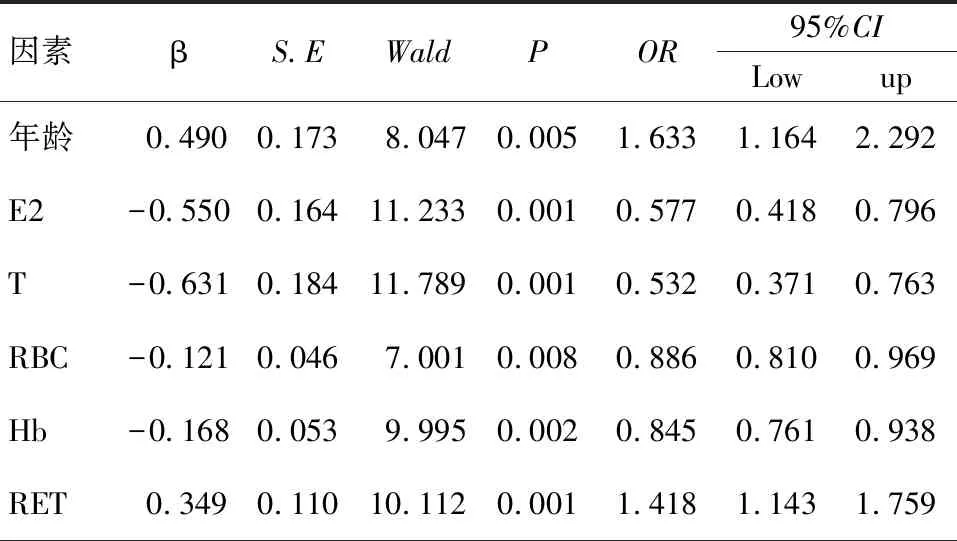
表3 TB并发AI危险因素分析
注:RBC:红细胞计数;Hb:血红蛋白;RET:网织红细胞计数;T:睾酮;E2:雌二醇
四、T、E2对T细胞体外刺激诱导实验
加入 T、E2刺激的实验组CD3+、CD8+下降趋势较空白组有显著差异,P<0.05,见图2。

图2 T、E2对T细胞体外刺激诱导实验图;注:A:空白组CD3+水平变化;B:实验组CD3+水平变化;C:空白组CD8+水平变化;D:实验组CD8+水平变化
讨 论
TB产生的高耐药性与细胞免疫应答障碍密切相关,特别是并发AI后可导致病情发展急骤、变化迅速凶险且累及多系统器官[10-11]。这可能与机体内存在过高的血清游离铁有关,其可参与氧化还原反应而催化自由基产生,导致DNA、蛋白质及脂质的破坏,使机体产生过量毒性作用。相关试验表明,T、E2和血清铁呈显著负相关,提示其可能参与铁的分泌和利用,限制AI发生和发展[12]。本文结果显示,TB合并AI患者体内T、E2水平显著低于单纯TB患者,与既往报道结果相一致,提示T、E2可能与AI发病有关[13-15]。Zuo等[16-17]通过实验发现,单纯性TB患者体内可呈T、E2高表达状态,其对改善免疫应答、炎症和贫血状态有一定价值。而其作用机制可能受多种因素影响,目前在大鼠体外实验中发现经Hb刺激后的T、E2功能显著提高,提示红细胞可能影响机体T、E2的功能[18]。本文结果显示,T、E2与血常规指标WBC、Hb、RET均呈显著正相关,考虑T、E2可能与红细胞生成密切相关。T、E2均为雄激素中含量较高、生物活性较强的激素,参与生殖器官、骨骼、脑的生长发育及机体免疫代谢调节。近年研究证实,T、E2可通过提高促红细胞生成素浓度来促进红细胞骨髓造血能力,本文Logistic回归分析和相关系数分析显示T、E2为AI发生危险因素,考虑与其促进造血功能来降低性腺激素水平有关,下降至正常的性腺激素水平为AI的发生低风险。但结果中T、E2相关性与既往研究中指出的T不受E2影响不符合,考虑与本文选择的均为TB患者有关,而未对健康者T、E2进行探讨影响了结果误差[19-20]。
另结核分枝杆菌(Mycobacteriumtuberculosis, MTB)参与的免疫效应可介导T细胞产生免疫作用,其中CD4+、CD8+T细胞发挥着重要作用[21]。而胡型忠等[22]相关体内刺激实验显示,单核细胞、T细胞、B细胞等表面均有雌激素受体表达,其与特异性蛋白结合后可参与转录和逆转录过程,产生免疫生物学应答。免疫功能障碍较严重者,清除体内结核杆菌能力较弱,且易产生耐药性,相关研究显示在耐药性TB患者体内可呈现T、E2缺失,提示低表达T、E2患者免疫机制较低[23-25]。免疫机制失衡的发生与机体T淋巴细胞亚群失衡有关,CD3+、CD4+/CD8+比值异常是机体免疫功能紊乱的标志。为探讨T、E2与MTB关系,本文通过T细胞体外实验发现,加入T、E2刺激的实验组提高了CD3+、CD8+下降趋势,说明T、E2可提高TB免疫机制。T作为诱导机体局部炎性反应的重要炎性介质,已被证实过量表达可提高抗结核杆菌感染敏感性,在AI免疫应答中具有较高价值。E2一旦缺失则会引起肺部损伤修复能力降低,肺部感染进一步加重的机率增加[26-27]。有研究通过敲除基因观察E2含量变化发现T细胞产生的免疫机制通路中E2含量变化显著,其可在细胞内和细胞外呈高表达水平,提示其变化敏感性不受机体影响[28-29]。分析其作用机制发现,E2缺失可阻碍盐桥与T细胞抗原受体(T cell antigen receptor, TCR)相连参与的T细胞信号转导,导致机体免疫机制下降。CD4+主要通过改变T细胞增殖和细胞因子的产生发挥抗结核免疫的调节作用已得到证实,而E2缺失可通过影响CD4+水平而阻断辅助免疫球蛋白合成[30-31]。AI发生后,T水平降低而下丘脑-垂体调节轴发生改变,B淋巴细胞功能和抗体产生能力下降,最终导致机体免疫力降低。CD4+/CD8+是抑制感染重要的免疫细胞,而由结核杆菌感染引起的持续有效的宿主巨噬细胞凋亡抑制机制亦依赖于MTB的下调[32]。T、E2可激活巨噬细胞、进而对胞内炎性物质进行清除,预防AI发生。
综上所述,T、E2与TB患者并发AI密切相关,且对免疫机制起重要作用,在该病治疗过程中应多关注T、E2浓度。

