主动外排系统AcrAB在碳青霉烯耐药大肠埃希菌中表达差异研究*
洪 海,冯 伟,李 燕,曲 欣,孙凤军△
(1.北京卫戍区丰台第十五离职干部休养所门诊部,北京 100141; 2.陆军军医大学第一附属医院药剂科,重庆 400038)
大肠埃希菌是临床最常见的致病菌之一,近年来伴随抗菌药物的广泛使用,其对抗菌药物的敏感性逐年降低,碳青霉烯耐药菌株检出率越来越高[1]。而目前针对碳青霉烯耐药大肠埃希菌的感染尚无有效的治疗手段,主要采取多种药物联用的方式进行治疗,但疗效有限,且使治疗的不良反应增加。碳青霉烯耐药大肠埃希菌的主要耐药机制为产碳青霉烯酶,而对非产碳青霉烯酶菌株的耐药机制研究较少。因此,明确细菌的耐药机制将为碳青霉烯耐药大肠埃希菌感染治疗中抗菌药物的选用提供理论依据。
AcrAB是大肠埃希菌最常见的主动外排泵,AcrAB的高表达与大肠埃希菌多种耐药相关[2-3],AcrAB抑制剂羰基氰氯苯腙可显著增加药物敏感性。AcrAB在碳青霉烯耐药菌株中的作用尚少见报道,本研究拟收集临床分离碳青霉烯耐药大肠埃希菌,根据是否产碳青霉烯酶将其分为产酶组和非产酶组,并用实时荧光定量PCR(RT-PCR)检测acrAB基因表达的差异,分析acrAB在大肠埃希菌耐碳青霉烯类抗菌药物中的作用。
1 材料与方法
1.1材料
1.1.1实验菌株 20株碳青霉烯耐药大肠埃希菌来源于陆军军医大学第一附属医院和重庆医科大学附属第一医院,将其分别命名为SW1-SW10和CY1-CY10。
1.1.2主要试剂及设备 氨苄西林、头孢他啶、头孢哌酮、亚胺培南(imipenem,IMP)、美洛培南、氨曲南、庆大霉素、妥布霉素、环丙沙星、左氧氟沙星和阿米卡星(中国食品药品检定研究所),他唑巴坦(大连美仑生物技术有限公司),哥伦比亚血琼脂平板(重庆庞通医疗器械有限公司),MH培养基(北京陆桥技术股份有限公司),2×Taq MasterMix(北京康为世纪生物科技有限公司),细菌DNA、RNA提取纯化试剂盒(北京天根生化科技有限公司),cDNA 合成试剂盒、2×Realtime PCR Master Mix(上海东洋纺生物科技有限公司),Tris和琼脂糖(上海生工生物工程股份有限公司),多点接种仪(日本Sakuma公司),超声破碎仪、NanoDrop 2000超微量分光光度计(美国Thermo Scientific公司),PCR仪、电泳仪和凝胶成像系统(美国Bio-Rad公司)。
1.2方法
1.2.1最低抑菌浓度(MIC)测定 采用琼脂平板倍比稀释法检测抗菌药物对细菌的MIC值。细菌接种于哥伦比亚血琼脂平板,37 ℃培养过夜。用无菌生理盐水将细菌比浊至0.5个麦氏单位。抗菌药物用生理盐水进行倍比稀释,使其药物终浓度为256、128、64、32、16、8、4、2、1、0.5 μg/mL。采用多点接种仪将稀释菌液接种在含不同浓度抗菌药物的MH琼脂平板上,37 ℃培养18~20 h进行结果判读。
1.2.2改良Carba NP法检测碳青霉烯酶类型 参照文献[4]方法,将细菌接种于3 mL的MH肉汤中,37 ℃、200 r/min条件下培养12~18 h。然后100倍稀释转接于3 mL的MH肉汤中,37 ℃、200 r/min培养至600 nm处吸光度值(A600值)为1.0~1.4。取1.5 mL菌液在4 ℃、5 000×g条件下离心5 min,弃上清液,菌体用20 mmol/L Tris-HCl(pH 7.8)洗2次。菌体沉淀悬于500 μL的20 mmol/L Tris-HCl(pH 7.8)中,在冰浴条件下超声裂解菌体,然后在4 ℃条件下以最大转速离心5 min。取50 μL上清液分别与50 μL的底物Ⅰ、底物Ⅱ、底物Ⅲ、底物Ⅳ、底物Ⅴ混合,37 ℃下孵育1~2 h后根据最后显色结果判断菌株产碳青霉烯酶的类型。
1.2.3碳青霉烯酶耐药基因检测 采用细菌基因组提取试剂盒提取细菌DNA。参照文献[5]设计合成碳青霉烯酶耐药基因引物序列。PCR反应体系(20 μL):2×Taq MasterMix 10 μL,正向和反向引物各0.3 μL,DNA模板0.4 μL,双蒸水(ddH2O)9.0 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,52~56 ℃退火30 s,72 ℃延伸30 s,共35次循环;末次循环后72 ℃延伸10 min,产物进行1%琼脂糖凝胶电泳后观察结果,并将阳性产物送Invitrogen公司进行测序。测序结果在美国国立生物技术信息中心(NCBI)上进行Blast比对。
1.2.4RT-PCR检测碳青霉烯酶阴性和阳性菌株acrAB基因表达的差异 采用细菌RNA基因组提取试剂盒分别对碳青酶烯酶阴性和阳性菌株的总RNA进行提取纯化,然后用超微量分光光度计和1%琼脂糖凝胶电泳对RNA浓度和纯度进行定量和定性分析。采用First Strand cDNA Synthesis Kit将RNA反转录为cDNA,反转录反应条件:42 ℃ 10 min,30 ℃ 20 min,99 ℃ 5 min,4 ℃ 5 min。反应完毕,cDNA产物中加入60 μL RNase Free H2O,混匀,-20 ℃保存备用。acrB引物序列:正向引物TGA TGG TTG TCG GCG TTA,反向引物AGT TCT CAC CAC CCA GCT。RT-PCR反应体系(20 μL):2×Realtime PCR Master Mix 10 μL,正向和反向引物各0.3 μL,cDNA 2 μL,ddH2O补足至20 μL。RT-PCR反应条件:94 ℃ 5 min,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,共40个循环。以16S rRNA作为内参基因进行分析。
1.2.5亚-MIC IMP对碳青霉烯酶阴性菌株acrAB基因表达的影响 碳青霉烯酶阴性菌株接种于血琼脂平板上进行过夜培养。挑取细菌单菌落接种于10 mL LB肉汤中震荡培养过夜。药物处理组:取100 μL过夜培养物加入9.9 mL含IMP的LB肉汤中,使其药物终浓度为1/4 MIC。空白对照组:100 μL过夜培养物加入9.9 mL的LB肉汤中。37 ℃、180 r/min震荡培养过夜后进行RNA提取。然后采用RT-PCR方法检测亚-MIC IMP对acrB基因表达的影响。

2 结 果
2.1MIC测定结果 碳青霉烯耐药大肠埃希菌对临床常见抗菌药物的耐药性见表1。细菌对β-内酰胺类抗菌药物具有较高的耐药性,而对阿米卡星的敏感率最高。
2.2碳青霉烯酶检测结果 采用CarbNP法检测20株碳青霉烯耐药大肠埃希菌的碳青霉烯酶类型(图1),结果显示,有12株细菌的Ⅱ孔和Ⅲ孔由红色变成黄色,提示产B酶;有1株细菌的Ⅱ孔和Ⅳ孔变色,提示产A酶;而有7株菌的Ⅰ~Ⅴ孔均没变色,不产酶。
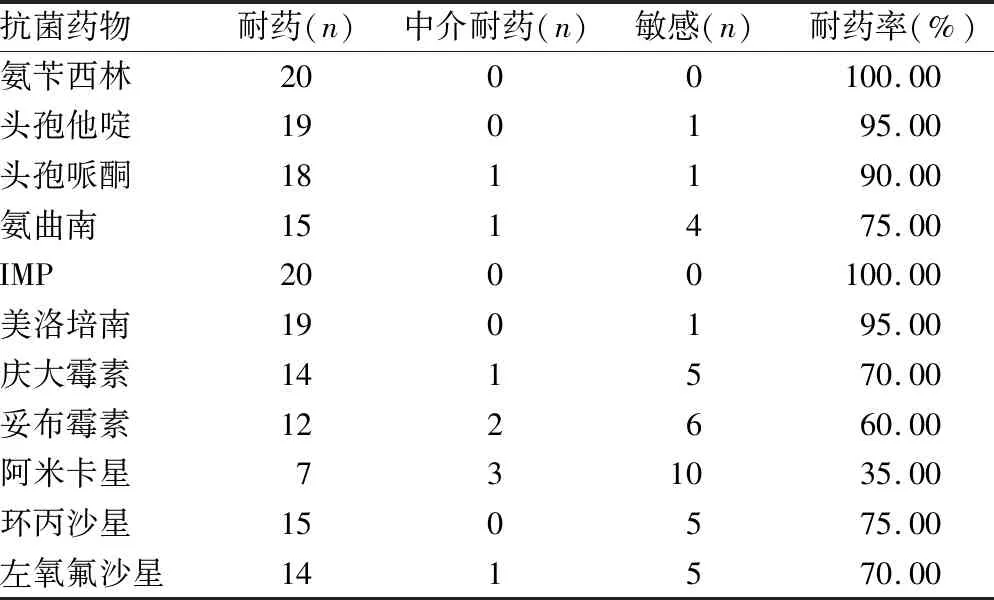
表1 碳青霉烯耐药大肠埃希菌对临床常见抗菌药物的耐药性(n=20)

图1 CarbNP法检测菌株产碳青霉烯酶类型结果
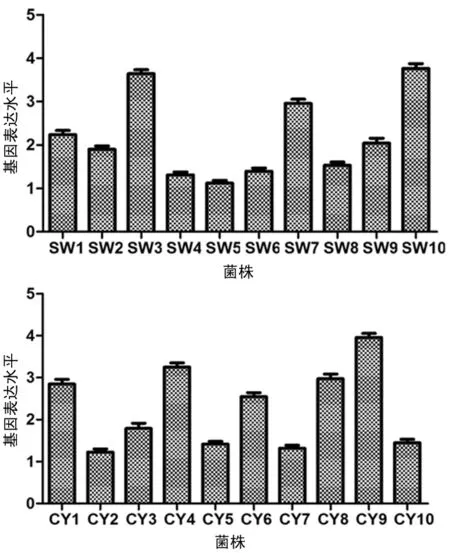
图2 碳青霉烯耐药大肠埃希菌acrAB基因表达结果
2.3碳青霉烯酶耐药基因扩增结果 PCR扩增和测序结果显示,8株菌携带NDM-1基因,3株菌携带IMP-4基因,有1株携带KPC-2基因,其他8株菌不携带碳青霉烯酶基因。其中菌株CY6产酶实验筛选时为阳性,而PCR扩增结果为阴性,即CarbNP试验结果与耐药基因PCR检测的相符度为95%(19/20)。
2.4acrAB基因表达差异分析 20株碳青霉烯耐药大肠埃希菌acrAB基因表达结果见图2。其中,7株碳青霉烯酶阴性菌株具有较高的acrAB基因表达水平,而产碳青霉烯酶菌株acrAB基因表达水平相对较低。
2.5亚-MIC IMP对碳青霉烯酶阴性菌株acrAB基因表达的影响 亚-MIC IMP对碳青霉烯酶阴性菌株acrAB基因表达的影响结果见图3。1/4 MIC IMP均能诱导菌株的基因表达(P<0.05)。

a:P<0.05,b:P<0.01,与对照组比较
图3亚-MICIMP对碳青霉烯酶阴性大肠埃希菌acrAB基因表达的影响
3 讨 论
碳青霉烯类抗菌药物具有抗菌谱广、抗菌活性能力强、不良反应少、对超广谱β-内酰胺酶和头孢菌素酶稳定性好等特点,因此是临床治疗β-内酰胺类耐药细菌感染的首选药物。随着细菌耐药的增高,导致碳青霉烯类抗菌药物的广泛和不合理使用,使得碳青霉烯类耐药菌逐年增高,给临床治疗带来了较大困难。碳青霉烯酶主要存在于铜绿假单胞菌和鲍曼不动杆菌中,在大肠埃希菌中并不多见,但中国细菌耐药监测网(CHINET)数据显示近几年该菌对碳青霉烯类抗菌药物的耐药性逐年增加[6-7]。本研究发现,碳青霉烯耐药大肠埃希菌对临床常用的抗菌药物均表现出较高的耐药性,这与文献报道的碳青霉烯耐药肠杆菌多为泛耐药和多耐药菌株结果一致[8-9],其原因可能为在抗菌药物压力条件下,细菌通过移动序列和质粒获得更多的耐药基因,耐药基因的共同表达导致了多耐药和泛耐药菌株的出现。
碳青霉烯酶的产生是大肠埃希菌对碳青霉烯类抗菌药物耐药的最主要原因。目前,碳青霉烯酶根据氨基酸序列及分子结构特点可分为A类(丝氨酸蛋白酶)、B类(金属酶)和D类[苯唑西林酶(OXA酶)][10]。Carba NP表型确证试验是2015年美国临床和实验室标准协会(CLSI)推荐的用于检测肠杆菌科细菌、铜绿假单胞菌和不动杆菌属细菌产碳青霉烯酶类型的方法。研究表明,该方法对于检测A类和B类碳青霉烯酶灵敏度和特异度较好(均大于90%),而对OXA-48型碳青霉烯酶具有较低的灵敏度[11]。PCR作为耐药基因检测的金标准,本研究通过两种方法检测20株碳青霉烯耐药大肠埃希菌的耐药基因,结果显示仅有7株不产酶,其中8株NDM阳性,3株IMP阳性,1株KPC阳性,而有1株产酶却PCR扩增阴性,可能因存在碳青霉烯酶基因的变异而导致扩增失败。Carba NP试验结果与耐药基因PCR检测的相符度为95%,因Carba NP为表型试验,更为准确,也有利于抗菌药物的选择,作为一种快速、简单、便于大规模检测的方法具有更广阔的的应用前景。研究中碳青霉烯耐药菌株其耐药基因阳性率为60%,主要流行的碳青霉烯酶为NDM和KPC,与国内流行的种类相似[12],并未发现国外流行的VIM和OXA酶[13],该结果说明碳青霉烯酶的分布具有较强的地域差异。NDM是大肠埃希菌最主要的碳青霉烯酶,在2009年才首次发现,远迟于KPC和IMP等酶的报道[14]。在本研究中NDM是最主要的碳青霉烯酶类型,提示NDM具有快速传播的特点,临床应引起高度的重视。
产生RND家族外排泵是大肠埃希菌一个重要的耐药机制,此家族包括AcrAB-TolC、AcrCD-TolC和AcrEF-TolC 3个外排泵,其中AcrAB-TolC因具有底物谱广、外排能力强等特点而研究较多[15]。本研究发现,碳青霉烯酶阴性菌株具有较高的acrAB基因表达。有研究表明,acrAB高表达与喹诺酮类、头孢他啶和四环素类抗菌药物耐药相关[16-17]。而碳青霉烯酶阳性菌株的acrAB基因表达水平较低,可能由于碳青霉烯酶水解IMP药物,使药物在细菌体内蓄积的浓度较低,不足以激活acrAB的表达。此外,碳青霉烯酶主要存在于质粒中,而质粒在抗菌药物压力作用下不断进化,可携带多种抗菌药物的水解酶和钝化酶,在短时间内即可使抗菌药物快速降解,acrAB的作用被弱化。1/4 MIC IMP对碳青霉烯酶阴性菌株acrAB基因均具有明显的诱导作用,说明acrAB高表达在大肠埃希菌耐碳青霉烯类药物中具有一定的作用。然而,acrAB并没有特异性,其高表达对于菌株产生高耐药和泛耐药也同样具有重要的意义。
本研究发现,碳青霉烯耐药菌株对多种抗菌药物均显示出较高的耐药性,提示在抗菌药物压力作用下,细菌耐药性会不断增高,因此临床应根据其药物敏感性选择联合使用抗菌药物。此外,acrAB的高表达是大肠埃希菌耐药的重要因素,是亚-MIC抗菌药物诱导细菌耐药的机制之一,因此临床治疗耐药菌引起的感染时应加大抗菌药物给药剂量,提高血药浓度,使其尽快达到或超过细菌MIC值,这对于增加治疗效果及预防出现更高水平的耐药具有重要意义。

