全腹腔镜胰十二指肠切除术50例报道
涂 奎,赵礼金△,罗 丹,顾 进,穆 锐,王甸北
(1.遵义医科大学附属医院肝胆胰外科,贵州遵义 563000;2.贵州省遵义市妇幼保健院外科 563000)
腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)首先由GAGNER及其团队于1994年开始尝试,但因较高的中转率及并发症发生率,一度被认为与开腹胰十二指肠切除术相比无明显优势[1-2]。直至21世纪初,随着超声刀、内镜切割闭合器的出现,LPD技术才取得了突飞猛进的发展,但由于LPD手术难度大、术后并发症多,加上手术入路、胰肠吻合方式等问题尚未达成统一意见[3],目前仅在少数胰腺疾病诊疗中心开展。现回顾性分析遵义医科大学附属医院成功完成的LPD手术,探讨LPD手术的安全性及可行性,以期促进LPD技术的发展。
1 资料与方法
1.1一般资料 2016年3月至2018年11月于遵义医学院附属医院行全腹腔镜胰十二指肠切除术患者,共计50例,其中男26例,女24例,年龄16~66岁,平均(50.96±3.34)岁。临床表现:黄疸34例(8例术前行PTCD术减黄、2例PTCD失败后行PTGD术前减黄,6例行ERCP活检并行ENBD),腹部隐痛不适25例,食欲减退6例,健康体检行腹部CT检查发现4例。所有患者术前均行腹部彩超、上腹部CT平扫+增强及超声内镜检查,合并阻塞性黄疸的患者均行磁共振胰胆管成像(MRCP)。患者术前检查均未提示肠系膜上动静脉受肿瘤侵犯及淋巴结、远处转移。
1.2方法 患者取“人字位”,头部略高,戳孔位置采取“五孔法”LPD路径[4],气腹压力12 mm Hg。穿刺管大小依次为:脐下10 mm套管,用于放置腹腔镜;左右侧腋前线肋缘下2 cm及平脐腹直肌外缘分别置人5 mm 及12 mm套管(左侧腹直肌外缘12 mm套管利于助手协助时置入切割闭合器)。术者位于患者右侧,助手于左侧,扶镜手位于患者两腿之间。
具体操作步骤如下:进镜后探查腹腔,明确是否存在远处转移,沿横结肠上缘切断胃结肠韧带,进入网膜囊,显露胰腺,沿胰腺上缘解剖显露肝总动脉(图1),解剖第一肝门(图2),清扫肝十二指肠韧带内淋巴结。在胰腺下缘解剖显露肠系膜上静脉,建立胰腺后隧道(图3),沿十二指肠壁C环顺时针方向探查、解剖和游离胰头和十二指肠,切开后腹膜和Treitz韧带,离断空肠,将已离断的近端空肠经肠系膜上血管后方推向右侧,直线切割闭合器离断胃,用超声刀离断胰腺颈部,沿肠系膜上动脉逐步离断胰腺钩突,清扫肠系膜上动脉及胰腺上区淋巴结,最后离断胆管,标本切除完毕。经左侧腹直肌外缘戳孔行辅助小切口取出。消化道重建:胰肠吻合采用胰管对黏膜吻合,扩张胰管置入胰管支撑管(图4):确定胰管,置入胰管支架,予可吸收缝线围绕胰管行第1个荷包缝合,固定胰管支撑管于胰腺断端,针距胰管周缘约3 mm;不可吸收缝线缝合胰腺后缘与空肠浆肌层(胰腺断端进针),于空肠侧壁、胰管支撑管对应位置戳一小孔,沿小孔周缘3 mm全层缝合肠壁完成第2个荷包,使胰管支撑管进入肠腔,拉近空肠与胰腺断端,打结第2个荷包缝合线,不可吸收缝线间断缝合胰腺断端前壁与空肠浆肌层。距胰肠吻合口10 cm处予可吸收缝线间断全层缝合胆管与空肠。距胆肠吻合50 cm处上提空肠攀,利用直线切割闭合器行胃肠侧侧吻合,并予可吸收缝线浆肌层加强缝合,胰肠和胆肠吻合口后方各放置引流管1枚。
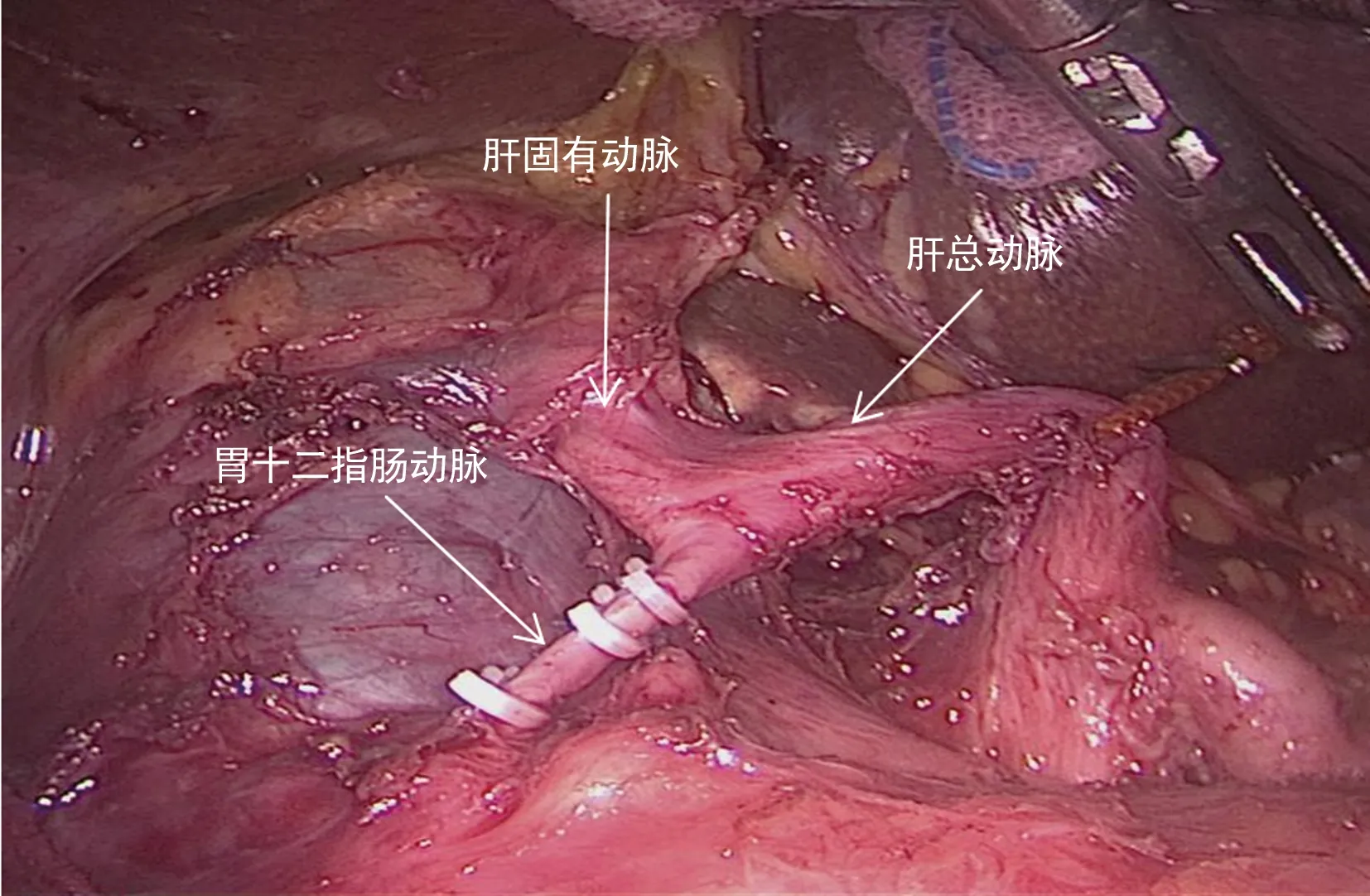
图1 游离肝总动脉及其分支
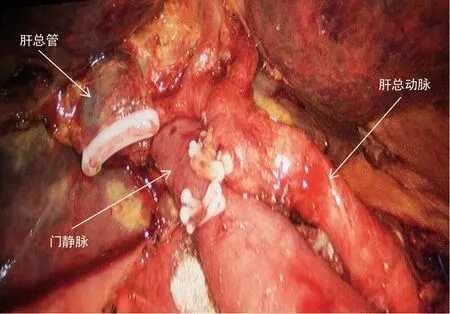
图2 裸化第一肝门
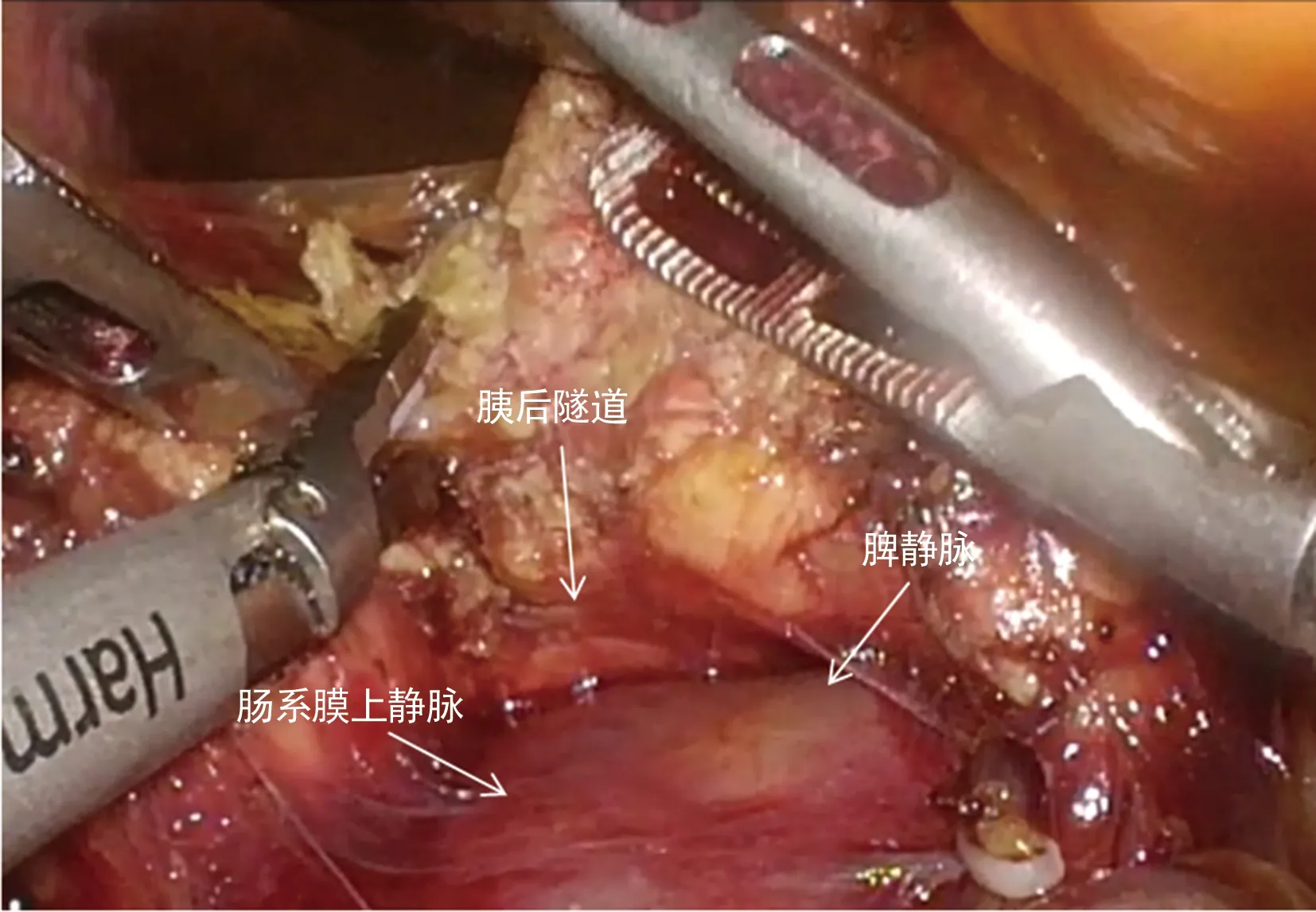
图3 建立LPD术中胰后隧道
2 结 果
50例患者均在全腹腔镜下完成胰十二指肠切除术,手术时间245~730 min,平均(459±103)min,术中出血量80~1 200 mL,平均(334±153)mL,术后住院时间7~75 d,平均(17±8)d。
术后并发症发生率22%(11/50):其中术后出血4例(胆囊床渗血1例、胃肠吻合口出血2例、后腹膜渗血1例(合并B级胰漏)),2例胃肠吻合口出血均发生于术后5 h内,主要表现为呕血,1例呕血量小,行胃镜检查未见明显搏动性出血,于渗血处钳夹止血,经保守治疗好转;1例呕血量较大,合并血凝块,考虑术后时间较短,腹腔无粘连,行腔镜止血。另2例出血时间均大于6 d,术后时间长,腹腔粘连重,选择行开腹止血)。术后胰漏6例(1例合并出血),按国际胰瘘研究小组(International Study Group of Pancreatic Fistula,ISGPF)提出的胰瘘诊断标准,其中生化瘘5例、B级1例(开腹止血后发生胰漏),无C级胰漏,6例胰漏患者经延长拔管时间或彩超引导下穿刺引流均康复出院;术后胃排空障碍1例,经延长禁食时间及促胃肠动力药物使用后恢复;术后淋巴瘘1例,经延长拔管时间、低脂饮食后痊愈。
术后病理结果回示十二指乳头腺癌20例,胰腺癌18例,胆总管下端癌8例,自身免疫性胰腺炎2例,慢性胰腺炎胰头假性囊肿1例,胰腺实性假乳头状瘤1例,术后淋巴结阳性6例,术后病理结果回示癌肿的46例患者中,38例患者糖类蛋白199(CA199)增高,R0切除患者占93.48%(43/46)。
术后43例患者获随访,随访时间1~24个月,截至随访末期,39例患者存活,其中 31例术后日常生活不受影响,6例患者感上腹部疼痛不适,疼痛时需服用止痛药,2例患者消化功能不良、伴腹泻纳差,其余4例患者生存时间2~15个月(4例术后淋巴结活检均为阳性)。
3 讨 论
腹腔镜胰十二指肠切除术自GAGNER于1994开展以来,经历了兴起、质疑、继续探索几个阶段,近年来由于腔镜器械的发展,大大加速了腔镜下止血、吻合的速度,但由于LPD技术难度大、手术切除范围广、消化道重建复杂、对术者及助手要求高,目前仅在一些大的胰腺诊疗中心开展。由于缺乏大样本量对照研究,LPD术的具体操作过程无统一标准,其中一些关键步骤仍存在争议。
3.1对于手术入路而言,目前主要存在如下几种方式:(1)kocher切口入路方式(经典胰十二指肠切除路径):此手术入路遵循探查、游离、切除的经典顺序及先易后难的原则,相对比较安全,但若肿瘤侵犯周围血管或肿块较大时,术中可能发生血管撕裂,导致大出血[5]。(2)动脉先行入路:此手术入路的优势为可在手术早期明确肠系膜上动脉是否存侵犯,判断手术是否可以根治切除,并能对起于肠系膜上动脉的变异肝右动脉进行保护及易于动脉周围淋巴结的清扫,其缺点在于此手术入路技术难度大,需要有较高的技术基础,难以推广及普及[6]。(3)勾突入路:此入路解剖基础为胰腺勾突完全位于肠系膜上静脉后方,其左侧缘极少超过肠系膜上动脉右侧缘[7],优点在于能完整切除勾突及相关淋巴、脂肪、纤维组织,提高R0切除率,降低术后复发。缺点在于解剖分离比较困难,发生血管损伤时出血难以控制,对术者腔镜操作技术要求较高[8]。(4)“G”形手术入路:此入路以胰头为中心,按照左上-右上-右下-左下-中心顺序切除,最后处理勾突部,手术过程解剖标志较多且明显,降低了手术难度,易于初学者掌握,缺点在于未明确血管是否受侵犯、可否能根治时即离断消化道,有时可使手术陷于被动[9]。(5)无接触技术入路:即先行离断汇入门静脉的胰头十二指肠区静脉,而后按常规步骤移除标本。此手术入路优点在于降低了在手术过程中因挤压使癌肿细胞通过门静脉远处转移的风险。缺点是术中游离血管复杂,手术时间明显延长,由于不能同常规入路那样牵拉及抬起胰头,血管损伤时出血亦难以控制[10]。本组50例患者中,均未单一采取某种手术入路,而是根据患者术前肿瘤大小、位置、血管情况及术中探查个体化选择,先易后难。在早期开展LPD 时,病例选择大多为胆总管下段及十二指肠乳头肿瘤、无血管侵犯,多采用kocher切口入路及“G”形手术入路相结合。
3.2在消化道离断重建中,也有一些争议:
3.2.1是否保留幽门 一部分学者认为,保留幽门的胰十二指肠切除术能够避免消化液的返流,降低倾倒综合征、吻合口溃疡及出血的发生率,提高患者术后营养状态及生活质量[11],但术前应准确评估肿瘤是否浸润幽门下5 cm内的十二指肠,术中快速冰冻提示十二指肠切缘及幽门淋巴结阴性,则保留幽门不增加术后复发的风险,并且认为胰头癌的预后与胰腺系膜切缘是否阴性及区域淋巴结是否转移有关,与是否保留幽门无确切关系[12]。不支持者则认为术中结扎切断胃右动脉及可能的迷走神经幽门支的损伤,会导致幽门部的功能障碍,保留幽门会增加术后胃排空障碍及胃潴留的发生率,延长住院时间[13],若通过保留胃右动脉来保护迷走神经幽门支,则可能导致幽门周围结缔组织中肿瘤细胞的残留。本组50例患者中,无1例保留幽门,主要出于以下几方面考虑:(1)保留幽门需对幽门周围血管神经进行仔细保护,且吻合不宜使用吻合器,增加了手术难度,延长了手术时间,初学者不宜使用。(2)保留幽门增加了术后胃潴留的风险。(3)尽管有报道认为胰头癌的预后与胰腺系膜切缘是否阴性及区域淋巴结是否转移有关,与是否保留幽门无确切关系,但尚无大宗病例报告及长期随访治疗资料,若有肿瘤细胞残留会降低术后生存率。故本组患者全都采用了不保留幽门的胰十二指肠切除术。
3.2.2胰腺空肠吻合的方式 目前胰肠吻合大多建议采用胰管对空肠黏膜吻合,但具体吻合方式及是否留置支撑管有所争议,较多采用的有洪氏一针法[14]、植入式胰管空肠吻合[15]、双荷包缝合法[16]、胰胃吻合等。本组病例中,大多采用双荷包缝合法,胰管支撑采用适于胰管大小的硅胶管,硅胶管置入胰管末端后向前退0.5~1.0 cm,胰腺断端外露约2~4 cm,术后胰瘘发生率为12%(6/50),主要因为双荷包缝合法对胰管要求不高,能确切的将胰管支撑管固定于肠壁及胰管,保证胰肠吻合的可靠性与通畅性。
本组50患者均成功完成了全腹腔镜胰十二指肠切除术,无1例死亡病例,并发症与开腹胰十二指肠切除术相比,无明显区别,故LPD是安全可行的。鉴于LPD创伤小、恢复快、视野清晰等优点,值得临床推广应用,但由于样本量小、随访时间短,远期疗效有待样本量的积累及随访量的增加。

