上皮间质转化与卵巢癌细胞顺铂耐药的相关研究*
张为家,苏小岩,李 爽,曾 海,2△
(1.长江大学附属第一医院肿瘤科,湖北荆州 434000;2.武汉大学中南医院肿瘤放化疗科,武汉 430071)
卵巢癌发病率居女性生殖系统恶性肿瘤第三位,病死率高居第一位,全球每年因卵巢癌死亡的患者约14万[1]。卵巢癌起病隐匿、早期症状不典型,使得多数卵巢癌患者确诊时已为晚期,手术难以彻底清除肿瘤病灶。以铂类药物为基础的联合化疗是晚期卵巢癌的一线治疗方式,然而多数患者在化疗过程中产生耐药,导致肿瘤复发转移,这是卵巢癌治疗失败的重要原因之一[2-3]。因此,探索卵巢癌顺铂耐药的分子机制成为卵巢癌研究的难点与热点。
上皮间质转化(EMT)是指上皮细胞在内外因素刺激下转化为具有间充质表型的生物学过程。最新研究表明,EMT与肿瘤转移、肿瘤干细胞形成及肿瘤耐药等多种恶性生物学行为密切相关[4-5]。目前,关于卵巢癌顺铂耐药与EMT之间的关系研究较少。本研究建立卵巢癌顺铂耐药细胞株,比较耐药细胞和亲本细胞表型差异;另外体外诱导卵巢癌细胞发生EMT,观察对顺铂化疗敏感性的影响,以期探讨EMT与卵巢癌细胞顺铂化疗耐药间的关系,为阐明卵巢癌顺铂耐药提供新的研究思路。
1 材料与方法
1.1细胞及试剂 人卵巢癌细胞株A2780、OVCAR3购自中国科学院上海细胞生物所;新型甲胺化合物(MTS)、顺铂及转化生长因子β(TGF-β)购自美国Sigma公司;RPMI 1640培养基和胎牛血清购自广州英韦创津公司;Transwell小室购自美国Millipore公司;鼠抗人E-cadherin、vimentin、免疫荧光标记二抗和羊抗鼠IgG-HRP二抗购自美国Cell Signaling公司。
1.2方法
1.2.1细胞培养及顺铂耐药细胞株的建立 A2780、OVCAR3细胞用含10%胎牛血清,100 U/mL青霉素和0.1 mg/mL链霉素的RPMI1640培养基于37 ℃ 5% CO2的培养箱中培养。通过顺铂间歇诱导和大剂量冲击相结合的方法建立顺铂耐药的人卵巢癌细胞株A2780/DDP、OVCAR3/DDP[6]。耐药细胞培养液中加入终浓度为5 μmol/L顺铂维持耐药表型,撤药培养1周后进行实验。
1.2.2MTS实验 将处于对数生长期的细胞按每孔3 000个接种到96 孔板,待培养细胞贴壁后加入浓度为0.1、1.0、10.0、20.0、40.0、80.0及100.0 μmol/L的顺铂。培养72 h后加入MTS (5 g/L)每孔20 μL,孵育2 h,于酶标仪上测定波长490 nm吸光度值(A490)。每孔重复3次。由A值计算出各药物浓度处理组的生存率,依据药物浓度与其生存率绘制量效曲线图。
1.2.3Transwell细胞迁移实验 在Transwell的聚偏氟乙烯(PVDF)膜的外表面涂一层fibronectin (10 μg/mL,50 μL) , 37 ℃孵育2 h后放入每孔加有600 μL培养基的24孔板内,在Transwell的内室加入细胞浓度为2×105个/mL细胞悬液200 μL,于37 ℃培养箱孵育48 h,取出Transwell小室,用棉签擦去内室面未迁移细胞,4.0%甲醛固定,0.1%结晶紫染色后在显微镜下挑取10个高倍视野计数,重复3次。
1.2.4Transwell细胞侵袭实验 将基质胶铺于小室底部,小室下层加入含10%FBS的RPMI 1640培养液500 μL,上层加入无血清的RPMI 1640培养液100 μL。制备细胞悬液,上室加入细胞浓度为2×105个/mL细胞悬液200 μL,培养48 h,染色和计数方法同迁移实验。
1.2.5Western blot检测 取生长状态良好的细胞,用预冷的PBS漂洗3次,加入含cocktail蛋白酶抑制剂的RAPI蛋白裂解液冰上裂解30 min;吸取裂解混合液离心取上清液即为细胞总蛋白。测定总蛋白浓度后按每孔50 μg进行10%十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离蛋白,电转移至PVDF膜后以5%脱脂奶粉室温封闭2 h;加入稀释后的一抗 4 ℃孵育过夜,PBST洗涤后加HRP标记的二抗室温孵育1 h,ECL底物显色。
1.2.6免疫荧光检测 制备细胞爬片,以4.0%冷的多聚甲醛室温固定30 min,0.1%曲拉通透化2~5 min,2.0% BSA室温封闭60 min。加入稀释的E-cadherin单克隆抗体4 ℃孵育过夜,加入稀释的荧光标记二抗于37 ℃孵育1 h。5 μg/mL DAPI染色2 min,抗淬灭封片剂封片,于荧光显微镜下观察,拍照。
1.2.7TGF-β体外诱导 用5 ng/mL TGF-β体外诱导卵巢癌细胞A2780发生48 h后EMT改变,检测细胞迁移、侵袭能力及EMT标记物表达以验证EMT表型。

2 结 果
2.1卵巢癌细胞顺铂耐药的鉴定 MTS结果显示,A2780/DDP的IC50值为(71.86±6.52)μmol/L,A2780的IC50值(7.50±0.98) μmol/L,IC50值升高9.58倍(χ2=15.495,P<0.01);OVCAR3/DDP、OVCAR3的IC50值分别为(61.75±7.28)、 (4.68±1.18) μmol/L,IC50值升高13.19倍(χ2=19.318,P<0.01)。
2.2卵巢癌细胞顺铂耐药形态学观察及迁移、侵袭能力检测 A2780/DDP、OVCAR3/DDP发生了形态学改变,具有间充质细胞形态学特点,细胞变得狭长、呈纺锤形、伸出伪足、细胞之间疏散,见图1。Transwell细胞迁移、侵袭实验结果显示A2780/DDP、OVCAR3/DDP细胞迁移及侵袭能力均明显高于亲本细胞A2780、 OVCAR3,见图2。
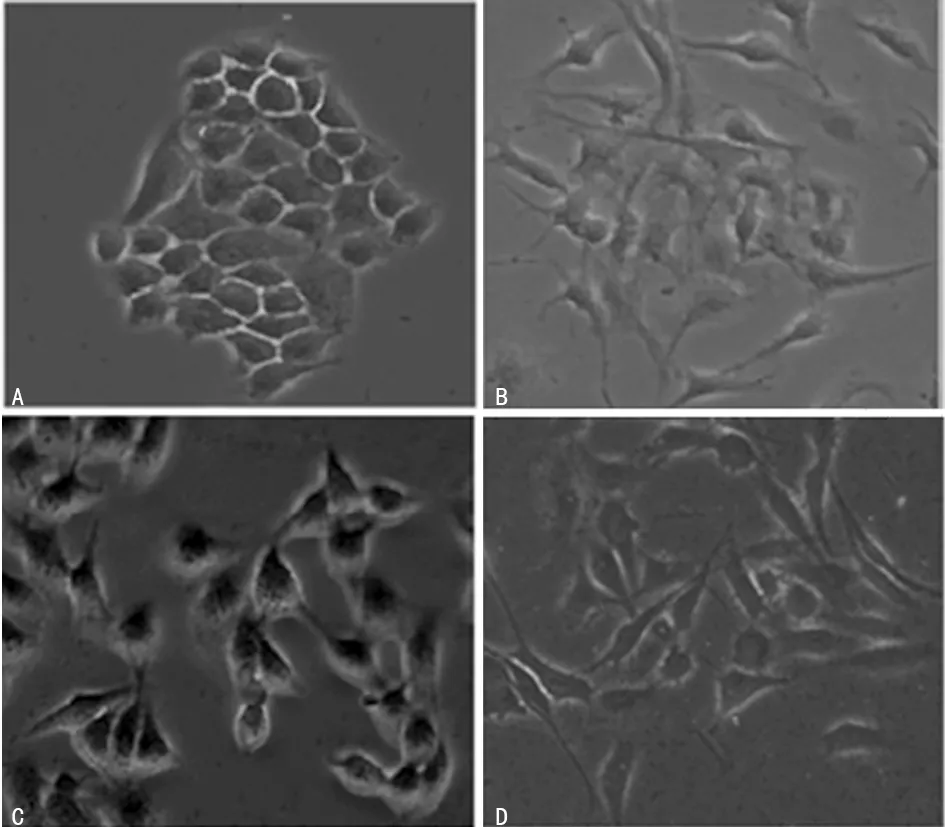
A:A2780;B:A2780/DDP;C:OVCAR3;D:OVCAR3/DDP
图1 卵巢癌亲本细胞及耐药细胞形态学差异(×200)
2.3卵巢癌亲本细胞与顺铂耐药细胞EMT标记物E-cadherin、Vimentin表达 A2780/DDP、OVCAR3/DDP中上皮分子标志物E-cadherin表达缺失,而间充质分子标志物Vimentin表达明显上调,见图3。亲本细胞A2780、OVCAR3中E-cadherin位于细胞膜,表达量高;耐药细胞A2780/DDP、OVCAR3/DDP细胞膜上未见E-cadherin的表达,见图4。

图2 卵巢癌亲本细胞及耐药细胞迁移和侵袭能力比较

图3 卵巢癌亲本细胞及耐药细胞中E-cadherin和
2.4TGF-β体外诱导对卵巢癌细胞的影响 TGF-β处理的A2780细胞迁移、侵袭能力明显高于对照组,且E-cadherin蛋白表达下调、Vimentin蛋白表达上调。MTS结果显示,TGF-β体外诱导卵巢癌细胞A2780发生EMT改变后,细胞的IC50值由(7.50±0.68) μmol/L上升为(37.56±3.28) μmol/L,差异有统计学意义(χ2=7.956,P<0.01),见图5。

图4 卵巢癌亲本细胞及顺铂耐药细胞中E-cadherin的表达及定位(×400)

A:细胞形态学改变(×200);B:Western blot检测E-cadherin和Vimentin蛋白的表达;C:Transwell迁移及侵袭实验;Con:PBS处理对照组;TGF-β:TGF-β处理组
图5 TGF-β体外诱导对卵巢癌细胞的影响
3 讨 论
铂类为主的联合化疗治疗卵巢癌患者的首次有效率为70%~80%,但80%以上患者2~3年后对铂类产生继发性耐药[7]。耐药细胞具有更强的侵袭转移特性,晚期卵巢癌患者常死于铂类耐药后的广泛转移,使其5年生存率仅为46%左右[8]。寻找卵巢癌铂类化疗耐药的机制一直是肿瘤学界研究的热点。越来越多的证据表明,EMT是将肿瘤转移与耐药联系起来的关键因素,而抑制肿瘤细胞EMT或可同时抑制肿瘤细胞的耐药与侵袭能力[9-11]。但目前尚缺乏EMT参与卵巢癌铂类耐药的研究证据。
EMT 是指在特定生理病理条件下,上皮细胞失去极性,转化成间质细胞,并获得侵袭和迁移能力的过程[12]。研究发现,EMT与多种恶性肿瘤如乳腺癌、卵巢癌、结肠癌和食管癌等的发生、发展密切相关,EMT成为近年来抗肿瘤研究领域的热点之一[13-14]。E-cadherin的表达减少是EMT发生的重要标志,可导致肿瘤细胞间黏附能力降低,迁移活动能力增强,在肿瘤侵袭转移中发挥重要作用[15]。Vimentin是间质细胞的重要标记物之一,可使细胞黏着斑的空间结构发生改变,增加肿瘤细胞的黏附与迁移能力[16]。本研究显示,A2780/DDP、OVCAR3/DDP细胞形态发生长梭形改变;进一步检测发现E-cadherin的表达明显下调,而Vimentin的表达明显上调;Transwell细胞迁移、侵袭实验进一步证实了耐药细胞的侵袭能力明显增加。上述研究结果符合EMT 过程中的分子生物学特征。为进一步明确EMT与卵巢癌细胞顺铂耐药的关系,本实验从反方面以TGF-β诱导处理卵巢癌细胞发生EMT后,检测出对顺铂的生长抑制作用明显降低。以上研究结果高度提示EMT可能为卵巢癌顺铂耐药监测及逆转顺铂耐药的潜在靶点。
目前有研究发现,顺铂耐药的非小细胞肺癌获得典型的EMT表型,细胞膜蛋白E-cadherin表达缺失、Vimentin的表达增加,细胞侵袭转移能力增加[17]。有报道顺铂耐药的胃癌细胞通过CIP2A/PP2A/AKT信号轴发生EMT改变,另外报道顺铂耐药的头颈部肿瘤细胞获得典型的EMT 特征,CD44分子通过microRNA-200c/ZEB-1参与其调节[18-19]。以上研究提示EMT 与多种上皮源性肿瘤细胞对顺铂化疗耐药密切相关,EMT能否成为临床铂类耐药的有效预测分子,有待更多其他类型肿瘤及临床组织病理学验证。多种信号转导通路参与EMT的发生,与TGF-β、Wnt/β-catenin、 zeb-1/Snail/Slug/Twist转录因子,MiRNA及LncRNA调控机制、微环境等因素有关[20-21]。本研究中卵巢癌细胞顺铂耐药发生EMT的信号调控机制尚有待进一步深入研究。
综上所述,本研究从卵巢癌顺铂耐药细胞株发生EMT改变与诱导卵巢癌细胞发生EMT对化疗敏感性降低两个角度证实了EMT与卵巢癌顺铂耐药密切相关,为未来监测卵巢癌顺铂耐药、逆转耐药的治疗提供新的研究策略。

