恶性黑色素瘤化疗研究进展
秦岚群 邹征云
恶性黑色素瘤主要由产生黑色素的神经鞘细胞发生突变,导致酪氨酸代谢和黑色素生成异常所引起。在靶向免疫治疗用于恶性黑色素瘤之前,晚期患者治疗手段有限且预后极差,中位生存期仅6~9个月,1年生存率仅25%[1]。自2011年起,随着用于黑色素瘤免疫、靶向治疗药物的不断获批,晚期黑色素瘤的治疗取得了突破性的进展;但是对于经济情况不佳、BRAF野生型、靶向治疗失效的患者,化疗仍是不可摒弃的治疗手段。
1 单药化疗
1.1 烷化剂
达卡巴嗪(Dacarbazine,DTIC)自1975年被FDA批准入市后,成为近40年来恶性黑色素瘤化疗的唯一标准药物。它通过将烷基基团引入鸟嘌呤碱而破坏DNA,抑制细胞分裂,进而导致细胞死亡。静脉给药后,DTIC经肝分解为5-(3-甲基三嗪-1-基)咪唑-4-酰胺(MTIC),然后再分解为活性代谢物二氮甲胺作用。DTIC在大多数新药的临床试验中被作为参照组,并且多项Ш期随机临床试验显示DTIC单药客观缓解率(Objective response rate,ORR)平均15%,中位生存时间5.6~11个月[2-4]。
替莫唑胺(Temozolomide,TMZ)与DTIC结构相似,在体内生理pH下亦转化为MTIC作用,与DTIC不同的是,它不需要经过肝脏代谢。TMZ可穿透血脑屏障,在脑脊液中的浓度是血浆中浓度的28%~30%,是NCCN指南黑色素瘤脑转移推荐用药。Middleton等[3]研究DTIC或TMZ治疗转移性黑色素瘤的Ⅲ期临床研究发现,TMZ组患者无进展生存期(Progression-free survival,PFS)和总生存期(Overall survival,OS)均稍高于DTIC组;Teimouri等[5]对1314例晚期黑色素瘤患者的Meta分析显示,除了TMZ是口服制剂,方便使用外,DTIC和TMZ在疗效和副作用方面差别不大,但是由于TMZ价格较贵,且淋巴细胞减少症发生率增加,建议DTIC作为化疗首选药物。
1.2 亚硝脲类
亚硝脲类代表药物有福莫司汀(Fotemustine,Fote)、卡莫司汀(BCNU)、洛莫司汀(CCNU)等。亚硝脲类具有较强的亲脂性,易通过血脑屏障进入脑脊液中,总体而言与DTIC有相似的有效率,但其临床应用受限于严重的副作用,尤其是骨髓抑制。Avril等对比DTIC和Fote治疗转移性恶性黑色素瘤的效果,发现虽然Fote组患者ORR显著增高(15.2%vs. 6.8%,P=0.043),却出现了延迟性骨髓抑制,3/4级血细胞减少发生率超过40%;然而对于那些入组时没有脑转移的患者来说,Fote组患者肿瘤转移至中枢神经系统的风险更小,并且开始发生转移的时间也明显长于DTIC组(22.7月vs. 7.2月,P=0.059)[4]。因此,福莫司汀已经在一些欧洲监管机构获批,成为欧洲恶性黑色素瘤脑转移一线化疗药物。
1.3 铂类
铂类化合物顺铂和卡铂已经在许多黑色素瘤的临床试验中进行了研究,这两种药物单药化疗有效率相似,从0%到大于50%的都有报道,大多数试验集中在15%~20%,且有效持续时间短[2]。虽然铂类药物对黑色素瘤有一定疗效,但其单药化疗活性不足,仍需要与其他化疗药物或者与免疫治疗联合。
1.4 紫杉类
紫杉类复合物包括紫杉醇和多西紫杉醇,是新型抗微管药物。传统溶剂型紫杉醇注射后,由于受困于蓖麻油胶束中,限制了其生物利用度,且过敏反应发生率高,使用不便,其单药有效率在12%~30%。多西紫杉醇在体外实验显示抗肿瘤活性较紫杉醇高,过敏发生较紫杉醇低。
白蛋白结合型紫杉醇(Nab-paclitaxel)是采用纳米技术,将药物与人血白蛋白结合形成直径为130 nm的颗粒。它在体内以白蛋白和紫杉醇的形式(约95%)运输,增加其生物利用度,并且能快速达到血浆浓度,快速分布到肿瘤组织并长期滞留。此外,它还能与血管内皮及肿瘤组织中的白蛋白受体结合,具有肿瘤靶向性[6]。Ibrahim等[7]进行Ⅰ期试验显示此药可以使肿瘤体积缩小,还能使乳酸脱氢酶(Lactic dehydrogenase,LDH)值下降,说明对恶性黑色素瘤治疗有效。Hersh等[8]评估白蛋白紫杉醇(ABRAXANE)对照DTIC在初治Ⅳ期转移性黑色素瘤患者的疗效显示,白蛋白紫杉醇明显提高了中位PFS(4.8月vs. 2.5月,P=0.044),但OS无统计学差异(12.6月vs. 10.5月,P=0.271)。
2 联合化疗
常见的联合化疗方案有BOLD方案(博来霉素+长春新碱+洛莫司汀+达卡巴嗪)、CVD方案(顺铂+长春碱+达卡巴嗪)、Dartmouth方案(达卡巴嗪+顺铂+卡莫司汀+三苯氧胺)等,但是这些方案毒性大,疗效未见明确优势,故临床上仅推荐作为二线治疗方案。近期一例个案报道示,对使用DTIC为一线治疗失败的黑色素瘤患者,以紫杉醇联合卡铂作为二线治疗,患者达到完全缓解(Complete response,CR)[9]。在这之前,也有Ⅱ期试验评估多西紫杉醇和卡铂联合对于一线治疗失败的晚期黑色素瘤患者疗效,结果提示该方案可作为二线治疗方案,治疗中有一例患者亦达到CR[10]。
一项Ⅱ期临床试验卡铂联合白蛋白紫杉醇治疗Ⅳ期黑色素瘤患者,结果显示化疗初治患者有效率为25.6%,原先已接受化疗患者有效率为8.8%,但由于双药联合,骨髓抑制、神经病变等毒副作用也随之增加[11]。也有人将该方案应用于中国人群,结果表明方案可耐受且有效,并且OS和PFS与化疗是否初治无关,与恶性黑色素瘤分型无关[12]。有关常见化疗方案的详细比较见表1。
3 化疗联合生物免疫治疗
化疗与免疫治疗之间存在相互作用,一方面化疗可通过诱导提高肿瘤细胞的免疫原性、下调抑制性T细胞活性来增强免疫效应,另一方面又可通过淋巴细胞杀伤作用抑制免疫反应;免疫疗法可通过在抗原释放前增强和激活免疫反应、扩增识别抗原的活化T细胞来增强化疗疗效[13]。常见的免疫联合制剂为INF-α和IL-2,这些制剂与化疗药物以各种形式组合,虽然一定程度提高了有效率,但不良反应也显著增加,从而限制了其临床应用。1996—2001年间多项Ⅱ期临床试验显示生物化疗有效率从37%~64%不等,1997—2001年间多项Ш期临床试验显示以DTIC为基础的生物化疗,有效率提高5.5%~23%,OS提高0.5~4.9个月[14]。多项临床试验比较CVD+IL-2+IFN-α方案与CVD方案、高剂量干扰素方案在疗效和副作用方面的差别,提示生物化疗一定程度上能提高有效率,改善PFS,但对于总生存率而言无肯定依据证实获益,此外还显著增加了不良反应的发生率[15-17]。也有研究将CVD方案中的长春花碱更改为白蛋白紫杉醇治疗晚期黑色素瘤患者,发现虽然白蛋白紫杉醇可以替代长春花碱引起颅外转移患者的应答,但是这种联合方案对于肝脏、骨髓和胃肠道有着强烈毒性,故也不推荐使用[18]。
随着伊匹单抗(Ipilimumab)、派姆单抗(Pembrolizumab)的出现,化疗联合免疫疗法发挥协同作用也是可能的。这两类药物均属于免疫检查点抑制剂,伊匹单抗通过阻断细胞毒性T淋巴细胞相关抗原(CTLA-4)以增强抗肿瘤免疫反应,派姆单抗通过阻断PD-1/PD-L1的信号传输,增强T细胞的活力进而杀死肿瘤细胞[19]。分别有临床试验将伊匹单抗与DTIC和TMZ联合,发现联合方案效果更佳且毒性可控[20-22],但也有研究认为此方案对日本人群并不能耐受,因其强烈的肝脏毒性[23],因而此联合方案对于亚洲乃至中国人群是否耐受还有待考究。还有个案报道显示在DTIC使用后,粘膜黑色素瘤患者脑转移灶中CD8+T细胞浸润显著增多,而CD8+T细胞浸润增多通常被认为与较好的PD-1单抗疗效有关,虽然此例患者后续使用PD-1单抗后最终疾病进展[24]。
4 化疗联合靶向治疗
靶向治疗是近年来治疗晚期恶性黑色素瘤的重大进展,包括BRAF抑制剂、MEK抑制剂以及抗血管生成药物等。常见的抗血管生成药物有贝伐珠单抗和恩度等,其作用机理为通过抑制血管的内皮细胞迁移来抑制肿瘤新生血管的生成,阻断肿瘤细胞的营养供给,达到抑制肿瘤增殖或转移的目的。国外很多试验联合化疗与贝伐珠单抗治疗初治或转移性恶性黑色素瘤,均获得较好的治疗效果[25-27]。在国内,2013年Cui等[28]通过比较DTIC联合恩度或安慰剂治疗恶性黑色素瘤患者的数据,发现恩度+DTIC组较安慰剂+DTIC组ORR显著提高(8.9%vs. 3.7%,P=0.0464),联合组的患者PFS和OS均优于安慰剂组,提示DTIC联合恩度可提高恶性黑色素瘤疗效,据此研究,DTIC联合恩度被写进中国黑色素瘤诊治指南,作为一线治疗被推广。
BRAF基因的突变与黑色素瘤的发生发展密切相关,白种人中约一半的转移性黑色素瘤具有细胞内BRAF基因突变[29],中国黑色素瘤中BRAF基因变异率也超过25%[30]。目前,BRAF抑制剂和MEK抑制剂对于BRAF突变的患者治疗效果显著,近年来研究也显示,化疗与此类药物联合能进一步增强疗效。Robert等[31]比较Selumetinib联合DTIC和DTIC单药化疗治疗BRAF突变的转移性恶性黑色素瘤,结果显示联合组显著提高了PFS(5.6月vs. 3.0月),而OS无明显证据显示提升。Queirolo等[32]用福莫司汀联合维莫非尼作为二线治疗维莫非尼耐药的恶性黑色素瘤结果示OS为15.4个月,其中完全缓解1例,部分缓解(Partial response,PR)4例。但是由于靶向治疗和免疫检查点抑制剂治疗疗效显著,有关化疗与此类药物联合的研究甚少,是否能发挥协同作用还需要进一步研究证实。近五年来,虽然有关免疫和靶向治疗研究十分火热,但仍不断有研究将新药或新治疗方案与化疗联合(表2),说明仍然是化疗不可或缺的存在。
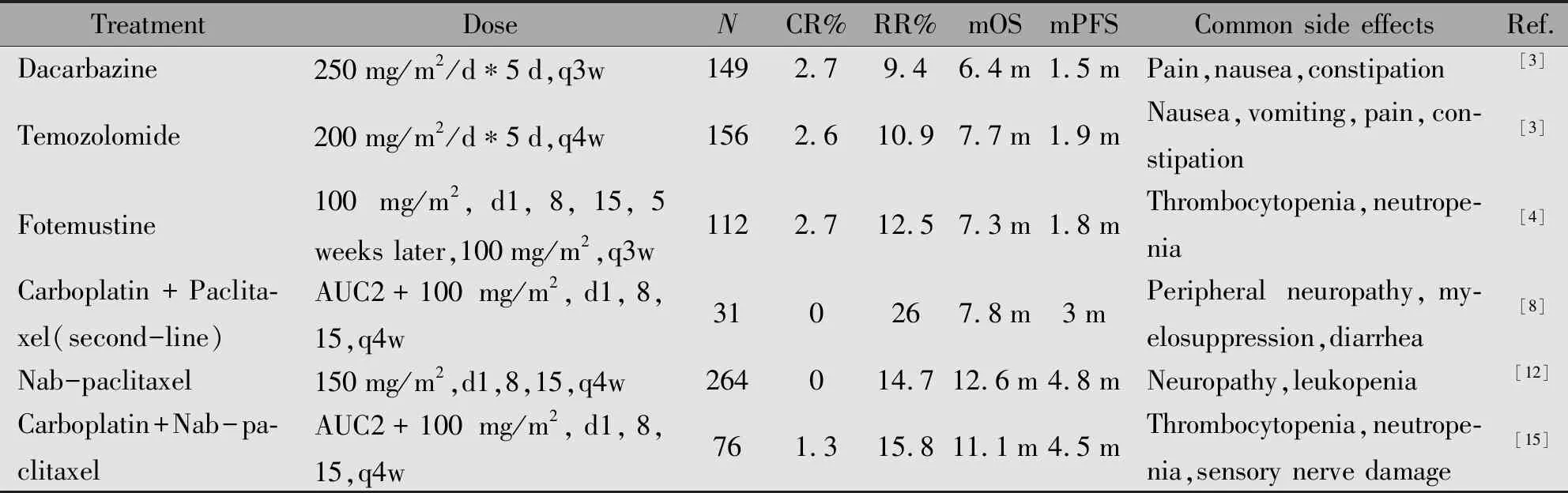
表1 常见化疗方案疗效比较Table 1 Summary of curative effect on common chemotherapy regimens
Note:AUC.Area under the Curve[Carboplatin dose(mg)=AUC(mg/mL/min)*Creatinine clearance rate+25];N.Number treated in key trials;ORR.Objective response rate;mOS.Median overall survival;mPFS.Median progression-free survival.
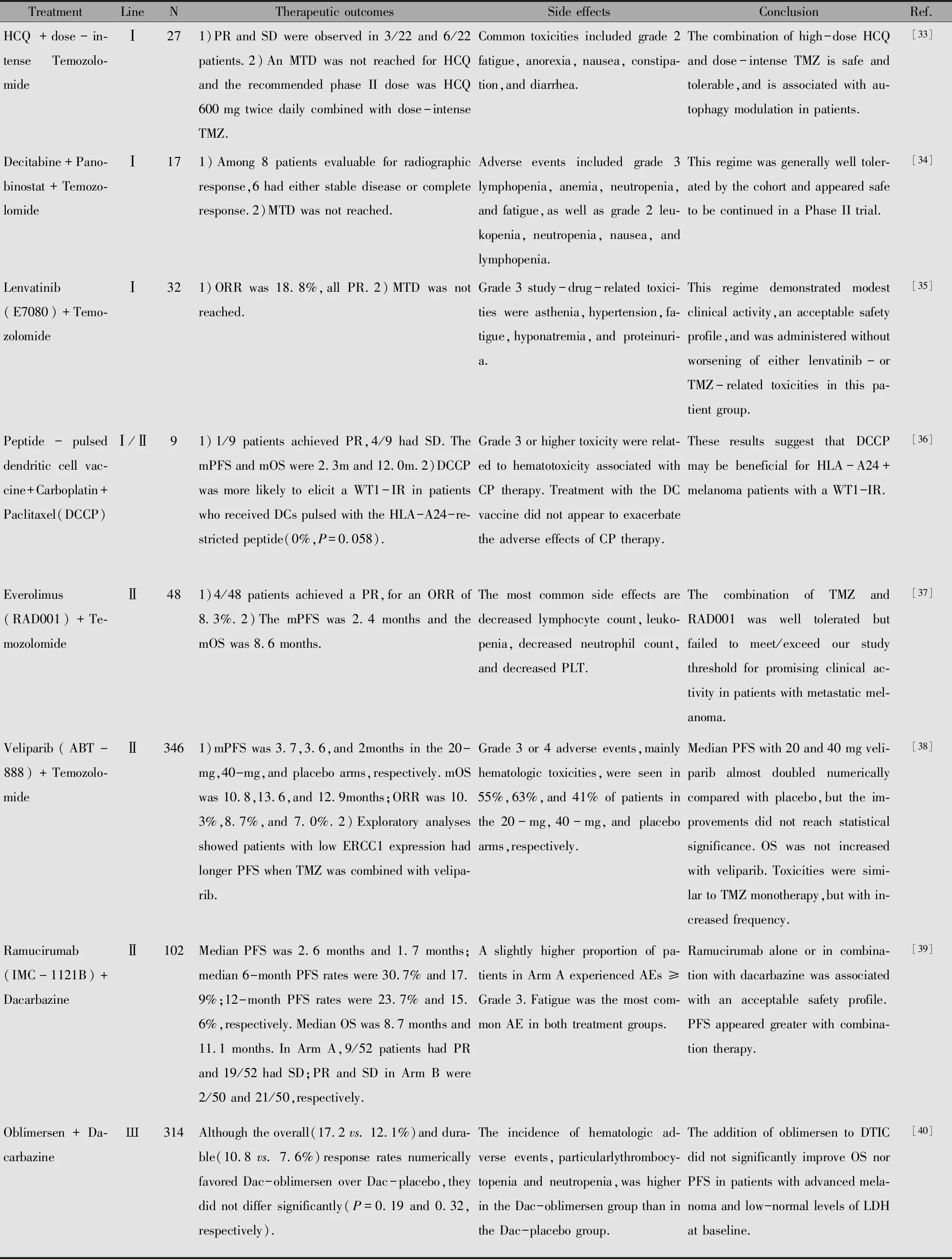
表2 近5年来化疗与其他治疗联合的新尝试Table 2 New combination of chemotherapy and other treatments in the last five years
Note:WT1-IR:WT1-specific immune response;DC:Dendritic Cell;CR:Complete respomse;PR:Partial response;SD:Stable disease;LDH:lactate dehydrogenase;MTD:maximal tolerated dose;HCQ:hydroxychloroquine;AEs:Adverse effects;ORR:Objective response rate.
5 小结与展望
黑色素瘤恶性程度高,易发生早期转移,预后极差。近年来,随着免疫和靶向治疗研究的进展,患者预后得到了极大的改善,但是对于不适合靶向和免疫治疗的,或者这两种治疗失败的晚期患者来说,化疗成了他们最后的治疗手段。化疗是否能与靶向、免疫治疗发挥协同作用也需要更多临床研究来证实。此外,中国黑色素瘤以肢端及粘膜黑色素瘤为主,国外研究所得的结论能否适用于中国患者,需要来自中国恶性黑色素瘤患者的大样本临床研究数据来支撑。

