肺癌完全性切除术对患者外周血中Th17/Treg细胞平衡的影响
赵 苏 郑晓瑜 朱开彬 卜建龙 徐世东
肺癌是当前全世界最常见的肿瘤,每年导致超过140万人死亡[1]。肺癌完全性切除术是目前治疗肺癌的主要方式,但手术本身却可能会促进肿瘤的复发转移[2]。主要原因是手术创伤会干扰机体免疫功能,抑制术后适应性免疫反应和抗肿瘤免疫[3]。而CD4+T细胞亚群分化失衡在适应性免疫功能失调中起主要作用[4]。因此,探讨手术创伤后CD4+T细胞亚群的变化至关重要,有助于找到有效的治疗策略来改善手术创伤后免疫抑制。
初始CD4+T细胞与抗原作用后会增殖分化为不同的CD4+T细胞亚群[5]。CD4+T细胞亚群主要包括Th1和Th2[6]。新近研究表明,Th细胞也可转化为Th17和调节性T细胞(Treg),Th17细胞主要诱导正向免疫应答,而Treg则主要抑制免疫效应[7]。以往研究表明手术创伤可以诱导Th1/Th2平衡向Th2漂移[8]。新近研究发现手术创伤后Th17/Treg细胞也会失衡[5,9]。然而,肺癌完全性切除术后患者Th17/Treg平衡的改变尚未完全阐明。因此本研究旨在探讨肺癌完全性切除术对肺癌患者外周血中Th17/Treg平衡的影响。
1 资料和方法
1.1 病例资料
研究程序经哈尔滨医科大学附属肿瘤医院伦理委员会批准。本实验研究对象为21例病理确诊为肺癌并即将接受肺癌完全性切除术的患者(均为我院2016年1月—2018年1月收治入院的患者)和21名健康对照者。所有患者均接受肺癌完全性切除术,进行肺叶(全肺)切除及淋巴结清扫术。手术方式均为常规开胸手术。研究分为三组,健康对照组(Control)、手术患者术前组(Day 0)和手术患者术后三天组(Day 3)。患者手术前必须未接受化疗和放疗。患有自身免疫性疾病或病毒感染的患者被排除在研究之外。患者和健康对照者的一般资料详见表1。

表1 肺癌完全性切除术患者和健康对照者一般资料的比较Table 1 Correlation between patients underwent lung cancer resection and healthy controls
Note:ASA.American society of anesthesiologists.
1.2 标本收集
手术患者在术前(Day0)和术后三天(Day3)清晨,空腹采集肘静脉血各8 mL,分装在EDTA-2K抗凝管中,一管6 mL用于流式细胞和RT-PCR检测,另一管2 mL离心后取血清,保存于-80℃冰箱,用于ELISA检测细胞因子。健康对照组(不接受手术)随机清晨空腹采集肘静脉血,标本收集储存方法同前。
1.3 外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs)的分离
取一15 mL离心管,加入2 mL已用抗凝剂处理过的人血液样品,再加入2 mL PBS进行稀释,上下颠倒混匀样品,备用;取一新的无菌15 mL离心管,加入3 mL淋巴细胞分离液,然后将稀释好的4 mL抗凝血标本小心地沿离心管壁缓慢加入淋巴细胞分离液上,保持分离液与标本界面清晰;将离心管垂直放入离心机内,18~20℃,1 000 g离心30 min;小心取出离心管,此时,液体分三层:最上层为血浆,下层为红细胞,中间层为分离液层,位于中层靠近血浆层的白膜层即为单个核细胞层,小心吸走血浆层,不要打动白膜层;用弯头滴管插入白膜层,小心吸取单个核细胞;将白膜层细胞吸入另一离心管中,加入无菌PBS重悬,400 g离心10~15 min;重复洗涤细胞两次;末次离心后,弃上清,加入含10%胎牛血清的RPMI 1640重悬细胞,显微镜下用细胞计数板计数,将细胞浓度调整至2~4×106/mL。
1.4 流式细胞术检测PBMC中的Th17细胞
向PBMC管中加入1 μL莫能霉素和1 μL细胞刺激混合液,混匀后置于37℃,5%CO2培养箱培养4 h。向PBMC管中加入FITC标记的CD4单克隆抗体,室温下避光孵育30 min。PBS洗涤两次,弃上清,加入固定剂300 μL,室温下避光固定30 min。固定后洗涤两次,弃上清,再加入100 μL破膜剂,加入20 μL PE-IL-17单克隆抗体,室温下避光孵育15~20 min。最后再加入500 μL PBS洗涤一次,用300 μL 1%浓度的甲醛固定细胞,放在4℃环境中,等待用流式细胞仪检测。
1.5 流式细胞术检测PBMC中的Treg细胞
向PBMC管中加入100 μL BD Pharmingen Stain Buffer(554656)混悬细胞,再加入FITC标记的CD4单克隆抗体以及APC-cy7标记的CD25单克隆抗体,室温下避光孵育30 min。用无菌PBS洗涤两次,弃上清,加入固定剂(IFP)100 μL,室温下避光固定4 h。固定后洗涤两次,弃上清,加入破膜剂100 μL,加入PE-FOXP3单克隆抗体,室温下避光孵育15~20 min。最后再加入500 μL PBS洗涤一次,用300 μL 1%浓度的甲醛固定细胞,放在4℃,等待用流式细胞仪检测。
1.6 RT-PCR检测PBMC中RORγt和Foxp3基因的mRNA水平
使用Omega公司的RNA提取试剂盒提取总RNA,用Real-Time PCR试剂盒进行逆转录得到cDNA。RORγt上游引物序列:5′-AATCTCATCCTCGGAAAAGTG-3′,下游引物序列:5′-TCTCAAAGCAGGAGCAATGGA-3′;Foxp3上游引物序列:5′-TGGAGGAACTCTGGGAATGTG-3′,下游引物序列:5′-GGTGCTGGAGAAGGAGAAGCT-3′;以GAPDH为内参,上游引物序列:5′-CATGTTCGTCATGGGTGTGAA-3′,下游引物序列:5′-GGCATGGACTGTGGTCATGAG-3′。上机后反应程序如下:酶激活温度95℃(15 min)→扩增反应温度94℃(15 s)→退火温度65℃(30 s),总计40个循环→延伸温度温度70℃(34 s)。1.7 酶联免疫吸附实验(Enzyme linked immunosorbent assay,ELISA)
采用人IL-17和TGF-β ELISA试剂盒(Abclonal)检测三组中血浆IL-17及TGF-β的浓度。按试剂盒操作说明检测,在iMark酶标仪(美国BIO-RAD公司)上测定OD450值,绘制标准曲线,计算样品浓度。
1.7 统计分析
使用统计软件SPSS 17.0进行统计分析,患者一般资料中的计量资料使用均数±标准差表示,计数资料以百分比表示,其中身高、年龄、体重等计量资料采用独立样本t检验,性别和ASA分级等计数资料采用卡方检验和秩和检验。多组间比较采用单因素方差分析(one-way AVONA),多重比较采用SNK法,P<0.05为差异有统计学意义。
2 结果
2.1 肺癌完全性切除术改变手术后患者外周血中Th17/Treg细胞百分比
肺癌患者术前组(Day 0)外周血中Th17细胞(图1A和B)(P<0.01)和Treg细胞百分比(图1C和D)(P<0.05)均高于健康对照组(Control)。此外,手术患者术后三天组(Day 3)与术前组(Day 0)相比,Th17细胞百分比下降(图1A、B)(P<0.01),而Treg细胞百分比明显增加(图1C和D)(P<0.01)。
2.2 肺癌完全性切除术影响肺癌患者PBMC中RORγt和Foxp3的表达
肺癌患者术前组(Day 0)与健康对照组相比,RORγt和Foxp3的mRNA水平均增高(图2A和B)(P<0.01)。肺癌患者术后三天组(Day 3)与术前组(Day 0)相比,RORγt表达减少(图2A)(P<0.01),而Foxp3的表达增加(图2B)(P<0.01)。
2.3 肺癌完全性切除术影响肺癌患者血浆中IL-17和TGF-β1的表达
通过ELISA法检测发现,肺癌患者术前组血浆中IL-17和TGF-β1的水平高于健康对照组(图3A,B)(P<0.01)。此外,与术前组相比较,患者术后3天组血浆IL-17的水平降低(图3A)(P<0.01),然而血浆TGF-β1的水平明显增高(图3B)(P<0.01)。
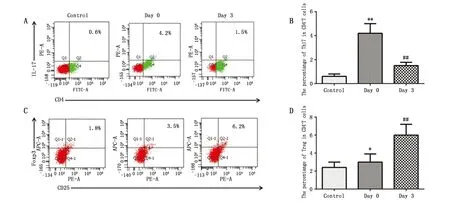
图1 肺癌完全性切除术对外周血中Th17和Treg细胞百分比的影响Figure 1 Effects of lung cancer resection on the percentages of Th17 and Treg cells in the peripheral blood of patientsNote:A.Representative diagram of the percentage of Th17 in healthy controls and patients before surgery(Day 0)or Day 3;B.Graph shows the percentage of Th17 cells;C.Representative diagram of the percentage of Treg cells in healthy controls and patients before surgery(Day 0)or Day 3;D.Graph shows the percentage of Treg cells.* P<0.05,** P<0.01,when compared with the control group;# P<0.05,when compared with the Day 0;## P<0.01,when compared with the Day 0.
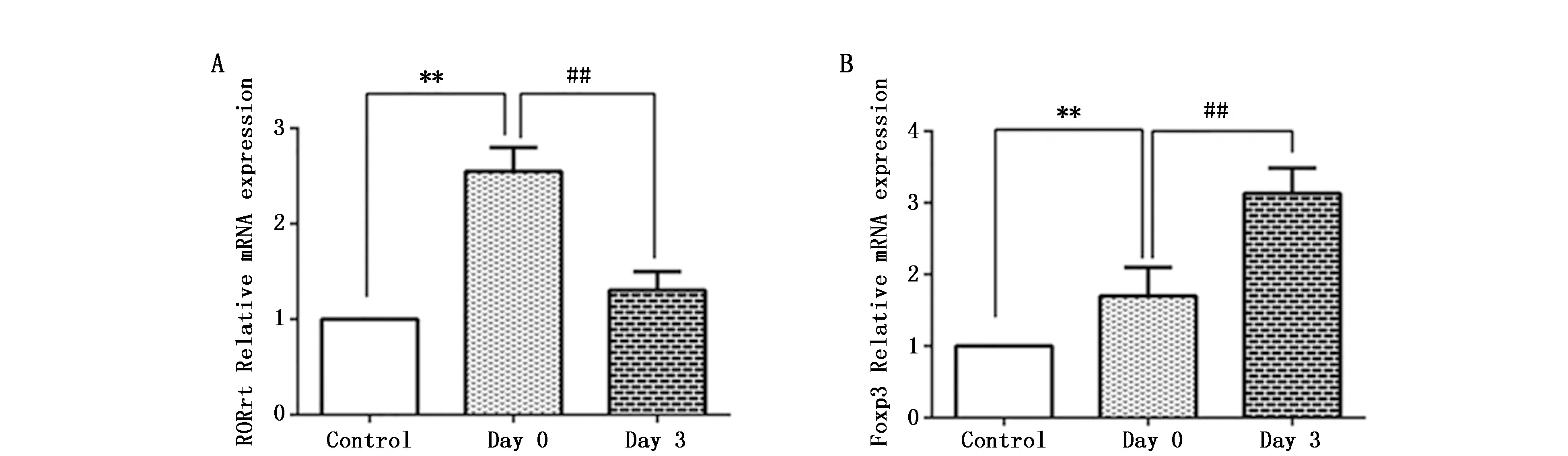
图2 肺癌完全性切除术对患者PBMC中RORγt和Foxp3的影响Figure 2 Effects of lung cancer resection on the expression of RORγt and Foxp3 in PBMCNote:A.Expression of RORγt in the three groups;B.Expression of Foxp3 in the three groups.* P<0.05,** P<0.01,when compared with control group;#P<0.05,## P<0.01,when compared with Day 0.
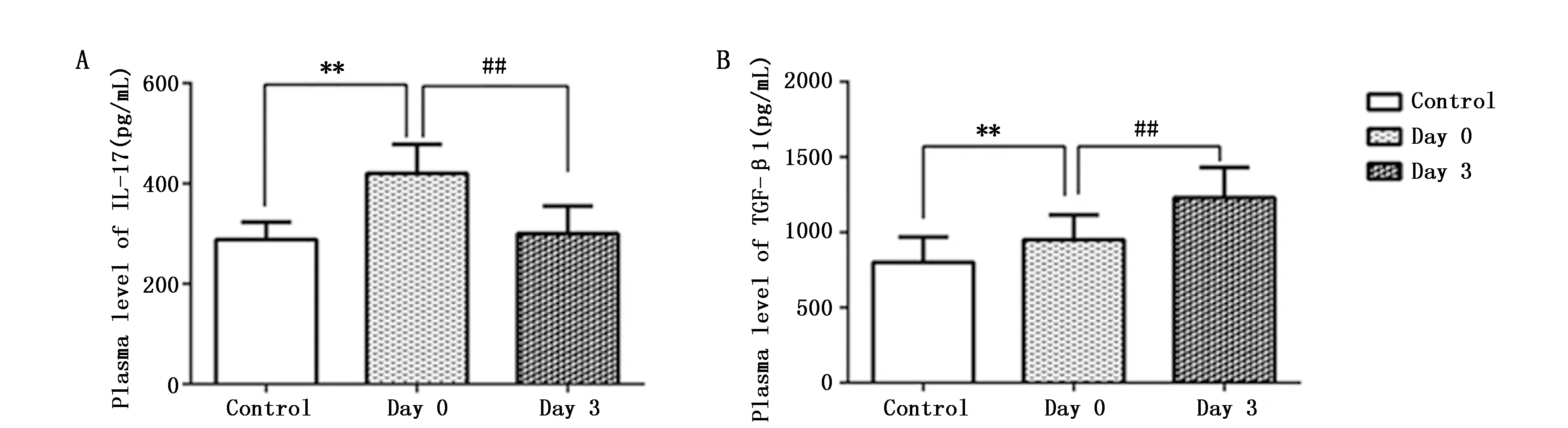
图3 肺癌完全性切除术对患者血浆中TGF-β1和 IL-17的影响Figure 3 Effects of lung cancer resection on the plasma levels of tumor growth factor(TGF)-β1 and interleukin(IL)-17Note:A.Plasma level of IL-17 in the three groups;B.Plasma level of TGF-β1 in the three groups.* P<0.05,** P<0.01,when compared with control group;#P<0.05,## P<0.01,when compared with Day 0.
3 讨论
肺癌是全球癌症的第一原因,也是癌症的第一死因。手术切除仍然是治疗肺癌的一线治疗方法,但手术本身导致的术后免疫抑制可以促进肺癌的复发转移,因此深入研究手术切除对肺癌患者术后免疫抑制的影响,并寻找新的可运用于临床的治疗策略,是提高患者临床受益的迫切需要。
手术创伤能触发机体发生复杂的宿主反应,它既干扰固有免疫反应,又干扰适应性免疫反应,诱导相关细胞和促炎、抗炎细胞因子发生短暂性的变化,从而造成机会性感染和创伤后并发症增加[10-11]。创伤后免疫失衡可导致脓毒症和多器官功能障碍,对抗抗肿瘤免疫反应,促进肿瘤患者的复发和转移。因此,全面理解免疫应答的活化和变化对于预防创伤后并发症的发生发展以及改善创伤后的不良临床后果至关重要。迄今为止,手术创伤相关并发症的确切机制仍未被阐明。然而,细胞介导的免疫抑制被公认对于创伤后并发症的发展至关重要。其中,CD4+T细胞应答的改变在细胞介导的免疫抑制中发挥关键性作用,主要包括Th1/Th2平衡向Th2漂移,同时伴随Th1功能的丧失和Treg细胞数量的上调[12]。
近年来,有研究表明严重的胸部创伤和创伤后败血症会使得Th17/Treg失衡[13-14]。但是,肺癌完全性切除术对肺癌患者术后Th17/Treg细胞平衡的影响尚未被阐明。本研究结果显示,在接受肺癌完全性切除术后的患者外周血中,Th17细胞的百分比下降,而Treg细胞的百分比上调。同时,血浆IL-17的表达水平降低,而血浆TGF-β1的表达水平增高。ROR-γt是Th17细胞特异性的转录因子,在初始辅助性T细胞中诱导IL-17基因的转录。Th17细胞百分比在ROR-γt-缺陷型小鼠中明显降低[15]。同时,Treg细胞的特异性转录因子是Foxp3,并且已经有研究表明TGF-β依赖性信号转导途径可以促进初始T细胞中的Foxp3的表达[16]。因此,本研究也采用RT-PCR法检测了ROR-γt和Foxp3的表达。结果表明,肺癌患者术后与术前相比,ROR-γt的表达降低,Foxp3的表达升高,以上结果均表明肺癌完全性切除术带来的手术创伤可能导致Th17/Treg平衡向Treg方向漂移。这种变化抑制了机体的抗肿瘤免疫,并可能促进肿瘤的复发和转移。
导致手术创伤后Th17/Treg失衡的原因包括很多,首先,细胞因子微环境是Th17/Treg平衡的主要决定因素之一。TGF-β1是由Treg分泌的特征性细胞因子,可促进Treg的分化[15]。然后由Treg细胞分泌产生的TGF-β1又可以为Treg的诱导产生提供强大的正反馈回路。在本研究中,我们发现手术促进了TGF-β1的产生,这可能是术后患者外周血Th17/Treg细胞平衡向Treg方向偏移的一个重要原因;最近有报道称共刺激分子如PD-1也是控制Th17和Treg细胞分化的关键因子[17]。PD-1通过与其配体PD-L1结合导致PD-1胞内段的酪氨酸发生磷酸化,PD-1内段免疫受体酪氨酸抑制基序(ITIM)与免疫酪氨酸转换基序(ITSM)发生磷酸化,随后抑制抗原信号向细胞核内传入,抑制T细胞信号传导,介导免疫抑制作用[18-19];并且,手术创伤同时会引起微循环功能障碍,导致乳酸水平升高[20]。乳酸水平的增加导致T细胞的代谢重整,损害了T辅助细胞的功能,但却不影响Treg细胞的功能,这一研究表明,手术创伤为Tregs提供了代谢优势[21]。此外,严重的创伤改变了常规树突状细胞(cDCs)分泌促炎细胞因子的能力,从而损害了其有效触发Th1和Th17细胞免疫应答的能力;还会诱导未成熟抗原呈递细胞如未成熟树突细胞(DC)和骨髓来源抑制细胞(MDSC)的百分比明显增加[22]。这些抗原呈递细胞损害了Th1和Th17细胞的功能,并可促进Treg细胞的功能,这也可能是手术创伤中Th17/Treg失衡的潜在机制[23]。
此外,越来越多的证据表明,Th17和Treg细胞在肿瘤的发生、发展和转移中表现出复杂和有争议的作用[19,24]。我们的研究也发现,肺癌患者外周血中的Th17和Treg细胞的百分比与健康对照者相比均增高,与以往的文献报道一致,可能的原因主要有,肺癌患者相比较健康对照者IL-17A、IL-23、IL-1 β以及RORC的血浆蛋白水平和mRNA分子水平均增高,这些增高了的细胞因子和特异性转录因子会明显促进Th17细胞的分化[25];肺癌患者相比较健康对照者TGF-β以及Foxp3表达水平也增高,而这些细胞因子及转录因子的过表达会促进Treg细胞的分化[26]。
综上所述,接受肺癌完全性切除术后的患者外周血Th17/Treg细胞平衡向Treg方向偏移,可使得外科手术患者术后的免疫功能处于抑制状态,可能会促进或加速肿瘤的复发与转移,因而下一步对肺癌完全性切除术后Th17/Treg失衡进行深入的机制研究有助于寻找治疗靶点以改善术后Th17/Treg失衡,对肺癌患者的预后有重要的临床意义。

