人源多菌株益生菌发酵条件的研究
印伯星,瓦云超,黄玉军,徐广新,顾瑞霞
(1.扬州大学,江苏扬州225009;2.扬州大学江苏省乳品生物技术与安全控制重点实验室,江苏扬州225009;3.江苏省乳业生物工程技术研究中心,江苏扬州225004;4.扬州市扬大康源乳业有限公司,江苏扬州225004)
0 引 言
发酵乳具有独特的风味、丰富的营养物质和多种健康因子,广受各国消费者青睐,已成为乳制品中发展最快的产品之一。中国发酵乳市场每年保持着两位数的高速增长,增长率领跑全球,2017年产值已经超过1 000亿,预计2020年中国发酵乳市场规模将近2 000亿元[1]。发酵乳产品和品牌的竞争也日趋激烈,功能性发酵乳产品的研究与开发将成为下一阶段乳制品发展的重点。
发酵乳品质在很大程度上取决于发酵剂的质量,并且其功能特性更加依赖于发酵菌株的益生特性。因此,在发酵乳生产前必须根据发酵乳的不同种类和生产条件的差异选定适宜菌种预先制备相应的发酵剂。其次,在保障发酵乳具有良好口感和风味的同时,还应保持发酵乳制品中存在较高的活菌数以保证其进入体内发挥益生作用。因此,新型发酵乳制品开发的核心将是优良菌株筛选、高活性发酵剂制备、新型发酵乳制备技术的研究[2]。
选用 L.rhamnosus LV108、L.casei grx12 和 L.fer⁃mentum grx08是实验室从3160株分离自长寿地区人群体内的3株具有较好的耐酸、耐胆盐、人工胃肠液等特性。仅以3株人源乳杆菌组合制备发酵乳,旨在确定3株菌株复配比例及优化发酵乳制备工艺,为进一步研究开发具有降胆固醇的功能特性的人源益生菌发酵乳提供基础数据。
1 材料与方法
1.1 菌株与材料
本实验所选用的L.rhamnosus LV108、L.casei grx12和L.fermentum grx08均由扬州大学江苏省乳品生物技术与安全控制重点实验室提供。
MRS液体、固体培养基,12%脱脂乳培养基,生理盐水,氢氧化钠(分析纯)。
1.2 主要仪器与设备
HH-6恒温水浴锅,JF-SX-500全自动灭菌锅,日立7020全自动生化分析仪,Legend mach1.6R高速冷冻离心机,SPX-150BSH生化培养箱,CAR/PDMS75μ m萃取纤维头,Trace DSQ气相色谱-质谱联用仪,Milli-Q Direct 8超纯水系统,SW-CJ-1F单人双面工作净化台,GYB60-08高压均质机,BS2000S电子天平,FE20pH计,TMS-Pro质构仪。
1.3 方法
1.3.1 菌种的活化
将冻存于-80℃冰箱的实验菌株接入MRS液体培养基中,37℃恒温培养24 h,革兰氏染色镜检是否有杂菌。确定无杂菌后,活化三代用于后续试验。
1.3.2 人源乳酸菌益生特性测定
对菌株的耐酸能力、耐胆盐能力、耐抗生素能力、抑菌能力、疏水性、黏附性、甘油三酯降解能力及胆固醇降解能力等安全指标和功能性指标进行测定,方法参照作者所在实验室的测定方法[3-5]。
1.3.3 不同混合菌株发酵特性
将脱脂乳粉复原成12%(w/v)的脱脂乳,放置30 min使蛋白质充分复水后分装每个三角玻璃小瓶100 mL(平行样5个),95℃灭菌5 min,冷却至37℃左右,分别以 1∶0∶0、0∶1∶0、0∶0∶1、1∶1∶1、2∶1∶1 接种 L.rham⁃nosus LV108、L.casei grx12和L.fermentum grx08,制成乳酸菌脱脂乳发酵剂进行发酵乳试验。每2 h取样测定其酸度、黏度、游离氨基酸数值,连续测定24 h。将实验菌株按3%接种至脱脂乳培养基,42℃恒温培养并记录凝乳时间。
1.3.4 理化指标测定
酸度测定:参照国标GB5413.34-2010[6]的方法,用0.10 mol/L NaOH标准溶液进行滴定。
黏度测定:参照栾少萌[7]的方法进行测定。
游离氨基酸测定:样品采用H.M.Abu-tarboush的处理方法;游离氨基酸测定采用Frank.C.Church等[8]建立的邻苯二甲醛(OPA)法。
活菌数测定:参照陈廷续[9]方法,无菌条件下吸取样品5 mL置于灭菌三角瓶内,加入45mL灭菌水,振荡5 min制成1∶10稀释液,随后进行梯度稀释到10-6~10-8左右,分别在做10倍递增稀释,选取不同稀释度稀释液1 mL置于灭菌平皿中,注入30 mL培养基(同时做培养基空白对照);待琼脂凝固后,翻转平板,置于37℃温箱中进行培养48 h左右,选取菌落数在30~300的平板进行计数。随机挑取5个菌落数进行革兰氏染色,显微镜进行复查,排除杂菌。
1.3.5 人源乳酸菌发酵乳工艺优化
根据Box-Behnken试验设计原理,本研究在前期单因素实验的基础上,以活菌数、pH测定和冷藏后发酵乳状态为响应值对接种量(2%、3%、4%、5%、6%)、蔗糖添加量(5%、6%、7%、8%、9%)、发酵温度(33℃、35℃、37℃、39℃、41℃)与固形物含量(11%、12%、13%、14%、15%)4个因素进行分析。
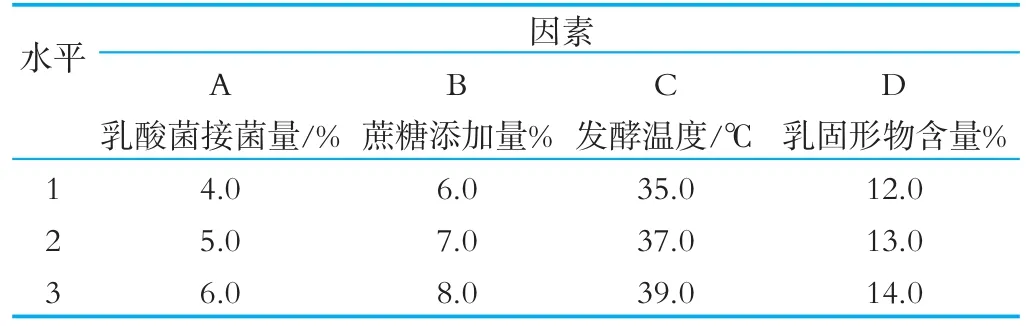
表1 人源乳酸菌发酵乳配方因素水平表
1.3.6 质构测定
测试模式为compression,测试前下降速度为1.0 mm/s,测试速度为1.0 mm/s,测试后速度为10.0 mm/s,测试距离为30 mm,采用A/BE探头,直径40 mm[10]。
1.3.7 风味物质测定
样品预处理:固相微萃取法;GC-MS分析色谱条件:色谱柱,PEG-20M柱(30m×0.25mm×0.25I×m),升温程序(初始温度36℃,以4℃/min升至120℃,保持4 min随后以10℃/min升至230℃,保持8 min载气(流速0.8 mL/min),进样温度为250℃,
质谱条件:电子能量70 eV,离子化电流200 I×A,离子源温度200℃,电子倍增电压350 V[11]。
2 结果与讨论
2.1 人源乳酸菌益生特性
对分离得到的人源乳酸菌进行了体外功能益生特性研究,其中获得了3株益生特性良好且对甘油三酯和胆固醇具有降解作用的乳酸菌株,具体如表2所示。
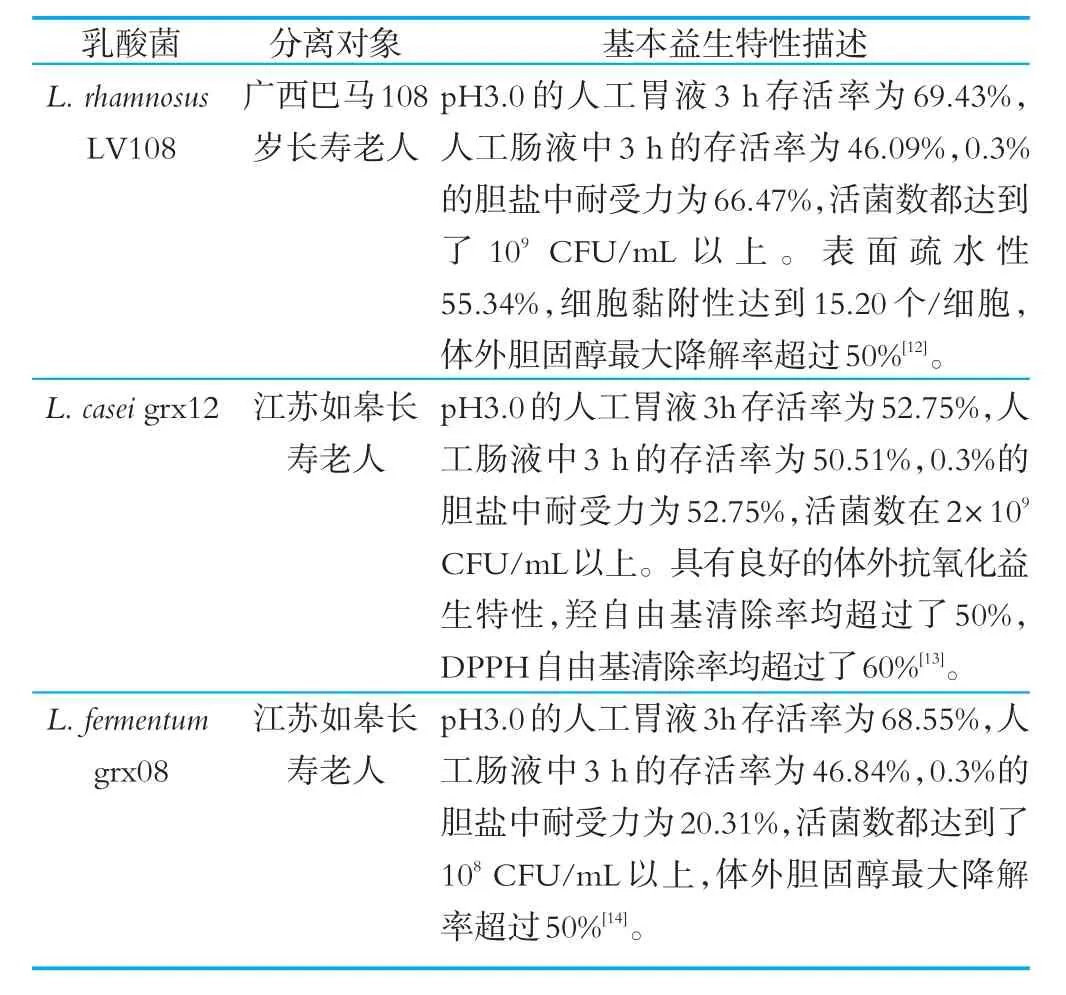
表2 3株益生特性良好的乳酸菌
2.2 混合菌株发酵特性测定
2.2.1 人源乳酸菌产酸特性
酸度的测定主要监测不同混合乳酸菌的产酸能力及后酸化情况,分别对使用不同人源乳酸菌组别制成发酵乳产酸情况进行测定,结果如图1所示。
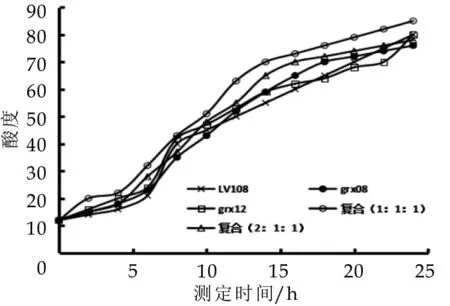
图1 不同乳酸菌发酵过程中酸度变化
由图1发现,L.casei grx12菌株酸度在22 h左右仍有跳跃性增长,L.fermentum grx08酸度随时间的变化呈现先急速增加后缓慢增长的趋势,L.rhamnosus LV108、混合乳酸菌(1∶1∶1)和混合乳酸菌(2∶1∶1)酸度均随测定时间而增加,且在凝乳后缓慢增长。
跟踪测定3 d后,各组发酵乳酸度发现,混合乳酸菌(2∶1∶1)制备的发酵乳酸度上升3.5 °T,混合乳酸菌(1∶1∶1)制备的酸乳上升4.2 °T,LV108后酸化较弱仅上升2.1°T,L.fermentum grx08和L.casei grx12则分别上升了3.5°T和5.3°T,这可能由于菌株中的脲酶能够分解尿素形成氮,从而有效减缓后酸化[15]。由此可看出,各组发酵乳的后酸化程度均不高,可作为生产发酵剂使用。
2.2.2 人源乳酸菌产黏特性
对使用不同人源乳酸菌组别制成发酵乳测定其黏度,结果如图2所示。
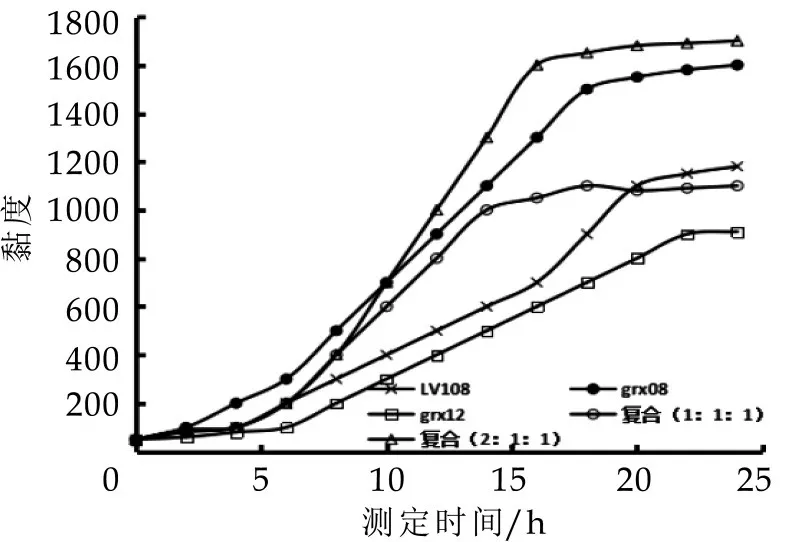
图2 不同乳酸菌发酵乳发酵过程中黏度变化
选择产高黏度发酵剂既可提高产品在生产过程中经泵运输时的抗剪切作用,也可提高产品拉丝感及醇厚的口感。由图2可看出,不同人源乳酸菌组别发酵剂的黏度随测定时间的延长先增加后缓慢变化,但最大黏度差异较大,其变化范围在0.9 Pa·s-1.6 Pa.s。混合乳酸菌(2∶1∶1)发酵剂黏度最高为1.6 Pa·s,grx12黏度则最低为0.9 Pa·s,而grx08、LV108、混合乳酸菌(1∶1∶1)发酵剂的黏度分别为1.5 Pa·s、1.1 Pa·s和1 Pa·s。除grx12外,其它几组发酵剂黏度均高于1 Pa·s,混合乳酸菌(2∶1∶1)发酵剂黏度高于单一发酵菌株,这主要由于不同菌种间的共生关系能够刺激菌株的产黏特性[16]。同时,多菌株共同发酵过程中胞外多糖的组分不同,会直接影响酸乳的组织状态。因此,混合乳酸菌(2∶1∶1)可以优先作为发酵乳发酵剂。
2.2.3 人源乳酸菌蛋白水解能力
对使用不同人源乳酸菌组别制成发酵乳测定游离氨基酸,结果如图3所示。
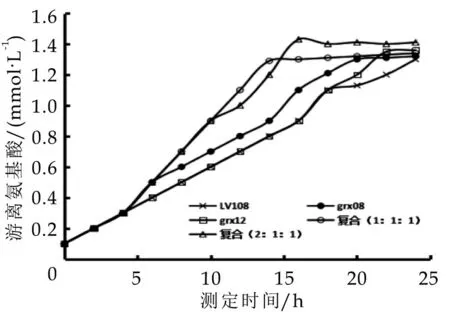
图3 不同乳酸菌发酵过程中氨基酸含量变化
由图3可以看出,不同人源乳酸菌组别发酵剂的蛋白水解能力差异较大,且随时间变化呈现先继续增加后稳定的趋势,其中grx08游离氨基酸含量最低为1.21 mmol·L-1,而 grx12 含量为 1.35 mmol·L-1,LV108含量为1.13 mmol·L-1。混合乳酸菌(1∶1∶1)发酵剂和混合乳酸菌(2∶1∶1)发酵剂的游离氨基酸含量与单一菌株相差不显著,分别为1.29和1.43 mmol·L-1,这可能由于混合菌株生长过程中消耗了部分氨基酸[17]。
2.2.4 人源乳酸菌贮藏期内活菌存活率
本研究产品属于低温活性发酵乳制品,产品活菌数是考量产品品质的一个重要因素,对使用不同人源乳酸菌组别制成的发酵乳测定3 d和21 d后的产品活菌数值。结果如表3所示。
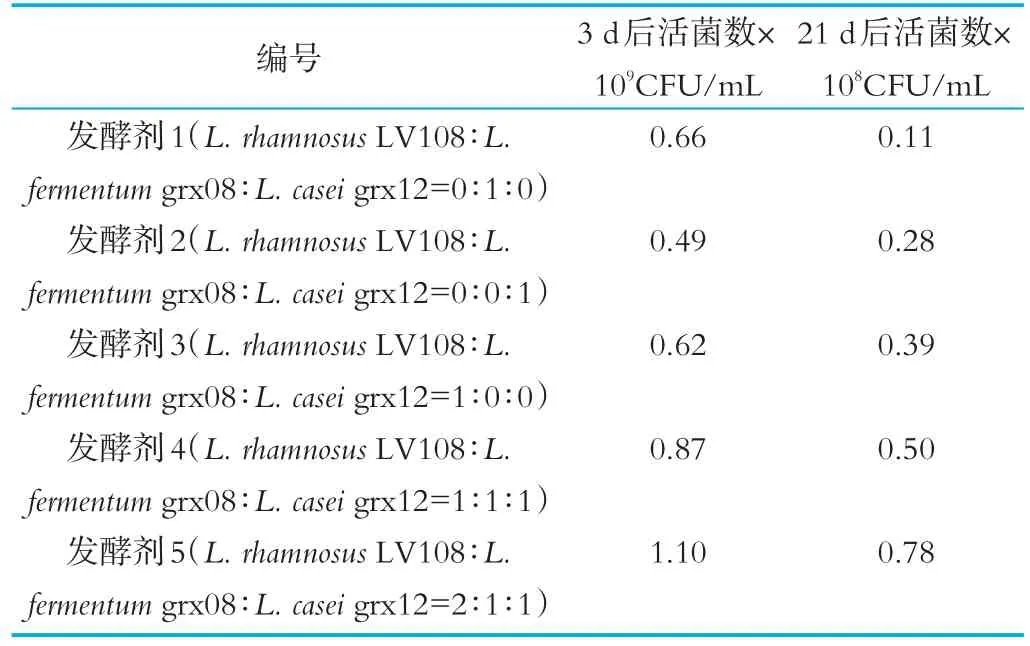
表3 单一及混合乳酸菌发酵乳贮藏过程中的活菌数变化
由表3可以看出,不同组合发酵剂在活菌数达到最大值后会随着储存时间的延长而减少,且呈显著性差异。其中发酵剂5的活菌总数3 d后仍高达1.10×109CFU/mL,这可能是该发酵温度下,混合乳酸菌具有良好的共生关系,也可能是某些代谢产物刺激乳酸菌生长繁殖。另外,21 d后发酵剂5的活菌数仍然高达0.78×108CFU/mL,表明混合人源乳酸菌具有较强的稳定性。且该发酵剂制备发酵乳活菌数显著高于国标GB19302中关于乳酸菌含量要达到1×106CFU/mL的要求。
综合以上研究发现,混合乳酸菌(2∶1∶1)发酵时间适当、后酸化较弱、黏度较强、游离氨基酸较多且产品活菌数高,混合乳酸菌(2∶1∶1)更适用于人源乳酸菌发酵乳的制备发酵剂。
2.3 人源乳酸菌发酵乳制备条件优化
根据单因素实验的实验结果,以混合乳酸菌(2∶1∶1)作为人源乳酸菌发酵乳发酵剂,选择接种量、发酵温度、乳固形物含量及蔗糖添加量作为实验因素,设计正交实验,并记录每组乳酸菌发酵乳活菌数量作为评价指标,并用数据分析软件对正交试验结果进行直观和极差分析,结果如表4所示。
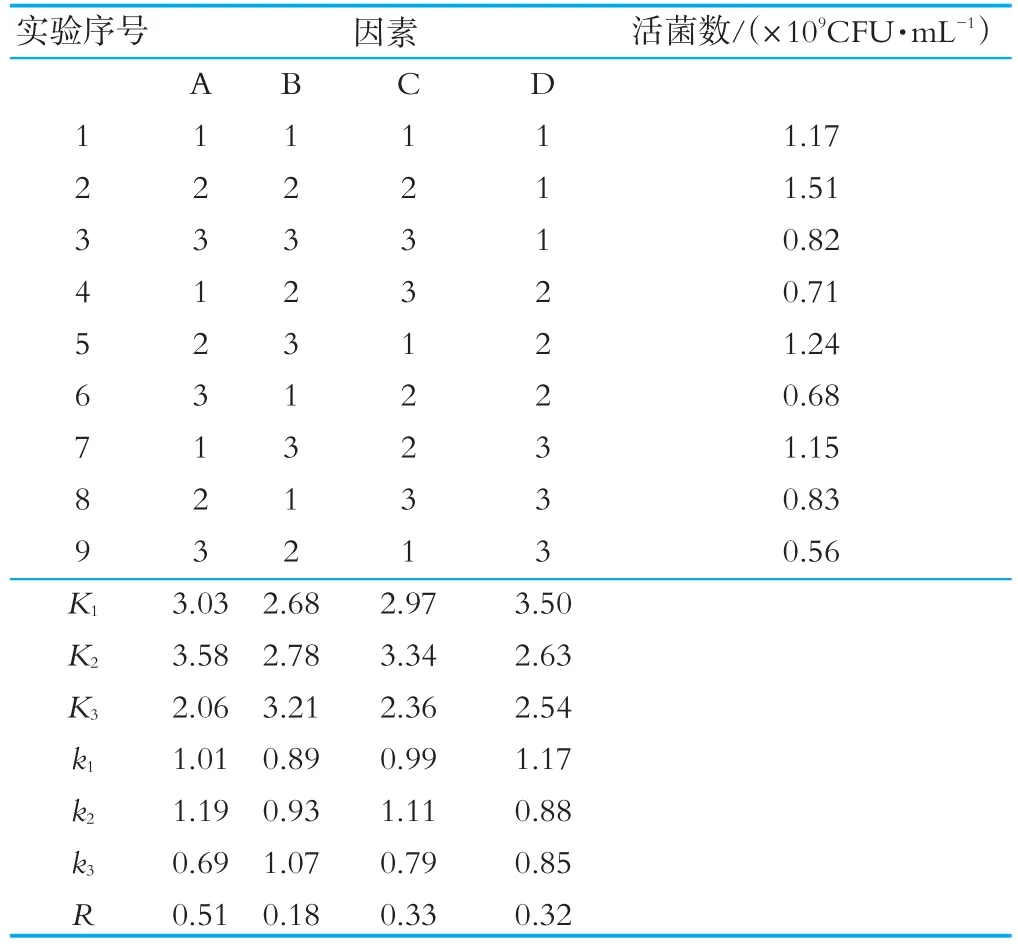
表4 混合乳酸菌发酵乳正交实验结果
由表4可知,发现对混合乳酸菌发酵乳活菌数量影响程度顺序依次为A>C>D>B。因此,选定A2B3C2D1,即混合乳酸菌接种量为5.0%,蔗糖添加量为8.0%,发酵温度为37℃,乳固形物含量为12.0%作为混合乳酸菌发酵乳制备条件。
2.4 人源乳酸菌发酵乳风味和质构特性
2.4.1 人源乳酸菌发酵乳风味物质
以混合乳酸菌(2∶1∶1)作为发酵乳发酵剂,根据最佳工艺制作发酵乳,同时制作普通酸牛奶作为对照,利用顶空SPME GC/MS测定样品挥发性风味物质,结果如表5所示。
比较普通乳酸菌制备的发酵乳和混合乳酸菌制备的发酵乳中挥发性物质种类可以发现,普通发酵乳中检测到的挥发性物质种类较少,为26种,而人源乳酸菌制备的发酵乳中检测到的挥发性物质种类为41株。其中作为发酵乳特征风味物质的乙醛和双乙酰含量,人源乳酸菌制备的发酵乳的含量分别为25 ug/g和26 ug/g,是普通发酵乳的3倍左右,这就使其特征风味优于普通发酵乳。另外,酸类物质对发酵乳风味强度影响较大,人源乳酸菌制备的发酵乳中己酸、乙酸、辛酸等含量显著高于普通发酵乳。其中,乙酸具有淡淡的酸味、辛酸具有清香、己酸有油脂味,其它的不饱和脂肪酸具有果香和乳香味[18]。

表5 普通酸奶和混合乳酸菌发酵乳主要挥发性风味物质
2.4.2 多菌株人源乳酸菌发酵乳质构特性
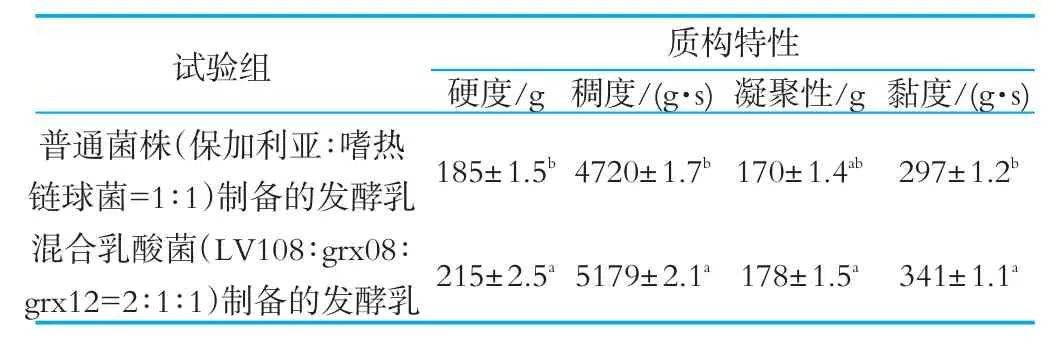
表6 普通酸奶和混合乳酸菌发酵乳质构特性
由表6可知,多菌株人源乳酸菌酸奶的质构特性显著优于空白组,其硬度、稠度、凝聚性和黏度分别为215 g、5179 g·s、178 g、341 g·s。这主要是因为多菌株人源乳酸菌酸奶组织状态细腻、均匀,且硬度、稠度、凝聚性和黏度都较适中,这也是容易被消费者接受的原因。
3 结论
混合乳酸菌(L rhamnosus LV108∶L.casei grx12∶L.fermentum grx08=2∶1∶1)发酵时间适当、后酸化较弱、黏度较强、游离氨基酸较多且产品活菌数高,以混合乳酸菌(2∶1∶1)为发酵剂的最佳发酵工艺为接种量为5.0%,蔗糖添加量为8.0%,发酵温度为37℃,乳固形物含量为12.0%。按此参数生产的多菌株人源益生菌酸奶组织细腻、质地均匀、酸甜适中、黏稠适度,具有较佳的风味。

